桂枝汤类方主要成分在大鼠体内药代动力学比较研究
陈莹蓉, 高成璐, 裘福荣, 马越鸣*
(1.上海中医药大学中药学院药理学教研室,上海201203;2.上海中医药大学附属曙光医院临床药代动力学实验室,上海 201203)
桂枝汤类方主要成分在大鼠体内药代动力学比较研究
陈莹蓉1, 高成璐2, 裘福荣2, 马越鸣1*
(1.上海中医药大学中药学院药理学教研室,上海201203;2.上海中医药大学附属曙光医院临床药代动力学实验室,上海 201203)
目的 比较桂枝汤类方不同配伍大鼠体内的药动学差异。方法 LC-MS/MS法分析大鼠灌服桂枝汤、桂枝加桂汤和桂枝加芍药汤后在大鼠体内的桂皮酸、马尿酸、芍药苷和甘草次酸血药浓度和药动学参数的差异,以及配伍对芍药苷肠菌代谢的影响。结果 大鼠灌服桂枝汤类方血浆中桂皮酸、马尿酸及甘草次酸的药动学参数经剂量校正后差异均无统计学意义。但桂枝加芍药汤中芍药苷的Cmax升高 (P<0.05)。大鼠灌胃芍药苷后其AUC和Cmax与给药剂量呈线性关系。配伍甘草对芍药苷肠菌代谢的抑制作用最强。结论 桂枝汤类方的不同配伍对芍药苷在大鼠体内的药动学有影响,其机理可能是抑制了芍药苷的肠菌代谢。
桂枝汤类方;LC-MS/MS;药代动力学;配伍;芍药苷;肠菌代谢
桂枝汤类方出自《伤寒论》,桂枝汤为基本方,由桂枝、芍药、甘草、生姜和大枣组成,具有解肌发表,调和营卫之功效,主治外感风寒表虚证,对体温、血压、肠蠕动和免疫功能等有双向调节作用[1],现代临床用于治疗感冒等[2];桂枝加桂汤为桂枝汤中桂枝剂量增加获得,具有温阳祛寒,平冲降逆之功效,是治疗“奔豚证”的方剂,现代临床用于治疗高血压、美尼尔氏综合征、充血性心力衰竭等[3];桂枝加芍药汤为桂枝汤中芍药剂量加倍获得,具有温脾和中,缓急止痛之功效,主治太阳病误下伤中,土虚木乘之腹痛,现代临床用于治疗黏连性肠梗阻、肠易激综合征等[4]。
桂枝汤类方的药味组成相同,配比不同,其功效和主治有一定的区别;桂枝和芍药配比的变化是否会引起3个方剂中主要成分体内药代动力学的差异,药动学过程的差异与功效与主治变化的关系如何,这几个问题都有待解决。目前对桂枝汤类方的药代动力学方面尚未见研究报道,未从药动学方面阐明其体内配伍规律和组方原理,故有必要对这3个复方的药动学进行比较研究。桂皮酸是桂枝的主要入血成分[5],马尿酸是桂皮酸的代谢产物,芍药苷是芍药的主要成分[6-7],甘草次酸是甘草的主要吸收形式,也是甘草的主要活性成分[8]。本研究采用LC-MS/MS法测定大鼠灌胃给予桂枝汤类方后体内主要成分桂皮酸、马尿酸、芍药苷和甘草次酸血药浓度的经时变化,并比较不同配伍中各成分药动学参数的差异,阐明桂枝汤类方的药代动力学规律和配伍影响,并进一步探讨配伍影响机制。
1 材料与方法
1.1 药品与试剂 桂皮酸 (纯度99%)、芍药苷(纯度99%)、甘草次酸 (纯度98%)和内标地西泮 (纯度98%)对照品购于中国药品生物制品检定所;马尿酸 (纯度98%)、内标1,8-二羟基蒽醌(纯度98%)对照品购自国药集团;90%芍药苷购于南京泽朗医药科技有限公司。桂枝、芍药、甘草、大枣和生姜均购自上海同济堂药业有限公司,经上海中医药大学生药教研室赵志礼教授鉴定为正品药材。甲醇为色谱纯 (Merck),其余试剂为分析纯,购自上海国药集团有限公司。实验用水为超纯水 (Millipore制备)。正常肠菌孵育液为自制(取正常大鼠新鲜粪便4 g,加入厌氧培养液[9]40 mL,搅匀后3 000 r/min离心10 min,上清即为正常肠菌孵育液)。
1.2 仪器 LC-MS/MS系统,包括Agilent HPLC系统及串联质谱系统API4000(AB公司,USA),工作软件为Analyst 1.4.2数据处理系统;TurboVap LV氮吹仪 (Caliper Life sciences);USC-502超声波清洗器 (上海波龙电子设备有限公司);TGL-16G-A型高速冷冻离心机 (上海安亭科学仪器厂)。
1.3 桂枝汤类方提取物的制备 桂枝和生姜分别用加5倍量水用蒸馏法提取2 h,收集挥发油,药渣与芍药、甘草和大枣按比例 (桂枝汤中桂枝9 g,芍药9 g,甘草6 g,生姜9 g,大枣12枚;桂枝加桂汤中桂枝为15 g;桂枝加芍药汤中芍药为18 g,其余四味药剂量不变)用10倍量水煎煮1 h,再用8倍量水煎煮1 h,浓缩,干燥,制成桂枝汤类方提取物细粉。桂枝用蒸馏法提取得挥发油后再用水煎煮,浓缩,干燥,制成提取物细粉,芍药和甘草直接用水煎煮,浓缩,干燥,制成提取物细粉。桂枝汤类方中各成分的量由HPLC法测得[10]。将桂枝和生姜挥发油按桂枝和生姜生药在桂枝汤类方中所占比例加入桂枝汤类方提取物细粉,用0.5%羧甲基纤维素钠溶液溶解得桂枝汤类方给药药液。
1.4 动物 清洁级SD大鼠36只,(230±10)g,雌雄各半,合格证号:SCXK 2008-0016,由上海中医药大学实验动物中心提供。
1.5 桂枝汤类方主要成分药代动力学比较
1.5.1 LC-MS/MS条件 Agilent TC-C18色谱柱 (5 μm,4.6 mm×150 mm);流动相为A(0.08%甲酸4 mmol/L醋酸铵)和B(甲醇),梯度洗脱:0→10 min,60%B→90%B,10→19 min,90%B;体积流量0.6 mL/min;柱温30℃。采用正负离子模式检测,多反应监测模式 (MRM)测定,正离子模式检测甘草次酸,负离子模式检测桂皮酸、马尿酸和芍药苷,正离子内标为地西泮,负离子内标为1,8-二羟基蒽醌。
1.5.2 血浆样品处理方法 血浆50 μL,加入内标120 ng/mL 地西泮、3 μg/mL 1,8-二羟基蒽醌各5 μL,加入1 mol/L 盐酸15 μL,涡旋1 min,加入乙 酸 乙 酯 0.25 mL,涡 旋 2 min,离 心(16 000 r/min)10 min,吸取上清液吹干,残渣用50μL 流 动 相 复 溶,涡 旋 1 min,离 心(16 000 r/min)10 min,取上清液20 μL进样。
1.5.3 方法学考察 血浆中内源性成分不干扰各给药组中待测成分的检测。空白血浆中在与马尿酸对照品相同保留时间处有检出质谱峰,经LC-MS/MS测定,判断该成分即为血浆中内源性的马尿酸。又经多份空白血浆样品测定,该峰每份空白血浆样品的峰面积相对小而恒定,在马尿酸最低定量限的20%以内,故不影响马尿酸的检测。
用加权最小二乘法 (w=1/c2)进行线性回归运算求得桂皮酸、马尿酸、芍药苷和甘草次酸的标准曲线回归方程,各成分低、中、高3个质量浓度的批内、批间精密度、准确度、提取回收率、基质效应和稳定性均符合生物样品分析要求。
1.5.4 动物实验 SD大鼠18只随机分为3组,每组单次灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤 (桂枝汤类方给药剂量见表1)。分别在灌胃后的0.017、0.25、0.5、1、2、4、6、8、12、24、36、48 h于眼球后静脉丛采血,肝素抗凝,9 600 r/min,4℃下离心制备血浆,血浆保存在-70℃中待测。血浆中各成分的质量浓度按上述方法进行测定,超出定量限的样品用空白血浆稀释后再检测。

表1 桂枝汤类方给药剂量Tab.1 Doses of three extracts given in three treatment groups
1.6 芍药苷单体药代动力学 SD大鼠18只随机分为芍药苷低、中、高3个剂量组,每组单次灌胃给予90%芍药苷11.1、22.2、44.4 mg/kg(分别含芍药苷单体10,20,40 mg/kg)。分别在灌胃后的0.083、0.25、0.5、1、2、4、6、8和 12 h于眼球后静脉丛采血,肝素抗凝,9 600 r/min,4℃下离心制备血浆,血浆保存在-70℃中待测。血浆中芍药苷的质量浓度按1.5项中的方法进行测定,超出定量限的样品用空白血浆稀释后再检测。
1.7 桂枝汤类方和相应的单味药及其组合对芍药苷肠菌代谢的影响
1.7.1 桂枝汤类方对芍药苷肠菌代谢的影响 将0.3 mL的芍药苷单体、芍药、桂枝汤、桂枝加桂汤和桂枝加芍药汤药液加入2.7 mL的正常肠菌孵育液中,依次为芍药苷单体组、芍药组、桂枝汤组、桂枝加桂汤组和桂枝加芍药汤组,每组重复3份,体系中芍药苷单体组芍药苷的终质量浓度为46.2 μg/mL,芍药组、桂枝汤、桂枝加桂汤组和桂枝加芍药汤组提取物粉末的终质量浓度为4.8、21.3、15.1和17.1 mg/mL(依次相当于生药20、97、111和104 mg/mL)。各组37℃水浴下0、8、10、12和24 h时取出0.2 mL孵育液,加入终止液0.2 mL终止反应。将各组孵育体系终芍药苷不同时间点的浓度以相对浓度形式表示 (芍药苷相对浓度=实际浓度/零时浓度×100%)。
1.7.2 桂枝汤类方中的单味药及其组合对芍药苷肠菌代谢的影响 将0.3 mL的肠菌缓冲液、桂枝、甘草和桂枝甘草药液加入2.4 mL的正常肠菌孵育液中,依次为空白对照组、桂枝组、甘草组及桂枝甘草组,每组重复3份。各组37℃水浴下预孵育1 h后加入0.3 mL的芍药药液,体系中芍药药液的终质量浓度为9.7 mg/mL(相当于生药40 mg/mL),桂枝、甘草及桂枝甘草的终质量浓度为1.1、5.4、及6.5 mg/mL(依次相当于生药 20、13.3及 33.3 mg/mL)。各组37℃水浴下0、8、10、12、24 h时取出0.2 mL孵育液,加入甲醇0.2 mL终止反应。将各组孵育体系终芍药苷不同时间点的浓度以相对浓度形式表示 (芍药苷相对浓度 =实际浓度/零时浓度×100%)。
1.8 数据分析 通过随行标准曲线来计算血浆中桂皮酸、马尿酸、芍药苷和甘草次酸的浓度。由DAS 2.0药代动力学软件分析血药浓度-时间数据,求算药代动力学参数 (实测值);为了消除给药剂量不同所带来的影响,将所有剂量相关的药动学参数进行剂量校正 (AUC/dose及Cmax/dose)。芍药苷肠菌代谢孵育液中芍药苷的浓度通过随行标准曲线求得,计算不同配伍药物组中芍药苷的相对AUC(0-24)。结果以均数 ±标准差 (±s)表示。用Power Model[11]评价芍药苷单体药动学参数AUC(0-∞)和Cmax与给药剂量间的线性关系。药动学参数及肠菌代谢相对AUC(0-24)均采用单因素方差分析-SNK检验,统计分析由SPSS 12.0软件进行,P<0.05被认为差异有显著意义。
2 结果
2.1 桂枝汤类方主要成分药代动力学 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中可检测到桂皮酸、马尿酸、芍药苷和甘草次酸,血药浓度-时间曲线见图1。在3个复方组中,桂皮酸均可迅速吸收进入体内,并代谢产生马尿酸,1 min即可检测到,并随时间呈动态变化,各组中桂皮酸的达峰时间为灌胃给药后的1 min,血浆中的浓度在6 h(桂枝汤组)、8 h(桂枝加桂汤组)和4 h(桂枝加芍药汤组)后低于最低定量限;马尿酸于灌胃给药后的15~30 min达峰,血浆中的浓度在24 h(桂枝汤组及桂枝加桂汤组)和12 h(桂枝加芍药汤组)后低于最低定量限。各组中芍药苷的达峰时间为15~60 min,血浆中的浓度在8 h后低于最低定量限。各组中甘草次酸的达峰时间为6~12 h,血浆中的浓度在48 h后低于最低定量限。
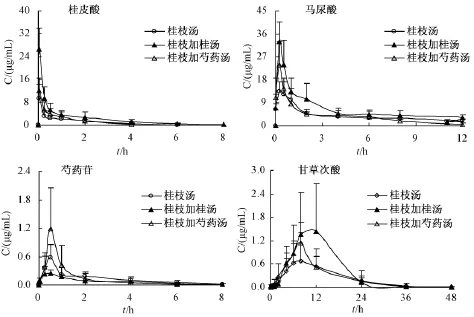
图1 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中桂皮酸、马尿酸、芍药苷和甘草次酸血药浓度-时间曲线 (±s,n=6)Fig.1 Plasma concentration-time curves of cinnamic acid,hippuric acid,paeoniflorin and glycyrrhetic acid after ig administration of Guizhi Decoction,Guizhi Decoction plus Cinnamomi Ramulus and Guizhi Decoction plus Paeoniae Radix in rats(±s,n=6)
各组中桂皮酸、马尿酸、芍药苷和甘草次酸的药代动力学参数见表2~5。在实测参数中,经单因素方差分析-SNK检验,与桂枝汤组和桂枝加芍药汤组比较,桂枝加桂汤组桂皮酸的Cmax和AUC及马尿酸的Cmax增高,但剂量校正后差异均无统计学意义。与桂枝汤组及桂枝加桂汤组比较,桂枝加芍药汤组中芍药苷的Cmax升高,剂量校正后,与桂枝加桂汤组比仍升高。对于甘草次酸而言,各组间的参数差异无统计学意义。
表2 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中桂皮酸药动学参数(±s,n=6)Tab.2 Pharmacokinetic parameters of cinnamic acid after i.g.administration of Guizhi Decoction,Guizhi Decoction plus Cinnamomi Ramulus and Guizhi Decoction plus Paeoniae Radix in rats(±s,n=6)

表2 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中桂皮酸药动学参数(±s,n=6)Tab.2 Pharmacokinetic parameters of cinnamic acid after i.g.administration of Guizhi Decoction,Guizhi Decoction plus Cinnamomi Ramulus and Guizhi Decoction plus Paeoniae Radix in rats(±s,n=6)
注:与桂枝汤比,aP<0.05,bP<0.01;与桂枝加桂汤比,cP<0.05,dP<0.01;*实测值;#剂量校正值;
参数 单位 桂枝汤 桂枝加桂汤 桂枝加芍药汤*AUC(0-t) μmol h/mL 0.047±0.014 0.115±0.047b 0.054±0.027d#AUC(0-t)/dose (μmolh/mL)/(mmol/kg) 0.22±0.07 0.34±0.13 0.27±0.11 T1/2 h 1.2±0.3 1.3±0.4 1.0±0.3 MRT(0-t) h 1.25±0.25 1.45±0.36 0.94±0.15 Tmax h 0.02±0.00 0.02±0.00 0.02±0.00 Cl/F L/(kg/h) 0.9±0.3 1.1±0.5 0.7±0.3 Vd/F L/kg 1.6±1.0 1.1±0.5 1.5±1.0*Cmax μmol/mL 0.06±0.034 0.18±0.047b 0.08±0.027d#Cmax/dose (μmol/mL)/(mmol/kg)0.29±0.16 0.51±0.14 0.39±0.14
2.2 芍药苷单体的药代动力学 大鼠灌胃给予芍药苷低、中、高三个剂量组后血浆浓度-时间曲线见图2。各组芍药苷药代动力学参数见表6。经单因素方差分析,高、中、低3个剂量组中芍药苷的T1/2和CL的差异无统计学意义;Power Model的评价结果如下:Cmax的相关系数为0.975,90%置信区间为 (0.986,1.203),判断区间为 (0.743,1.258);AUC(0-∞)的相关系数为 0.980,90%置信区间为 (0.841,1.005),判断区间为 (0.839,1.161)。Cmax和 AUC(0-∞)的置信区间均在判断区间内,在10~40 mg/kg的剂量范围内芍药苷大鼠单次给药后的药动学参数与剂量成线性关系。参数 单位 桂枝汤 桂枝加桂汤 桂枝加芍药汤
表3 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中马尿酸药动学参数(±s,n=6)Tab.3 Pharmacokinetic parameters of hippuric acid after i.g.administration of Guizhi Decoction,Guizhi Decoction plus Cinnamomi Ramulus and Guizhi Decoction plus Paeoniae Radix in rats(±s,n=6)

表3 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中马尿酸药动学参数(±s,n=6)Tab.3 Pharmacokinetic parameters of hippuric acid after i.g.administration of Guizhi Decoction,Guizhi Decoction plus Cinnamomi Ramulus and Guizhi Decoction plus Paeoniae Radix in rats(±s,n=6)
注:与桂枝汤比,aP<0.05,bP<0.01;与桂枝加桂汤比,cP<0.05,dP<0.01;*实测值;#剂量校正值;
参数 单位 桂枝汤 桂枝加桂汤 桂枝加芍药汤*AUC(0-t) μg h/mL 53±31 81±39 38±5#AUC(0-t)/dose (μg h/mL)/(mg/kg) 13.3±7.8 9.1±4.4 7.2±0.9 MRT(0-t) h 4.5±3.4 4.0±2.4 2.5±1.3 T1/2 h 2.8±2.0 2.2±1.4 2.0±1.2 Tmax h 0.50±0.27 0.29±0.10 0.25±0.00*Cmax μg/mL 17±3 36±7b 24±9d#Cmax/dose (μg/mL)/(mg/kg)4.2±0.7 4.0±0.8 4.5±1.7
表4 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中芍药苷药动学参数(±s,n=6)Tab.4 Pharmacokinetic parameters of paeoniflorin after i.g.administration of Guizhi Decoction,Guizhi Decoction plus Cinnamomi Ramulus and Guizhi Decoction plus Paeoniae Radix in rats(±s,n=6)

表4 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中芍药苷药动学参数(±s,n=6)Tab.4 Pharmacokinetic parameters of paeoniflorin after i.g.administration of Guizhi Decoction,Guizhi Decoction plus Cinnamomi Ramulus and Guizhi Decoction plus Paeoniae Radix in rats(±s,n=6)
注:与桂枝汤比,aP<0.05,bP<0.01;与桂枝加桂汤比,cP<0.05,dP<0.01;*实测值;#剂量校正值;
*AUC(0-t) μg h/mL 1.1±0.5 0.6±0.2 1.1±0.8#AUC(0-t)/dose (μg h/mL)/(mg/kg) 0.087±0.039 0.050±0.018 0.057±0.041 MRT(0-t) h 2.20±0.59 1.97±0.39 1.13±0.20bd T1/2 h 1.9±1.1 1.4±0.5 1.0±0.2 Tmax h 0.46±0.10 0.38±0.14 0.46±0.10 Cl/F L/kg/h 13±5 21±7 23±11 Vd/F L/kg 41±33 45±23 32±15*Cmax ng/mL 605±282 317±106 1 256±793ad#Cmax/dose (ng/mL)/(mg/kg) 50±23 26±9 63±40c
表5 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中甘草次酸药动学参数(±s,n=6)Tab.5 Pharmacokinetic parameters of glycyrrhetic acid after i.g.administration of Guizhi Decoction,Guizhi Decoction plus Cinnamomi Ramulus and Guizhi Decoction plus Paeoniae Radix in rats(±s,n=6)
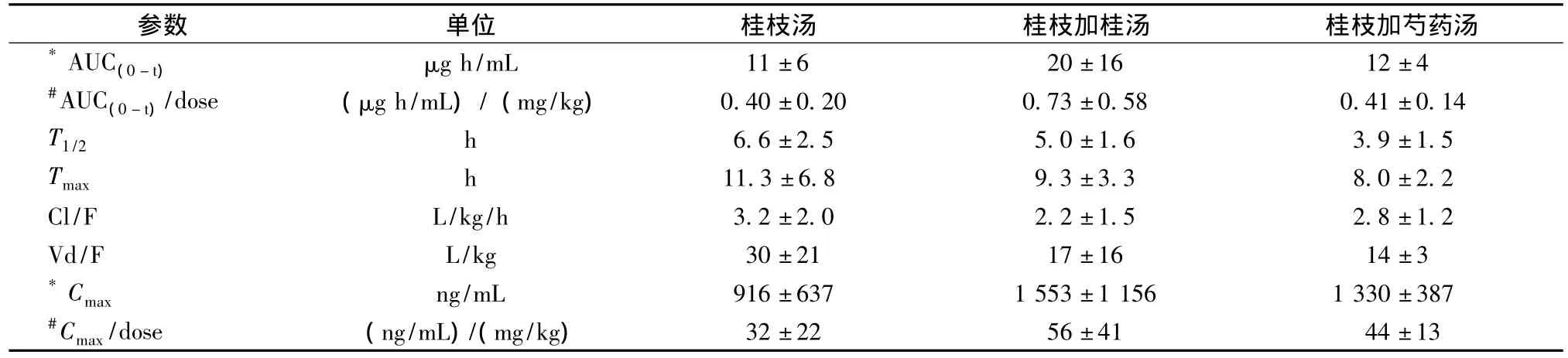
表5 大鼠灌胃给予桂枝汤、桂枝加桂汤和桂枝加芍药汤后血浆中甘草次酸药动学参数(±s,n=6)Tab.5 Pharmacokinetic parameters of glycyrrhetic acid after i.g.administration of Guizhi Decoction,Guizhi Decoction plus Cinnamomi Ramulus and Guizhi Decoction plus Paeoniae Radix in rats(±s,n=6)
注:*实测值;#剂量校正值;
参数 单位 桂枝汤 桂枝加桂汤 桂枝加芍药汤*AUC(0-t) μg h/mL 11±6 20±16 12±4#AUC(0-t)/dose (μg h/mL)/(mg/kg) 0.40±0.20 0.73±0.58 0.41±0.14 T1/2 h 6.6±2.5 5.0±1.6 3.9±1.5 Tmax h 11.3±6.8 9.3±3.3 8.0±2.2 Cl/F L/kg/h 3.2±2.0 2.2±1.5 2.8±1.2 Vd/F L/kg 30±21 17±16 14±3*Cmax ng/mL 916±637 1 553±1 156 1 330±387#Cmax/dose (ng/mL)/(mg/kg)32±22 56±41 44±13
2.3 桂枝汤类方和相应的单味药及其组合对芍药苷肠菌代谢的影响 芍药苷、芍药、桂枝汤类方和相应的单味药及其组合肠菌孵育体系中芍药苷0~24 h相对AUC的值见图3。与芍药苷单体组和芍药组比,类方中芍药苷的肠菌代谢均受到抑制(P<0.01);对于桂枝加芍药汤而言,体系中芍药苷的相对AUC(0-24)大于桂枝加桂汤组,差异有统计学意义 (P<0.01)。与空白组相比,甘草、桂枝+甘草均能抑制芍药苷的肠菌代谢 (P<0.01),桂枝对芍药苷肠菌代谢的抑制不明显。
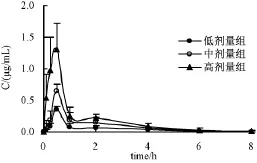
图2 大鼠灌胃给予芍药苷后血浆中芍药苷血药浓度-时间曲线(±s,n=6)Fig.2 Plasma concentration-time curves of paeoniflorin after intragastric administration in rats(±s,n=6)
表6 大鼠灌胃给予芍药苷后血浆中芍药苷药动学参数(±s,n=6)Tab.6 Pharmacokinetic parameters of paeoniflorin after intragastric administration in rats(±s,n=6)

表6 大鼠灌胃给予芍药苷后血浆中芍药苷药动学参数(±s,n=6)Tab.6 Pharmacokinetic parameters of paeoniflorin after intragastric administration in rats(±s,n=6)
参数 单位 剂量/(mg·kg-1)10 20 40 AUC(0-t) μg h/mL 0.40±0.05 0.78±0.09 1.49±0.08 AUC(0-∞) μg h/mL 0.43±0.06 0.82±0.11 1.51±0.09 MRT(0-t) h 1.9±0.6 1.6±0.3 1.5±0.3 T1/2 h 1.5±0.6 1.3±0.7 1.6±0.6 Tmax h 0.50±0.00 0.50±0.00 0.42±0.13 Cl/F L/kg/h 24±4 25±4 27±2 2 Vd/F L/kg 50±19 43±20 61±23 Cmax μg/mL 0.35±0.05 0.65±0.10 1.58±0.16
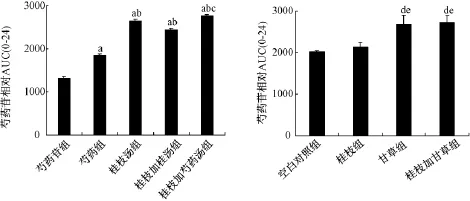
图3 芍药苷、芍药、桂枝汤类方及不同配伍药物肠菌孵育后芍药苷的0~24 h相对曲线下面积图(±s,n=3)Fig.3 Relative AUC(0-24)of paeoniflorin after incubation(±s,n=3)
4 讨论
桂枝汤类方作为临床广泛应用的一类中药复方,目前对其的报道多为药效学和临床应用研究,未有对其药代动力学方面的研究报道,对其有效成分的体内过程和动力学规律缺乏研究。桂皮醛和桂皮酸是桂枝的主要成分,桂皮醛是桂枝挥发油的主要成分,进入体内后迅速被氧化为桂皮酸,再进一步发生β-氧化,生成苯甲酸,在尿中以马尿酸的形式排泄[12,13]。前期研究表明,桂皮醛单体给药后在胃肠道已开始转化为桂皮酸,肝脏和血浆中未检测到桂皮醛,证明其在吸收入血之前已经在肝脏中转化为桂皮酸[5]。桂枝汤类方的药效成分对体温、血压等的调节作用均需进入中枢后起作用,故研究桂枝中主要入血成分桂皮酸及其代谢产物马尿酸的药动学过程十分必要。经过大鼠灌胃给予桂枝汤类方后体内成分的筛选,确定芍药苷和甘草次酸分别为臣药芍药和佐药甘草的检测成分。本研究用LC-MS/MS测定大鼠灌胃给予桂枝汤类方后体内主要成分桂皮酸、马尿酸、芍药苷和甘草次酸血药浓度的经时变化,并比较3个复方中各成分药动学参数的差异,阐明桂枝类方的药代动力学规律和配伍影响。
本研究结果表明与桂枝汤和桂枝加芍药汤组比,桂枝加桂汤组桂皮酸的Cmax和AUC升高,证明其体内暴露增加。桂皮酸为桂枝的主要入血成分,桂枝加桂汤中桂枝药量增加,旨在加强助阳平冲之力,用于治疗心阳虚弱,寒水凌心之奔豚[3]。推测桂枝加桂汤组桂皮酸体内暴露的增加将有助于该复方中桂枝药效作用的发挥。
桂枝汤类方提取物细粉中桂皮酸、芍药苷和甘草酸的量有很大的不同[10],这种含有量上的差异是来源于药味用量及制备过程 (煎煮)。在本研究中,桂枝汤中桂枝和芍药均为7.4 g/kg,甘草为4.9 g/kg,而桂枝加桂汤中的桂枝根据原方加量到12.3 g/kg,桂枝加芍药汤中的芍药根据原方加量到14.8 g/kg。由于各给药组提取物中各成分的量以及各复方药味剂量的差异,导致各组中桂皮酸、芍药苷和甘草酸的给药剂量不一致。为了消除这种给药剂量上的不同所带来的影响,本研究中将所有剂量相关的药动学参数 (AUC及Cmax)均进行了剂量校正 (AUC/dose及Cmax/dose)。通过对各组中AUC/dose及Cmax/dose的比较本研究发现经剂量校正后,对于桂皮酸而言,各组Cmax和AUC的差异无显著性意义,证明配伍对桂皮酸体内过程的影响是体外的药味用量差异造成的,并非由复方中配伍药物的药动学相互作用引起。对于芍药苷而言,各组剂量校正后的药动学参数的差异仍有统计学意义,提示配伍对芍药苷的体内过程有影响。由于桂枝加芍药汤中芍药苷的量高于其他两方,为分析是否因非线性药动学的问题,本研究进行了10、20和40 mg/kg的3个剂量的芍药苷的药动学研究,结果表明为线性动力学,因此桂枝加芍药汤组芍药苷的在大鼠体内的Cmax的显著升高是由配伍引起的。现代药理研究表明,芍药苷具有镇痛、抗惊厥和解痉等作用,桂枝加芍药汤临床用于治疗黏连性肠梗阻、肠易激综合征等胃肠道疾病,推测与芍药苷舒张胃肠道平滑肌的作用有关。而与桂枝加桂汤比,芍药苷体内峰浓度的提高可能有利于其药效作用的发挥。
中药传统多为口服给药,药物进入机体后,常要发生氧化、还原、水解等多种化学反应,其中一个重要的代谢场所就在肠道,在肠菌的作用下,药物被代谢转化。因此,研究肠内菌群对中药苷类成分体内过程的影响具有十分重要的意义。芍药苷是芍药的主要有效成分之一,是一种单萜类糖苷化合物,可被肠菌代谢。为了阐明桂枝汤类方中芍药苷药动学差异的机制,本研究对桂枝汤类方中芍药苷的肠菌代谢进行了比较。通过研究发现桂枝汤类方中的药物配伍可抑制芍药苷的肠菌代谢,其中桂枝加芍药汤对芍药苷肠菌代谢的抑制作用大于桂枝加桂汤。桂枝加芍药汤中芍药苷在肠中的代谢减慢,导致肠道中芍药苷原形增多,芍药苷吸收入血增多,Cmax增高。进一步对桂枝、甘草和桂枝+甘草与芍药配伍后的肠菌代谢能力进行比较,结果配伍甘草对芍药苷的肠菌代谢抑制作用最强。
桂枝汤类方中甘草的功用有两方面:一为佐药,益气和中,合桂枝以解肌,合芍药以益阴;一为使药,调和诸药。甘草酸是甘草的主要成分,口服后可在消化管内被肠道细菌分解成为甘草次酸而被吸收,也可被肠道吸收在肝脏中被转化为甘草次酸[8]。本研究中各组甘草次酸于灌胃给药后15 min可检测到,吸收较快,但达峰时间较慢,为6~12 h,推测可能是由于甘草酸在体内转化成甘草次酸的过程推迟了甘草次酸的达峰;甘草次酸的消除较慢,给药后48 h仍能检测到,有利于药效作用的持续发挥。
[1]张保国,梁晓夏,刘庆芳.桂枝汤现代药效学研究[J].中国中药杂志,2007,32(7):557-561.
[2]Pan D W,Chen L G.Mathematical modeling of sign-and-symptom-oriented diagnostic procedure in traditional Chinese medicine based on the analytic hierarchy process:indications of Guizhi Decoction and its varieties in the Shanghanlun[J].Chin J Integr Med.2011,9(4):354-360.
[2]江怀筹.桂枝加桂汤的临床应用[J].实用中西医结合杂志,1998,11(6):518-519.
[3]唐建中.桂枝加芍药汤治疗粘连性肠梗阻27例[J].传统医药,2000,7(6):28.
[4]孔祥廉,林 棉,李 亮,等.新方桂枝芍药汤治疗肠易激综合征临床研究[J].中国中医急症,2005,14(3):221-222.
[5]Chen Y R,Ma Y M and Jia W.Pharmacokinetics and bioavailability of cinnamic acid after oral administration of Ramulus Cinnamomi in rats[J].Eur J Drug Metab Pharmacokinet,2009,34(1):51-56.
[6]王秋玲,王文全,魏胜利,等.不同加工方法对栽培和野生芍药中7种化学成分的影响研究[J].中国中药杂志,2012,37(7):920-924.
[7]Hwang Y H,Kim T,Cho W K,et al.Food-and gender-dependent pharmacokinetics of paeoniflorin after oral administration with Samul-tang in rats[J].J Ethnopharmacol,2012,142(1):161-167.
[8]Yang J,Zhou L,Wang J,et al.The disposition of diammonium glycyrrhizinate and glycyrrhetinic acid in the isolated perfused rat intestine and liver[J].Planta Med,2008,74(11):1351-1356.
[9]Hattori M,Shu Y Z,Shimizu M,et al.Metabolism of paeoniflorin and related compound by human intestinal bacteria[J].Chem Pharm Bull,1985,33(9):3838-3842.
[10]陈莹蓉,马越鸣,张 宁.桂枝汤类方化学成分含量研究[J].中成药,2010,32(6):112-116.
[11]Smith B P,Vandenhende F R,DeSante K A,et al.Confidence interval criteria for assessment of dose proportionality[J].Pharm Res,2000,17(10):1278-1283.
[12]Yuan J H,Dieter M P,Bucher J R.Toxicokinetics of cinnamaldehyde in F344 rats[J].Food Chem Toxicol,1992,30(12):997-1004.
[13]Sapienza P P,Ikeda G J,Warr P I,et al.Tissue distribution and excretion of14C-labelled cinnamic aldehyde following single and multiple oral administration in male Fischer 344 rats[J].Food Chem Toxicol,1993,31(4):253-261.
Pharmacokinetics of Guizhi Decoctions in rats
CHEN Ying-rong1, GAO Cheng-lu2, QIU Fu-rong2, MA Yue-ming1*
(1.Laboratory of Pharmacokinetics,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China;2.Laboratory of Clinical Pharmacokinetics,Shanghai Shuguang Hospital,Shanghai 201203,China)
AIMTo compare the differences of pharmacokinetics among Guizhi Decoctions.METHODS
LC-MS/MS was employed to analyze the plasma concentrations of cinnamic acid,hippuric acid,peoniflorin and glycyrrhetic acid in rats fed with Guizhi Decoction(Cinnamomi Ramulus,Paeoniae alba Radix,Glycyrrhizae Radix et Rhizoma,Zingiberis recens Rhizoma,Jujubae Fructus),Guizhi Decoction plusCinnamomi Ramulusand Guizhi Decoction plusPaeoniae Radix,respectively.The differences of pharmacokinetic parameters and the effect of peoniflorin on the intestinal flora metabolism were tested.RESULTSAfter dose correction,the pharmacokinetic parameters of cinnamic acid,hippuric acid and glycyrrhetinic acid showed no significant difference on Guizhi Decoctions,but paeoniflorin content in Guizhi Decoctionplus Paeoniae Radixincreased and showed a statistical difference with a dose-dependent relationship.The inhibitory effect of addingGlycyrrhizae Radix et Rhizomaon paeonifiorin metabolism presents the most in relation to the inhibition of intestinal flora metabolism.CONCLUSIONPharmacokinetics of peoniflorin were different among Guizhi Decoctions in rats.The inhibition of compatibility on the metabolism of paeoniflorin by intestinal flora contributed to the pharmacokinetic difference of paeoniflorin.
Guizhi Decoctions;LC-MS/MS;pharmacokinetics;compatibility;paeoniflorin;intestinal flora metabolism
R969.1
A
1001-1528(2013)04-0683-07
10.3969/j.issn.1001-1528.2013.04.011
2012-10-14
上海高校创新团队建设项目 (2009)、上海市教委重点学科建设项目 (J50303);重大新药创制项目 (2012ZX09303009-001)
陈莹蓉 (1984—),女,硕士,研究实习员,研究方向:中药药理学。Tel:(021)51322389,E-mail:chenyingrong2006@163.com
*通信作者:马越鸣,教授,博士生导师,研究方向:中药药代动力学。Tel:(021)51322200,E-mail:mayueming_117@126.com