亚麻分离蛋白提取工艺的研究
许光映 胡晓军 李 群 高忠东
(山西省农业科学院农产品加工研究所,太原 030031)
亚麻是我国主要油料作物之一,我国常年种植面积约57万公顷,年产量约47万吨,种植面积居世界第3位,产量居世界第2位[1]。亚麻籽含有40%左右的粗脂肪、1%左右的木酚素、10%左右的亚麻胶27%左右的膳食纤维和20%左右的蛋白质[1-5],亚麻籽已成为国内外学者研究功能食品的热点之一。亚麻籽作为一种高蛋白油料作物,其品种、产地、种植方式和气候均对其蛋白含量有影响[6-8]。此前,国内外报道亚麻分离蛋白是以脱脂亚麻籽或脱胶脱脂亚麻籽为原料,采用碱溶酸沉的方法提取。以脱脂亚麻籽为原料提取亚麻分离蛋白时,因为亚麻籽富含胶质干扰蛋白的分离和沉淀,提取的难度很大[9];用脱胶脱脂亚麻籽提取亚麻蛋白时,氮回收率有所提高,提取率约为42%,蛋白质的纯度到达89.37%[10-11],然而亚麻籽在脱胶后脱脂前需要耗费大量的能源进行干燥,该工艺各产品的生产成本较高,所以至今没有应用到工业生产中。本研究探讨以脱皮脱脂亚麻籽为原料,采用碱溶酸沉的方法提取亚麻分离蛋白,为提高亚麻籽脱皮脱脂后的副产品——亚麻籽仁粕的加工附加值,实现亚麻分离蛋白的产业化开发打下理论基础。
1 材料与方法
1.1 试验材料
亚麻籽:大同市福瑞康鑫科技有限公司。
1.2 试剂及仪器设备
1.2.1 试剂
石油醚:淄博市临淄东方红化工厂;氢氧化钠:莱州市兴泰化工有限公司;盐酸:常州市双良化工有限公司;硫酸、硫酸钾:连云港巨佳化工科技有限公司;硫酸铜:上海青凤化工厂;甲基红、溴甲酚绿:天津希恩思生化科技有限公司;硼酸:淄博锦熹硼酸厂。
1.2.2 仪器与设备
脱皮机:自制;HZS-HA水浴振荡器:哈尔滨市东明医疗仪器厂;旋转蒸发器:上海亚荣生化仪器厂;TD2102电子天平:余姚市金诺天平仪器有限公司;PHS-25型数显酸度计:杭州雷磁分析仪器厂;KDY-9820凯氏定氮仪:北京通润源机电技术有限公司;FD-3冷冻干燥机:北京博医康实验仪器有限公司;LXJ-ⅡB低速大容量离心机:上海精密仪器仪表有限公司;DHG-9140B电热鼓风干燥箱:上海申贤恒温设备厂;KDN-20消煮炉:郑州南北仪器设备有限公司;万能粉碎机:武义县屹立工具有限公司。
1.3 试验方法
1.3.1 分析测定方法
1.3.1.1 蛋白含量的测定
蛋白含量用凯氏定氮法(GB/T 5511—1985)测定。
1.3.1.2 蛋白提取率的测定[11]
蛋白提取率=分离蛋白中的蛋白质质量/脱胶脱脂亚麻仁粕中的蛋白质质量×100%。
1.3.2 原料预处理方法
亚麻籽经筛选除杂后,送入脱皮机分离为亚麻籽仁和亚麻籽皮[12],取一定量的亚麻籽仁加入料液比1∶5的石油醚脱脂,在20℃的水浴振荡器中提取3 h,经抽滤固液分离,重复2次,干燥固相,得脱皮脱脂亚麻籽仁粕。亚麻籽仁粕的蛋白质量分数为52.4%。
1.3.3 单因素试验
1.3.3.1 提取液pH对分离蛋白提取率和蛋白含量的影响
试验设6个处理,提取液 pH 分别是:7.5、8.5、9.5、10.5、11.5、12.5。每个处理取脱皮脱脂亚麻仁粕粉10 g放入三角瓶中,加入150 mL纯净水,用1 mol/L的NaOH调节至一定的pH,将三角瓶放入40℃水浴振荡器中,振荡提取90 min。提取结束后将混合液倒入离心管,在4 800 r/min条件下离心5 min,把上层液相移入三角瓶,用1 mol/L的HCl调节上层液相的pH至出现沉淀,在4 800 r/min条件下离心5 min,收取固相物,冷冻干燥、粉碎,即得亚麻分离蛋白,重复3次,结果取平均值。考察分离蛋白提取率和蛋白含量。
1.3.3.2 料液比对分离蛋白提取率和蛋白含量的影响
试验设 5个处理,料液比分别是:1∶10、1∶20、1∶30、1∶40、1∶50。每个处理取脱皮脱脂亚麻仁粕粉 10 g放入三角瓶中,加入一定量的纯净水,用1 mol/L的NaOH调节至pH 9.5,将三角瓶放入40℃水浴振荡器中,振荡提取90 min。提取完毕的后续处理方法及考察内容同 1.3.3.1。
1.3.3.3 提取温度对分离蛋白提取率和蛋白含量的影响
试验设5个处理,提取温度分别是:20、40、60、80、100℃。每个处理取脱皮脱脂亚麻仁粕粉10 g放入三角瓶中,加入300 mL纯净水,用1 mol/L的NaOH调节至pH 9.5,将三角瓶放入水浴振荡器调节至一定温度,振荡提取90 min。提取完毕的后续处理方法及考察内容同 1.3.3.1。
1.3.3.4 提取时间对分离蛋白提取率和蛋白含量的影响
试验设6个处理,提取时间分别是:60、90、120、150、180、210 min。每个处理取脱皮脱脂亚麻仁粕粉10 g放入三角瓶中,加入300 mL纯净水,用1 mol/L的NaOH调节至pH 9.5,将三角瓶放入40℃水浴振荡器中,振荡提取一定时间。提取完毕的后续处理方法及考察内容同 1.3.3.1。
1.3.4 正交试验设计
设提取液pH、料液比、提取温度、提取时间4个因素,每个因素设3个水平,开展L9(34)正交试验,正交试验设计见表1。根据单因素试验结果,取单因素试验中最佳的水平为第二水平;每个处理取脱皮脱脂亚麻仁粕粉10 g放入三角瓶中,提取完毕的后续处理方法同1.3.3.1。考察试验各处理的分离蛋白提取率、最佳工艺条件组合时蛋白提取率和分离蛋白的蛋白含量。

表1 正交试验因素与水平表
1.4 数据处理
应用DPS软件进行统计分析。
2 结果与分析
2.1 提取液pH对分离蛋白提取率和蛋白含量的影响
提取液pH对分离蛋白提取率和蛋白含量的影响见图1。提取液pH的变化改变了蛋白质的带电情况,直接影响蛋白质与蛋白质、蛋白质与溶液的相互作用,从而使蛋白质的溶解性发生了变化,进而影响对分离蛋白的提取率。在试验范围内,当提取液pH值从7.5增至9.5时,随着提取液pH的增加,分离蛋白提取率呈上升趋势;当pH值从9.5增加至12.5时,提取率则呈下降趋势。经统计分析,pH 9.5时的蛋白提取率与其他5个处理的蛋白提取率呈极显著差异(P<0.01),为提高分离蛋白提取率,提取液以pH 9.5 为宜。
分离蛋白的蛋白含量与提取率成正相关,当提取液pH 9.5时得到分离蛋白的蛋白含量与其他5个处理呈极显著差异(P<0.01)。

图1 提取液pH对分离蛋白的提取率和蛋白含量的影响
2.2 料液比对分离蛋白提取率和蛋白含量的影响
从图2可见,不同料液比对分离蛋白提取率的影响呈先上升后平缓趋势,当料液比从1∶10增加到1∶30时,分离蛋白提取率呈快速上升趋势;当料液比由1∶30增加至1∶50时,分离蛋白提取率呈平缓趋势。说明当料液比较小时,一方面在试验设定的时间内,部分蛋白还没有被溶解出来,另一方面在固液相分离时,固相中吸附了比较多的提取液。统计分析表明,料液比 1∶30、1∶40 和 1∶50 3 个处理之间的蛋白提取率差异不显著(P>0.05),料液比1∶30、1∶40和1∶50 3 个处理与料液比 1∶10、1∶20 2 个处理的蛋白提取率呈极显著差异(P<0.01),一般地料液比越高提取成本越大,因此,提取料液比采用1∶30为宜。
不同料液比对分离蛋白的蛋白含量影响趋势与对提取率的影响趋势相似,提取料液比为1∶30时,提取获得分离蛋白的蛋白含量最高。

图2 料液比对分离蛋白的提取率和蛋白含量的影响
2.3 提取温度对分离蛋白提取率和蛋白含量的影响
提取温度对分离蛋白提取率和蛋白含量的影响见图3。不同提取温度对分离蛋白提取率的影响呈先上升后下降趋势,当提取温度从20℃增加到60℃时,随着提取温度的提高,分离蛋白提取率呈上升趋势;提取温度从60℃增加至100℃时,蛋白提取率呈下降趋势;这可能与温度升高后蛋白质发生变性,进而影响蛋白质提取有关。统计分析表明,提取温度为60℃时的提取率与40℃时差异不显著(P>0.05),与其他处理呈极显著差异(P<0.01)。
提取温度对分离蛋白蛋白含量的影响与蛋白提取率的趋势相似,温度在60℃时提取获得分离蛋白的蛋白含量最高。
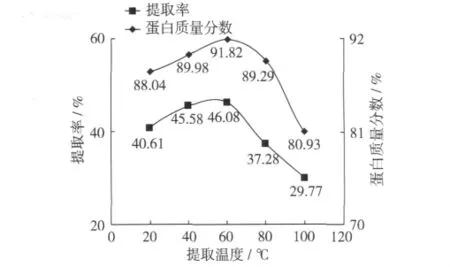
图3 提取温度对分离蛋白的提取率和蛋白含量的影响
2.4 提取时间对分离蛋白提取率和蛋白含量的影响
从图4可以看出,提取时间在150 min以下,随着时间的延长,分离蛋白提取率也在提高;提取时间在150 min以后继续延长至210 min时,蛋白提取率呈平缓向下趋势。分离蛋白的蛋白含量与提取时间的关系与提取率相似,也呈先上升后平缓向下的趋势。出现这种现象是由于随着加热时间的延长蛋白逐渐析出,但时间过长时会使蛋白变性,而使得蛋白提取率下降[13]。经统计分析,提取时间为150 min和180 min 2个处理之间的提取率差异不显著(P>0.05);提取时间为150 min与210 min之间的提取率呈显著差异(P<0.05);提取时间为150 min与150 min以下的3个处理之间的提取率呈极显著差异(P<0.01)。因此,提取时间以150 min为宜。同时,提取时间为150 min时,提取分离蛋白的蛋白含量也最高。

图4 提取时间对分离蛋白的提取率和蛋白含量的影响
2.5 正交试验
正交试验结果见表2。由表2可知,按照极差R的大小,影响蛋白提取率的因素主次顺序是:提取液pH>提取温度>提取时间>料液比;亚麻分离蛋白提取工艺的最佳条件是:提取液pH 9.5、提取温度为60℃、提取时间为165 min、料液比为1:30。以脱皮脱脂亚麻仁粕为原料,以亚麻分离蛋白提取工艺的最佳条件试验的提取率为52.71%,提取的分离蛋白的蛋白质量分数(以干基计)达95.20%。

表2 正交试验结果及极差分析
3 结论
亚麻籽脱皮是亚麻籽深加工的关键技术,亚麻籽经脱皮脱脂后得到的亚麻籽仁粕为亚麻籽脱皮后制备油脂的副产品,其粗蛋白达到52.4%。以脱皮脱脂亚麻籽为原料,采用碱溶酸沉的方法提取亚麻分离蛋白的工艺研究表明,亚麻分离蛋白提取的最佳工艺条件是:提取液pH 9.5、提取温度为60℃、料液比为1:30、提取时间为165 min。最佳工艺条件时蛋白提取率达52.71%,提取的分离蛋白的蛋白质量分数达95.20%。
[1]胡晓军.亚麻产业技术发展现状与对策[J].山西农业科学,2010,38(7):8 -10
[2]孙爱景,刘玮.亚麻籽功能成分提取及其应用[J].粮食科技与经济,2010,35(1):44 -45
[3]郭永利,范丽娟.亚麻籽的保健功效和药用价值[J].中国麻业科学,2007,29(3):147 -149
[4]张金,胡麻籽的营养保健价值与产业前景[J].中国食品工业,2006(3):33-34
[5]陈海华.亚麻籽的营养成分及开发利用[J].中国油脂,2004,34(6):72 -75
[6]狄济乐.亚麻籽作为一种功能食品来源的研究[J].中国油脂,2002,27(4):55 -57
[7]Madhusudha K T.Detoxification of commercial linseed meal use in Broiler Ration[J].Poultry Science,1986,65:164 -171
[8]Madhusudha K T,Singh N.Effect of detox ification treatment on the physicochemical properties of Linseed proteins[J].Journal of Agricultural and Food Chemistry,1985,33:1219 -1222
[9]Mazza G,Biliaderis C G.Functional properties of flaxseed mucilage[J].Food Science,1979,54:1302 -1305
[10]Mandokhot V M,Singh N.Studies on Linseed(Linum usitatissmum)as a protein source for poultry.I.Process of demucilaging and dehulling of linseed and evaluation of processed material by chemicalanalysis and with rats and chicks[J].Food Science Technology,1978,16:25 -31
[11]施树,赵国华.胡麻分离蛋白的提取工艺研究[J].粮食与油脂,2011(1):23-26
[12]胡晓军,李群.亚麻籽脱皮及亚麻仁酱的研究[J].粮油食品科技,2008,16(1):36 -38
[13]董凌隆,巨敏,刘军海.正交优化法提取苜蓿中叶蛋白的工艺研究[J].江西饲料,2011(4):28-30.

