结直肠癌患者DNA甲基转移酶3A、3B基因单核苷酸多态性观察
徐 峰,张国梁,邹 江
(1天津医科大学第一中心临床学院,天津300192;2天津市第一中心医院)
大量实验证明,结直肠癌(CRC)发生是一个多基因参与的复杂过程,基因DNA甲基化[1]可能是CRC肿瘤细胞中抑癌基因失活的机制之一[2]。催化DNA甲基化的DNA甲基转移酶(DNA methyltransferases,DNMTs)主要包括 DNMT1、DNMT3A、DNMT3B和 DNMT3L。DNMT3A和 DNMT3B具有重新甲基化活性[3],据报道DNMT3A和DNMT3B基因调控区的单核苷酸多态性(SNPs)位点与基因的表达调控密切相关。尽管已鉴定出大量的SNPs位点,但多局限于单个位点,故对于与CRC有关的SNPs研究尚不够完善。本研究根据以前研究报道,采用病例—对照的分子流行病学方法,应用Sequenom MassArray质谱分析技术对DNMT3A和DNMT3B的10个SNPs位点与CRC易感性进行了研究。现报告如下。
1 资料与方法
1.1 临床资料 观察组为天津市第一中心医院2011年1月~2012年6月确诊的89例CRC患者,男46例,女43例;年龄(56.37±15.46)岁,均经临床及病理检查确诊,且临床资料完整,采集其血液样本,标本采集前均未有放化疗或抗肿瘤药物使用记录。对照组为94例健康者,男49例,女45例;年龄(54.63±13.32)岁。两组性别、年龄等资料均匹配。两组人群均系天津市汉族人群,个体之间均无血缘关系。调查和取样均征得受试者本人知情同意,采集外周静脉血3~4 mL,置于5 mL的 EDTANa2抗凝管中,-80℃冻存。
1.2 研究方法
1.2.1 候选基因及SNP的选择 根据所查阅的相关科研文献报道,并依据SNP数据库(http://www.ncbi.nlm.nih.gov/snp,dbSNP)中 DNMT3A 和 DNMT3B基因的SNP位点的连锁不平衡状态,选取位于启动子区域和下游调控区的10个SNPs位点,分别为:DNMT3A rs1550117、rs13420827、rs11887120、rs13428812 和 DNMT3B rs6119954、rs4911259、rs4911107、rs1569686、rs2424908、rs2424932。
1.2.2 DNA提取 用QIAGEN基因组DNA提取试剂盒提取外周血白细胞基因组DNA,提取步骤参照说明书,采用紫外分光光度计行DNA水平测定,并标化至质量浓度 >25 ng/μL,纯度 260/280≥1.7,260/230≥1,样本量 >20 μL,提取好的 DNA 保存于-80℃备用。
1.2.3 引物的设计与合成 针对10个单核苷酸多态性位点,用Sequenom MassArray Designer 3.0软件设计PCR扩增及延伸引物,其中特异性扩增引物序列见表1。

表1 扩增及延伸引物序列
1.2.4 基因SNP分型 利用Sequenom MassArray质谱阵列技术(美国,Sequenom公司)对10个SNP位点进行基因分型。方法为:① 多重PCR反应扩增DNA样本;②虾碱性磷酸酶(shrimp alkaline phosphatase,SAP)反应,去除未反应完的 dNTP;③单碱基延伸反应(single base extension,SBE),于SNP位点处延伸上带有荧光信号标记的单个碱基;④将所得反应产物用树脂脱盐后经自动点样仪点样于384孔板PCR仪(384-element SpectroCHIP array)上;⑤将点制后的芯片用基质辅助的激光解吸质谱仪(MAIDI-TOF MS)检测等位基因,根据单碱基延伸的等位基因的相对分子质量差异进行基因分型;⑥应用MassArray Typer软件分析质谱图。
1.2.5 SNPs连锁不平衡分析 采用Haploview4.2软件对样本中的SNPs进行连锁不平衡(link disequilibrium,LD)分析。
1.2.6 SNPs单体型分析 通过Haploview4.2软件对DNMT3A和DNMT3B SNPs行单体型分析。
1.2.7 统计学方法 采用Plink1.06软件进行数据分析和质控,两组等位基因和基因型频率行Hardy-Weinberg平衡检验,计算优势比(OR)及其95%CI[4],采用 Logistic 回归进行矫正。P≤0.05为差异有统计学意义。
2 结果
2.1 两组基因SNP分型结果 两组10个SNPs位点 DNMT3A rs1550117、rs13420827、rs11887120、rs13428812 和 DNMT3B rs6119954、rs4911259、rs4911107、rs1569686、rs2424908、rs2424932 的等位基因分别为 A/G、G/C、C/T、A/G、A/G、T/G、A/G、T/G、C/T、A/G。两组最小等位基因频率(MAF)均>1%,且符合Hardy-Weinberg平衡。统计分析结果表明,rs6119954和rs2424908在观察组与对照组间差异有统计学意义(rs6119954:OR=0.640,95%CI:0.411~0.996,P=0.047;rs2424908:OR=0.612,95%CI:0.405~0.926,P=0.020)。
2.2 SNPs连锁不平衡分析结果 DNMT3A的4个位点之间不存在紧密连锁(r2<0.8),DNMT3B基因构建LD显示有1个单倍型块(haplotype Block),由rs6119954、 rs4911259、 rs4911107、 rs1569686、rs2424908、rs2424932组成,两两之间存在强连锁(rs6119954和rs4911259之间的连锁性稍差,r2=0.83),见图1。
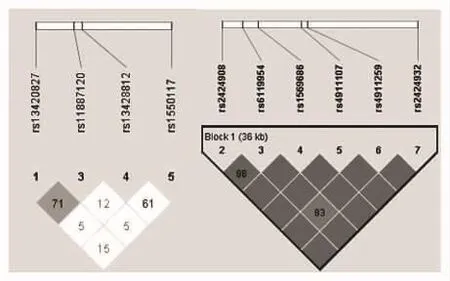
图1 DNMT3A和DNMT3B SNPs LD分析
2.3 SNPs单体型分析结果 DNMT3A的4个位点不存在紧密连锁,故未检测到单体型;DNMT3B的6个SNP位点间存在紧密连锁,本实验检出4个单体型,分别为 TGTAGG、CATAGG、CGGGTA 和 CGTAGG,其中观察组与对照组TGTAGG单体型频率分别为86.5%、34.0%;CATAGG单体型频率分别为40.4%、27.6%,两组比较,P均<0.05;CGGGTA单体型频率分别为20.2%、18.6%,CGTAGG单体型频率分别为2.2%、1.1%,两组比较,P均 >0.05。
3 讨论
据报道,CRC的发生、发展过程中既有原癌基因的激活,又有抑癌基因的失活及突变,包括遗传学和表观遗传学的改变。DNA甲基化是表观遗传学改变的主要形式,具体过程是指由DNMTs催化,以S-腺苷蛋氨酸(S-adenosyl methionine,SAM)作为甲基供体,将甲基转移到胞嘧啶上,生成5'-甲基胞嘧啶(5-mC)的过程[5],这是脊椎动物DNA惟一一种自然的共价修饰方式。DNMT3在肿瘤在发生、发展中起重要作用,负责基因的重新甲基化。DNMT3A定位于人染色体2p33,DNMT3B定位于人染色体20q11.2。基因调节区CpG岛的高甲基化被看作肿瘤抑制基因失活及其他遗传病发生的物质基础,而DNMT3在CpG岛的重新甲基化过程中发挥重要作用。实验表明,DNMT3A和DNMT3B基因通过调节细胞内甲基化过程而参与肿瘤的发生和发展,已发现其在许多肿瘤细胞中高表达[6]。最近研究显示,DNMT3A和DNMT3B基因的单核苷酸多态性在头颈部鳞癌、肺腺癌和肺小细胞癌、大肠腺癌、食管癌、胃癌、肾癌及白血病等多种肿瘤的发病中具有重要性[7]。
SNPs是基因组水平上由单个核苷酸变异引起的一种DNA序列多态性。由于其数目众多、分布广泛且相对稳定,已被作为第三代基因遗传标志[8]。作为一种稳定的遗传基因早期突变,SNP与疾病有稳定的相关性。因此,通过高密度SNP图谱,用相关性分析的方法搜寻某些复杂遗传疾病的致病基因,有助于在基因水平了解疾病发生的机制。随着国际人类基因组单体型计划(Hapmap)人类遗传性图谱的构建,SNPs已成为人类基因组研究的重要组成部分。本研究采用的Sequenom MassArray SNP检测系统,其基本原理为基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)技术。其通过采用高密度SpectroCHIP点阵芯片,按照A、T、G和C的信号强弱及质量差异得出模板序列信息,可高效自动化的筛查SNPs,该系统作为一种高通量的检测系统,适合SNPs的大规模筛查使用。
Gowher等[9]研究认为,DNMT3A 基因突变和启动子甲基化会导致基因的mRNA表达下降亦是基因变异导致癌症危险性增加的机理。Wu等[10]认为,DNMT3A基因R822H基因G→A突变后使DNMT3A与ATP的结合出现位阻,酶的活性(DNA修复能力)明显下降,故DNMT3A基因R822H位点突变是导致结肠癌危险性的原因。Fan等[11]研究后发现DNMT3A基因启动子区域rs1550117与胃癌的易感性紧密相关,可作为预测年龄<60岁的个体对胃癌易感性的一个分类标志。另有学者研究发现DNMT3A rs13420827位点与卵巢癌的发生有关。本研究未能发现DNMT3A基因rs1550117和rs13420827与CRC相关,提示以上两个位点突变可能存在组织器官的差异性。
本研究发现散发CRC患者DNMT3B基因rs1569686位点TT基因型频率明显高于普通人群,但值得注意的是,癌症患者和普通人群的突变率均高于 Hong等[12]的报道,提示 DNMT3B 基因rs1569686位点存在明显的种族差异。在以往的研究工作中,DNMT3A和DNMT3B SNP作为风险因素来衡量人群肿瘤的易感性,多局限于单个位点,而在本研究中,通过前期应用全基因组关联研究中国汉族人群的CRC发病情况,结合查阅的相关科研文献,对发现的10个位点进行研究,结果提示DNMT3B的2个SNP位点rs6119954和rs2424908多态性与汉族人群CRC发病相关,这在中国汉族人群是首次报道,在其他人种亦未见报道。Hu等[13]研究证明rs1569686的TT等位基因型比其他基因型胃癌的发生率低。鲍倩等[14]通过对DNMT3B基因启动子区rs1569686的检测,证实rs1569686位点G等位基因在CRC发生过程中是一个潜在保护因素。
连锁不平衡研究是寻找疾病相关基因易感位点的手段之一,单体型分析是其不可缺少的工作,利用配对连锁不平衡构建单体型块在全基因组范围内作图是目前人类基因组研究的重要内容之一[15]。我们采用基于最大期望算法(Expectation-Maximization,EM)的Haploview4.2软件,根据等位基因频率决定散发群体中杂合子个体的单倍型分布,得出的群体单体型频率较接近真实情况。在本实验中,配对连锁不平衡检验表明,DNMT3A的4个位点连锁不平衡程度较低,而DNMT3B的6个位点间存在强连锁,除rs6119954和rs4911259之间连锁性稍差(r2=0.83)外的其他位点之间接近或达到了完全的连锁不平衡。因此,在实际应用中,达到完全连锁不平衡的位点之中选择其一即可代表其他位点的等位基因型。而且,此6个位点归属于一个单体型块,能否在他们中筛选出单体型标签SNP(haplotype tag SNP,htSNP),并探讨与疾病的关系是我们今后的研究重点。
将来的研究可能是进一步验证DNMT3A和DNMT3B基因位点与CRC的关系,如使用基因敲入技术使小鼠表达DNMT3A和DNMT3B基因位点突变蛋白,然后观察小鼠CRC的发生率。而结肠癌作为多基因异常疾病,分析其他甲基转移酶遗传异常的连锁不平衡关系亦非常重要。因此,CRC发病的危险因素还有待于进一步研究,以利于更全面的阐述人群CRC的发病机制。
[1]Eng C,Herman JG,Baylin SB,et al.A bird's eye view of global methylation[J].Nat Getet,2000,24(2):101-102.
[2]Esteller M.Epigenetics provides a new generation of oncogenes and tumour-suppressor genes[J].Br J Cancer,2006,94(2):179-183.
[3]Liu K,Wang YF,Cantemir C,et al.Endogenous assays of DNA methyltransferases:evidence for differential activities of DNMT1,DNMT2,and DNMT3 in mammalian cells in vivo[J].Mol Cell Biol,2003,23(8):2709-2719.
[4]Purcell S,Neale B,Todd-Brown K,et al.PLINK:a tool set for whole-genome association and population-based linkage analyses[J].Am J Hum Genet,2007,81(3):559-575.
[5]张永彪,褚嘉祐.表观遗传学与人类疾病的研究进展[J].遗传,2005,27(3):466-472.
[6]Schmidt WM,Sedivy R,Forstner B,et al.Progressive up-regulation of genes encoding DNA methyltransferase in the colorectal adenoma-carcinoma sequence[J].Mol Carcing,2007,46(9):766-772.
[7]Chang KP,Hao SP,Liu CT,et al.Promoter polymorphisms of DNMT3B and the risk of head and neck squamous cell carcinoma in Taiwan:a case-control study[J].Oral Oncol,2007,43(4):345-351.
[8]Divne AM,Allen M.A DNA micro-array system for forensic SNP analysis[J].Forensic Sci Int,2005,154(2-3):111-121.
[9]Gowher H,Loutchanwoot P,Vorobjeva O,et al.Mutational analysis of the catalytic domai-n of the murine Dnmt3a DNA-(cytosine C5)-methyltransferase[J].J Mol Biol,2006,357(3):928-941.
[10]Wu H,Coskun V,Tao J,et al.DNMT3a-dependent nonpromoter DNA methylation facilitates transcription of neurogenic genes[J].Science,2010,329(5990):444-448.
[11]Fan H,Liu D,Qiu X,et al.A functional polymorphism in the DNA methyltransferase-3A promoter modifies the susceptibility in gastric cancer but not in esophageal carcinoma[J].BMC Med,2010,(8):12.
[12]Hong YS,Lee HJ,You CH,et al.DNMT3B 39179GT polymorphism and the risk of ad-enocarcinoma of the colon in Koreans[J].Biochem Genet,2007,45(3-4):155-163.
[13]Hu J,Fan H,Liu D,et al.DNMT3B promoter polymorphism and risk of gastric cancer[J].Dig Dis Sci,2010,55(4):1011-1016.
[14]鲍倩,何帮顺,陈丽萍,等.DNA甲基转移酶3B基因启动子单核苷酸多态性与结直肠癌的相关性[J].中华预防医学杂志,2012,46(1):53-57.
[15]Lai E,Bowman C,Bansal A,et al.Medical application of haplotype-based SNP maps:learning to walk before we run[J].Nat Genet,2002,32(3):353.

