大白菜脱春化效果及脱春化前后DNA甲基化分析
王晓丽赵 勇张耀伟
(1东北农业大学园艺学院,农业部东北地区园艺作物生物学与种质创制重点实验室,黑龙江 哈尔滨 150030;2黑龙江省经济作物技术指导站,黑龙江 哈尔滨 150090)
大白菜〔Brassica campestris L. ssp. pekinensis (Lour) Olsson〕是十字花科芸薹属一、二年生草本植物,原产中国,营养丰富,风味清新,深受人们的喜爱。除中国、日本、朝鲜、东南亚各国普遍栽培外,欧美等国家也相继引种,种植面积不断扩大;黑龙江省每年栽培面积8万hm2左右。
近年来,春大白菜生产发展迅速,种植面积不断扩大,但由于栽培管理不当及气候因素的影响,在春大白菜生产中经常会出现未熟抽薹的现象。春季的气候特点是前期温度低,后期温度高,这与大白菜的生长习性正好相反,不利于大白菜生长。前期温度低,大白菜处于低温环境条件下很容易通过春化阶段,随着温度升高,日照时间加长,会出现抽薹现象,即大白菜在进入结球期之前由于感受低温而通过春化抽薹开花(刘春 香和长兰卿,2001)。宋阿利等(2006)研究发现高温可延迟春化后大白菜的抽薹开花;蒋欣梅等(2009)报道高温可导致甘蓝春化逆转。本试验探讨了大白菜高温脱春化的效果,目的在于寻找防止大白菜先期抽薹的方法,从而弥补大白菜育苗过程中因低温春化所带来的不良后果,对春季大白菜生产起指导作用。
Burn等(1993)、Finnegan等(1998)认为去甲基化是春化作用的分子基础;蒋欣梅等(2009)研究发现甘蓝发生高温春化逆转后,核酸总量、DNA 和RNA 含量以及RNA/DNA 比值显著下降。本试验通过甲基化敏感扩增多态性(methylation sensitive amplification polymorphism,MSAP)方法检测脱春化前后大白菜基因组甲基化水平的变化,分析甲基化与脱春化之间的关系,对大白菜高温脱春化机理进行初步研究。
1 材料与方法
1.1 试验材料
试验于2011~2012年在东北农业大学园艺试验站进行。供试材料为耐抽薹大白菜一代杂种阳春,韩国兴农种子有限公司生产。
1.2 试验方法
1.2.1 光照培养箱条件下脱春化处理
1.2.1.1 绿体春化后脱春化 先将大白菜种子用30 ℃温水浸泡2h,播于8cm×8cm营养钵中,子叶展平后置于光照培养箱内,在温度为8 ℃/3 ℃(昼/夜,下同)、光照时间为12h的条件下进行绿体春化。低温处理20d后,温度调整为34 ℃/25 ℃,进行脱春化处理,分别处理14、21、28d,标记为A1、A2、A3。对照A0的培养温度为28 ℃/20 ℃。5月15日将所有幼苗定植到露地中,采用完全随机区组设计,3次重复,每重复种植20株。
1.2.1.2 种子春化后脱春化 用30 ℃温水浸泡大白菜种子2h,捞出沥干,置于冰箱内,0~3℃条件下低温处理25d,然后播于8cm×8cm营养钵中,子叶展平后置于光照培养箱中,34℃/25 ℃进行脱春化处理,分别处理14、21、28d,标记为B1、B2、B3。对照B0的培养温度为28 ℃/20 ℃。5月15日将所有幼苗定植到露地中,采用完全随机区组设计,3次重复,每重复种植20株。
1.2.2 温室条件下脱春化处理 用30 ℃温水浸泡大白菜种子2h,捞出沥干,置于冰箱内,0~3℃条件下低温处理25d,然后播于8cm×8cm营养钵中,子叶展平后置于日光温室中,不通风条件下分别进行高温处理(白天最高温度达40 ℃)10、15、20、25d,标记为C1、C2、C3、C4。对照C0低温处理之后不经过高温脱春化处理。5月15日将所有幼苗定植到露地,采用完全随机区组设计,3次重复,每重复种植20株。
1.2.3 调查项目 分别调查各处理抽薹植株的开花时间,未抽薹植株于定植后50d调查叶球内花薹高度。
1.2.4 MSAP法检测基因组甲基化 先将大白菜种子用30 ℃温水浸泡2h,播于8cm×8cm营养钵中,子叶展平后置于光照培养箱中,在温度为8 ℃/3 ℃、光照时间为12h的条件下进行绿体春化,处理20d;然后置于日光温室中,不通风条件下进行高温(白天最高温度达40 ℃)脱春化处理,时间为15d,标记为D1。设置2个对照,D0为绿体春化处理20d,CK为正常育苗,培养温度为28 ℃/18 ℃。
采用改进的CTAB法(郁有健,2010)提取大白菜新生叶片基因组DNA。参照Xiong等(1999)、范建成等(2010)的MSAP试验步骤并进行改进。分别采用EcoRⅠ/HpaⅡ及EcoR/MspⅠ两组限制性内切酶对DNA进行消化,为防止DNA损失,同时进行酶连。酶切、酶连体系为:DNA 500 ng,EcoRⅠ10U/HpaⅡ5U或 EcoRⅠ10U/MspⅠ5U,EcoRⅠ接头 5pmoL,HpaⅡ/MspⅠ接头50 pmoL,T4连接酶3U,T4buffer 2.5U,ddH2O补齐20μL。于37℃进行酶切与酶连,12h后取出,65 ℃处理10min,以使T4酶灭活,然后立即放在冰上冷却。每个样品吸取2μL用于预扩增,所得产物稀释100倍后用于选择性扩增反应。扩增程序与AFLP相同。所用接头及引物序列见表1。选择性扩增产物进行6%变性尿素聚丙烯酰胺凝胶电泳分离,硝酸银染色后统计分析条带。

表1 MSAP接头和引物序列
2 结果与分析
2.1 光照培养箱条件下大白菜脱春化
2.1.1 绿体春化后脱春化效果 绿体春化后,在光照培养箱条件下进行高温脱春化的大白菜植株开花时间见表2,说明高温能够解除大白菜春化效果;在相同的脱春化温度下,时间的长短对脱春化的效果有明显影响,且有一定规律,即脱春化时间越长,脱春化程度就越明显。
2.1.2 种子春化后脱春化效果 种子春化后,在光照培养箱条件下进行高温脱春化的大白菜植株间差异见表3,说明高温能使经过种子春化的大白菜解除春化,未经过高温脱春化处理的对照开花,而经过高温脱春化处理的B1、B2、B3没有开花,但各处理间脱春化效果均无显著差异。
2.2 温室条件下大白菜脱春化
大白菜温室条件下脱春化处理植株的叶球内花薹高度见表4,未经过高温脱春化处理的对照叶球内花薹高度极显著高于经过高温脱春化处理的C1、C2、C3、C4,说明高温能使大白菜叶球内的花薹高度变矮,可以脱春化。虽然4个处理之间无显著差异,但是随着脱春化时间的延长,脱春化效果越来越明显。
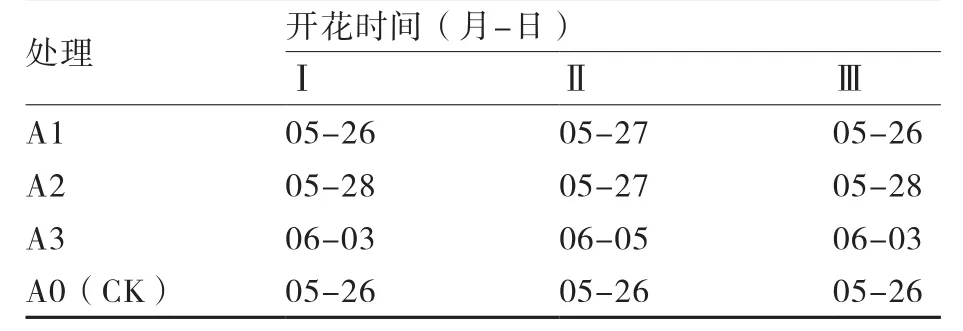
表2 大白菜绿体春化后在光照培养箱条件下脱春化植株的开花时间

表3 大白菜种子春化后在光照培养箱条件下脱春化植株的叶球内花薹高度
进行F测验后发现(表5):区组之间差异不显著,说明各区组之间环境条件差异不大;各处理与对照间差异极显著。
2.3 大白菜基因组DNA甲基化分析
2.3.1 同裂酶HpaⅡ和MspⅠ对甲基化的敏感性差异 虽然同裂酶HpaⅡ和MspⅠ都能识别5′-CCGG-3′序列,但是因甲基化胞嘧啶位置的不同,两种酶对甲基化的敏感性不同,使两者具有选择性切割的特性。HpaⅡ识别并切割非甲基化与半甲基化位点(5mCCGG/GGCC),对全甲基化位点(C5mCGG/GG5mCC)不敏感;而MspⅠ能够识别并切割非甲基化与全甲基化位点,对半甲基化位点不敏感。
根据通用的记带原则(只记清楚的带,不记模糊的带),对变性聚丙烯酰胺凝胶电泳带型进行统计分析。根据Hpa Ⅱ与MspⅠ酶切产物的扩增条带可以划分为4种甲基化类型(图1):无甲基化,两条泳道都有带;半甲基化,Hpa Ⅱ有带而MspⅠ无带;全甲基化,Hpa Ⅱ无带而MspⅠ有带;超甲基化,两条泳道都无带,说明两种酶都不能切割。
2.3.2 大白菜基因组DNA甲基化模式差异 甲基化模式变化表现在甲基化带型多态性方面,大白菜基因组DNA的MSAP带型发生改变,反应了在春化、脱春化过程中CCGG位点甲基化状态的改变。多态性片段包括3种类型:Ⅰ型是指在CK组中H和M泳道都无带,在D0组中两条泳道都出现带或其中1条出现带,在D1组中两条泳道都无带;Ⅱ型是指在CK组中H或M泳道有带,在D0组中H和M泳道都有带,在D1组中又恢复CK组状态。Ⅰ型和Ⅱ型说明春化后该CCGG位点发生了去甲基化,在脱春化后又发生了甲基化;Ⅲ型是指D0、D1组在CK组的基础上均出现了相同的去甲基化条带(图2)。
2.3.3 大白菜基因组DNA甲基化水平差异 利用7条EcoRⅠ引物和4条HpaⅡ/MspⅠ引物组成28对引物组合,对3种不同处理(CK、D0、D1)的大白菜基因组进行MSAP分析,3个样本中分别扩增出569、580、575条清晰条带,由此计算出3个样本均检测到592个基因位点,共检测到1776个基因位点(表6)。不同引物组合检测到的条带数目在36~90条之间,平均为63条。
由表6可见,未经过低温处理的CK组总甲基化率为58.1%,经过低温处理的D0组总甲基化率为54.2%,低温之后给予高温脱春化处理的D1组总甲基化率为57.1%。说明经过低温春化处理后大白菜总甲基化水平降低,温室脱春化处理后甲基化水平又有所升高。CK、D0、D1处理全甲基化率分别为28.2%、26.9%、27.9%,半甲基化率分别为29.9%、27.3%、29.2%,全甲基化与半甲基化水平也呈现春化后降低、脱春化后再升高的趋势。

表4 大白菜种子春化后在温室条件下脱春化植株的叶球内花薹高度

表5 方差分析
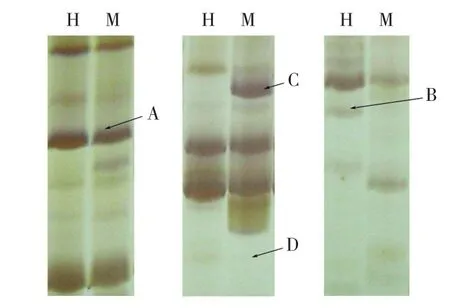
图1 大白菜基因组DNA甲基化带型
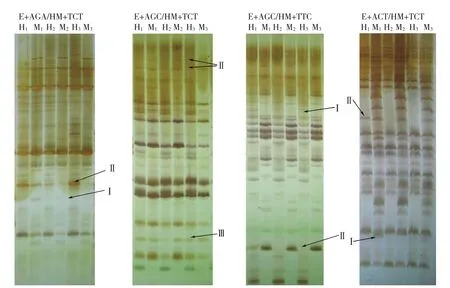
图2 大白菜基因组DNA甲基化MSAP聚丙烯酰胺凝胶电泳部分结果
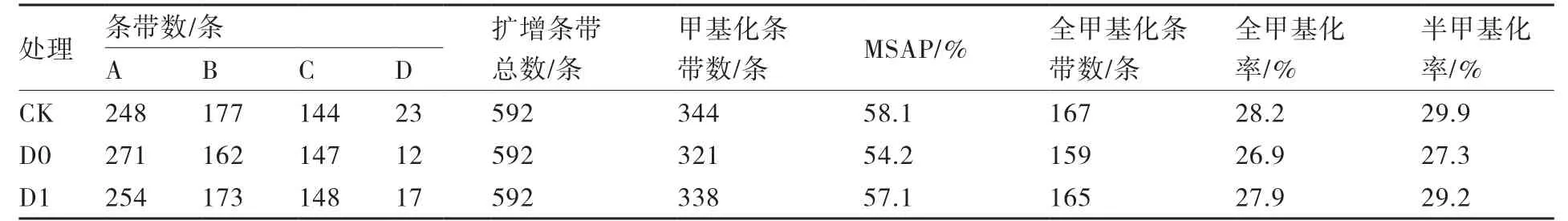
表6 大白菜基因组DNA甲基化率
3 结论与讨论
大白菜属于种子春化型,从种子萌发开始,对低温就有反应,而且这种对低温的感受作用在整个生长期都有表现;不像甘蓝等作物(绿体春化)需要一定大小的营养体才能够感受低温。对于一些耐抽薹性很强的材料在春化上的顽固性,奥岩松等(1996)提出将其作为近绿体春化型看待。本试验选用生产中表现优良的耐抽薹大白菜品种,采用绿体春化和种子春化两种方式进行春化,不同春化类型的春化效果有差异,高温脱春化效果也有差异。在相同低温下处理相同时间,绿体春化效果比种子春化效果好,植株开花时间比较早;在脱春化条件下,种子春化与绿体春化相比,更易于脱春化,说明种子春化更容易发生发育逆转。
在本试验中,光照培养箱条件下的绿体脱春化、种子脱春化以及温室自然高温脱春化结果均证明,高温可以脱春化。在高温条件下,处理时间越长,脱春化效果越明显。这与大白菜低温春化作用也是一致的,低温积累时间越长,开花越早。可能是在高温条件下,持续时间越长,大白菜体内低温诱导积累的开花相关物质就分解得越多,脱春化效果也越明显。温室内自然高温的脱春化效果好于光照培养箱处理,可能是光照培养箱设置的温度未达到脱春化的最佳温度;光照培养箱内34 ℃处理,已造成大白菜幼苗伤害,人工控制条件下很难确定脱春化的最佳温度。
本试验结果表明,春化时DNA甲基化水平降低,这与Burn等(1993)、Finnegan等(1998)的去甲基化是春化分子基础的理论相符,去甲基化促进了开花相关基因的表达。脱春化植株在田间种植时不开花或开花晚,同时脱春化时甲基化水平升高,说明春化时促进抽薹开花相关基因发生去甲基化,脱春化后又重新发生了甲基化。因此对春大白菜进行一定温度、一定时间下的脱春化处理,可以使春化效应逆转而恢复正常,从而减少春大白菜因先期抽薹而造成的经济损失。本试验结果表明,脱春化处理15d的大白菜植株甲基化程度并未达到正常栽培时的甲基化水平,这可能与脱春化时间不够有关,也可能与有些去甲基化不可逆转有关。如果将脱春化时间设为20、25d,可能甲基化程度会进一步提高。
奥岩松,李式军,陈广福,程斐.1996.种子春化与光周期处理对大白菜花芽分化和抽薹的影响.东北农业大学学报,27(3):250-254.
范建成,刘宝,王隽媛,盛连喜.2010.萘胁迫对水稻基因组DNA甲基化模式及水平的影响.环境科学,31(3):793-800.
蒋欣梅,赵荣秋,于锡宏.2009.高温春化逆转对甘蓝体内核酸类物质含量的影响.植物生理学通讯,45(7):673-676.
刘春香,长兰卿.2001.白菜的春化特性及未熟抽薹研究进展.吉林农业大学学报,(3):33.
宋阿利,冯辉,宋宝香,李骋宇,孙威.2006.高温对大白菜阶段发育的影响.长江蔬菜,(3):41-42.
郁有健.2010.大白菜抽薹开花相关基因SNP分析与晚抽薹开花性状QTL定位〔硕士论文〕.哈尔滨:东北农业大学.
Burn J E,Bagnall D J,Metzger J D,Dennis E S,Peacock W J.1993.DNA methylation,vernalization,and the initiation of flowering.Proc Natl Acad Sci,90:287-291.
Finnegan E J,Genger R K,Kovac K,Peacock W J,Dennis E S.1998.DNA methylation and the promotion by vernalization.Proc Natl Acad Sci,95(10):5824-5829.
Xiong L Z,Xu C G,Saghai M A,Zhang Q F.1999.Patterns of cytosine methylation in an elite rice hybrid and its parental lines,detected by a methylation-sensitive amplification polymor phism technique.Mol Gen Genet,261:439-446.

