1,8-桉叶油素对小鼠的经口急性毒性和蓄积毒性的研究
杜永华,王 川,周黎军,张 萍,魏 琴,*,殷中琼,蒋勤久,蒋吉洪
(1.宜宾学院西南特色经济植物保护与利用重点实验室,四川宜宾644000;2.宜宾学院食品科学与工程研究所,四川宜宾644000;3.四川农业大学动物医学院,四川雅安625014;4.宜宾县生产力促进中心,四川宜宾644000)
1,8-桉叶油素(1,8-cineole,C10H18O)为无色透明油状液体,具有樟脑气息和辛辣凉味,主要存在于桉树和油樟等芳香植物的挥发油中,是我国食品添加剂-桉叶油的主要成分(GB10351-2008)。研究表明,1,8-桉叶油素具有抗氧化[1]、抗菌[2]、杀虫[3]、镇痛抗炎[4-5]和促进透皮吸收渗[6]等作用,已广泛用于香料、食品、医药、化工和国防等领域。Santos研究了[7]1,8-桉叶油素对大鼠经口急性毒性,其 LD50为(2.85 ± 0.33)g/kg。余永莉等[6,8-9]研究发现桉树叶挥发油对小鼠的经口LD50为1824.01mg/kg,属低毒物品,无明显遗传毒性,无胚胎毒性和致畸作用。张笑乐等[10]研究发现油樟叶挥发油对家兔皮肤无光毒性,对完整皮肤无刺激性,中等剂量对破损皮肤有可逆性刺激性,对眼睛有一定刺激性。而对油樟叶挥发油中1,8-桉叶油素的毒性研究未见报道。本文研究了1,8-桉叶油素对小鼠的经口急性毒性和蓄积毒性,为其安全性评价提供实验依据。
1 材料与方法
1.1 材料与仪器
1,8-桉叶油素 由油樟叶挥发油中分离,纯度大于 99.5%,购自宜宾市江南香料厂,批号20101205;吐温-80 分析纯,成都市科龙化工试剂厂。
清洁级昆明小鼠 体重为18~22g,购于成都达硕实验动物研究所,合格证号:SCXK(川)2008-24。小鼠专用生长维持饲料,常规方式饲养,自然采光,自由采食饮水。
AL204电子天平 梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 1,8-桉叶油素对小鼠的经口急性毒性实验将1,8-桉叶油素用2%吐温-80配制成分散体系,用蒸馏水稀释成不同浓度的溶液,以2%吐温-80为溶剂对照,按小鼠体重灌胃。预实验结果表明小鼠经口灌胃1,8-桉叶油素0%和100%死亡剂量估计值分别为3000mg/kg和5000mg/kg。正式实验取60只小鼠随机分为6组,每组10只,雌雄各半,灌胃前禁食16h,不禁水。1~5组为染毒剂量组,组间剂量比为 1.14,一次性灌胃分别为 2960.39、3374.85、3847.33、4385.96、5000mg/kg·bw,第 6 组为溶剂对照组。灌胃染毒后连续观察14d,记录小鼠精神、摄食、饮水、呼吸、活动、死亡及病理学变化情况,采用改良寇氏法计算LD[11]50。
1.2.2 1,8-桉叶油素对小鼠的蓄积毒性实验 取40只小鼠随机分为2组,每组20只,雌雄各半,采用固定剂量法染毒,实验组小鼠每天经口染毒1/5LD50(769.47mg/kg)剂量的1,8-桉叶油素,连续灌胃染毒28d,对照组小鼠给予同剂量的溶剂。实验期内小鼠累计死亡数达50%,终止实验。按K=LD50(n)/LD50(1)计算累积系数(K),以评价化合物对机体蓄积性毒性的大小,是判断化合物是否引起潜在慢性中毒的依据之一,其中LD50(n)为固定剂量多次染毒引起半数小鼠死亡的总累积剂量,LD50(1)为一次染毒引起半数小鼠死亡的剂量。实验期间观察记录小鼠的精神、食欲、饮水及死亡情况,实验结束剖杀各组小鼠,观察组织病理变化,计算饲料利用率(每食入100g饲料所增长的体重克数)和脏器指数(某脏器与单位体重之比值)[12]。
1.2.3 数据统计处理 实验数据采用SPSS17.0分析软件进行组间显著性分析,数据以¯X±S表示。
2 结果与分析
2.1 急性毒性实验
小鼠染毒后活动减少,严重者出现呼吸急促或呼吸困难、精神萎靡、俯卧、拱背、不食等症状,1h~4d内先后死亡;轻者出现反应迟钝、精神不振、食欲减弱等症状,4d后不再死亡,逐步恢复正常。对照组小鼠精神、摄食、饮水、呼吸及活动未见异常,无死亡现象。剖检死亡小鼠可见小鼠胃和小肠轻度胀气,轻度充血,肝肾有少量出血点,其余组织器官未见明显异常变化。小鼠死亡情况见表1,采用改良寇氏法计算1,8-桉叶油素对小鼠的经口 LD50为3847.33mg/kg,LD5095%置信区间为3352.80~4414.82mg/kg。与Santos报道[7]的 1,8-桉叶油素对大鼠经口 LD50(2.85±0.33)g/kg相比,本实验测得的小鼠经口LD50较高,按化学品毒理学分级标准均为低毒化学品。1,8-桉叶油素对哺乳动物的急性毒性可能与动物种属有关。Vincenzi等[13]报道大鼠对桉叶油素的敏感性比小鼠高,大鼠在600mg/kg剂量经口染毒时出现毒性反应,小鼠在1200mg/kg剂量下仍未观察到毒性反应。刷尾负鼠能耐受每天食用含3.6g/kg 1,8-桉叶油素的饲料[14]。人在误食桉叶油后可出现急性中毒反应,主要表现为心跳加速、呼吸急促、恶心、呕吐、无力、嗜睡,甚至昏迷等症状,也有小孩误食3.5~5mL桉叶油引起死亡的报道[13]。实验结果表明,1,8-桉叶油素急性中毒时可引起小鼠肝肾轻度损伤,与Vincenzi等报道1,8-桉叶油素可引起大鼠肝肾损伤[13]一致。Kristiansen 和 Madsen 报道[15]高剂量1,8-桉叶油素能诱发大鼠近端肾小球上皮细胞微球蛋白升高。研究发现桉叶油可引起大鼠血液循环加快、血管扩张和血压降低等反应[16],减少大鼠心肌内膜钙离子的流入而降低心肌收缩能力[17],1,8-桉叶油素急性毒作用机理是否与其相关还有待进一步研究。
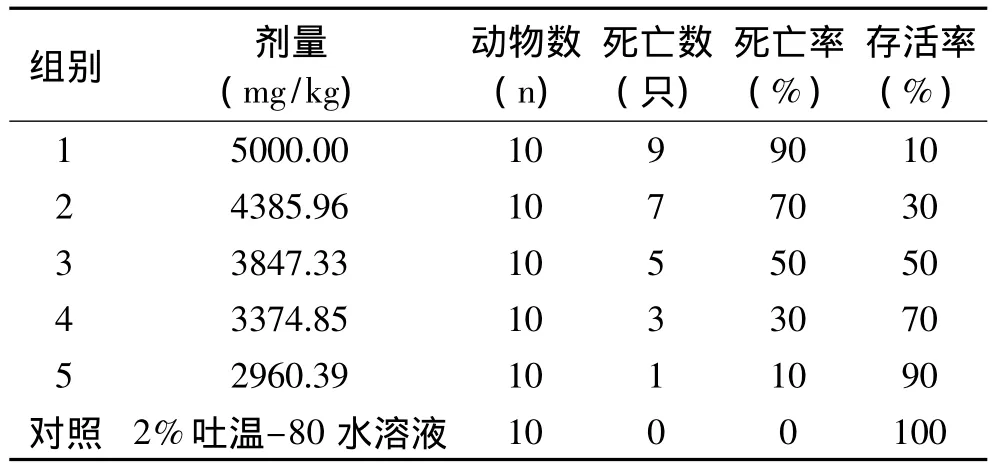
表1 1,8-桉叶油素对小鼠经口急性毒性实验结果Table 1 The result of oral acute toxicity test of 1,8-cineole on mice
2.2 蓄积毒性实验
2.2.1 临床观察 实验期间全部小鼠食欲、行动、被毛光洁度与色泽、呼吸,神态等均正常,实验组小鼠未见明显的中毒症状。经口染毒28d后,对照组和实验组的20只小鼠均全部存活,其蓄积毒性系数K>5,剖杀后各组小鼠均未见明显异常病理变化。根据蓄积系数分级标准[12],本次实验未观察到1,8-桉叶油素对实验小鼠有蓄积性毒性。余永莉等[6-7]的实验表明桉叶油对小鼠无明显的遗传毒性。美国食品香料和萃取物制造者协会(FEMA)规定1,8-桉叶油素在食品中最高参考用量为:软饮0.13mg/kg,冷饮0.05mg/kg,糖果 15mg/kg,焙烤食品 0.5~4.0mg/kg,口香糖190mg/kg。本实验所选蓄积性毒性实验剂量远高于FEMA规定剂量,可见如果按规定的剂量和方法使用,1,8-桉叶油素是比较安全的。1,8-桉叶油素的蓄积毒性不明显,可能与其经口生物利用度较低、生物代谢较快有关。Mclean等[18]报道刷尾负鼠饲喂低剂量的1,8-桉叶油素其口服生物利用度F仅为为0.05,半衰期T1/2为70min,肠管循环和肝微粒体代谢是导致口服生物利用度低的重要因素。研究发现1,8-桉叶油素能增加谷胱甘肽(GSH)、过氧化氢酶(CAT)、谷胱甘肽过氧化酶(GSH-Px)、铜锌趋氧化物歧化酶(CuZn-SOD)的活性,抑制脂肪氧化酶活性,表现出较强抗氧化作用,能保护乙醇诱导的大鼠胃损伤[19],保护氨基半乳糖/脂多糖[20]和 2,3,7,8-四氯二苯并二噁英[21]诱导的肝损伤。1,8-桉叶油素的抗氧化作用是否与其无明显蓄积毒性相关还需进一步研究。
表2 蓄积毒性实验中1,8-桉叶油素对小鼠饲料利用率的影响(±S)Table 2The feed conversion rate of mice in each group(士S)

表2 蓄积毒性实验中1,8-桉叶油素对小鼠饲料利用率的影响(±S)Table 2The feed conversion rate of mice in each group(士S)
注:**表示与对照组相比有统计学的差异(p<0.01)。
组别饲料利用率(g/100g)第1周 第2周 第3周 第4周对照组 15.68±0.280 8.88±0.271 4.49±0.102 4.17±0.188实验组 15.04±0.245 6.84±0.285**3.72±0.171 2.95±0.160
2.2.2 饲料利用率 1,8-桉叶油素对小鼠的饲料利用率的影响结果见表2。由表2可知,与对照组相比,1,8-桉叶油素组小鼠的饲料利用率有不同程度的降低,第二周时染毒组小鼠的饲料利用率与对照组的差异存在统计学意义(p<0.01),其余时间段染毒组与对照组无统计学差异(p>0.05),表明小鼠对1,8-桉叶油素具有一定阶段性耐受适应能力,小鼠的饲料利用率受1,8-桉叶油素的影响不大。研究发现刷尾负鼠能根据体内血中1,8-桉叶油素水平调节采食量,当刷尾负鼠血中1,8-桉叶油素浓度增加到一定水平后其采食量会下降,达到一定程度耐受后,其总体食物消耗量可逐步恢复正常,在1,8-桉叶油素摄入量增加过程中,由于肝酶的活性引起桉叶油素代谢加快和生物利用度下降,使其血中1,8-桉叶油素浓度并未增加[22]。Boyle和 McLean报道刷尾负鼠对1,8-桉叶油素的最大日摄入量可达(3.8±0.2)g/kg[23]。小鼠饲料利用率的变化是否与其血中1,8-桉叶油素水平有关需进一步研究。
2.2.3 脏器系数 1,8-桉叶油素对小鼠脏器系数的影响结果见表3,由表3可知,小鼠染毒28d后,实验组小鼠心、肝、脾、肺、肾、脑、生殖腺的脏器系数与对照组相比均无统计学差异(p>0.05)。表明小鼠按1/5 LD50剂量连续染毒28d,1,8-桉叶油素对小鼠的脏器无明显不良影响(p>0.05)。小鼠饲料利用率与脏器系数的测定结果进一步证实了1,8-桉叶油素对小鼠无明显蓄积毒性的临床观察结果。

表31 ,8-桉叶油素对小鼠脏器系数的影响(¯X±S)Table 3 Effect of 1,8-cineole on organ coefficient in mice(¯X±S)
3 结论
急性毒性实验结果表明,1,8-桉叶油素对小鼠经口LD50为3847.33mg/kg.bw,属低毒化学品,小鼠急性毒性主要靶器官为肝脏和肾脏。将其作为食品添加剂时需严格控制其用量,避免人中毒事件。
蓄积性毒性实验结果表明,1,8-桉叶油素对小鼠经口蓄积毒性系数K>5,未观察到蓄积性毒性,对小鼠饲料利用率影响不大,对脏器官无明显不良影响,在食品中按规定添加1,8-桉叶油素是比较安全的。
[1]Ciftci O,Ozdemir I,Tanyildizi S,et al.Antioxidative effects of curcumin,β - myrcene and 1,8 - cineole against 2,3,7,8-tetrachlorodibenzo- p- dioxin- induced oxidative stress in rats liver[J].Toxicol Ind Health November,2011,27(5):447-453.
[2]Morcia C,Malnati M,Terzi V.In vitro antifungal activity of terpinen-4-ol,eugenol,carvone,1,8- cineole(eucalyptol)and thymol against mycotoxigenic plant pathogens[J].Food Additives& Contaminants:Part A,2012,29(3):415-422.
[3]Liška A,Rozman V,KalinoviI,et al.Bioactivity of 1,8-cineole againstred flour beetle,Tribolium Castaneum(Herbst)[J].Pupae.Poljoprivreda,2011,17(1):58-63.
[4]Bastos V P D,Gomes A S,Lima F J B,et al.Inhaled 1,8-cineole reducesinflammatory parametersin airwaysof ovalbumin-challenged guinea pigs[J].Basic & Clinical Pharmacology & Toxicology,2011,108(1):34-39.
[5]Takaishi M,Fujita F,Uchida K,et al.1,8-cineole,a TRPM8 agonist,is a novel natural antagonist of human TRPA1[J].Molecular Pain,2012(8):86-98.
[6]Subongkot T,Opanasopit P,Rojanarata T,et al.Effect of limonene and 1,8 cineole on the skin penetration of fluorescein sodium deformable liposomes[J].Advanced Materials Research,2012,506:449-452.
[7]Santos F A.Estudo farmacológico de 1,8- cineole,um óxido terpênico presente em óleos essenciais de plantas[D].Fortaleza,CE,Brazil:Universidade Federal do Ceará.1999.
[8]余永莉,王传铜,冯国纹,等.桉叶油急性毒性与某些遗传毒性实验结果[J].毒理学杂志,2010,24(6):501-503.
[9]张宏,李啸红,余永莉,等. 桉叶油对小鼠胚胎发育影响的研究[J].时珍国医国药,2011,22(5):1155-1157.
[10]张笑乐,向楠,殷中琼,等.油樟叶挥发油对兔的急性皮肤刺激、眼睛刺激和皮肤光毒性的研究[J].中国农学通报,2011,27(23):36-39.
[11]中华人民共和国卫生部.GB1593.1-15193.21食品安全性毒理学评价程序和方法[S].2003:19-31.
[12]李建科.食品毒理学[M].北京:中国剂量出版社,2007,138-143.
[13]Vincenzi M De,Silano M,Vincenzi A De,et al.Constituents of aromatic plants:eucalyptol[J].Fitoterapia,2002,73(3):269-275.
[14]Lawler IR,Stapley J,Foley WJ,et al.Ecological example of conditioned flavor aversion in plant-herbivore interactions:Effect of terpenes of Eucalyptus leaves on feeding by common ringtail and brushtail possums[J].Journal of Chemical Ecology,1999,25(2):401-415.
[15]Kristiansen E,Madsen C.Induction of protein droplet(α2μglobulin)nephropathy in male rats after short-term dosage with 1,8- cineole and l- limonene[J].Toxicology Letters,1995,80(1-3):147-152.
[16] Lahlou S,Figueiredo A F,MagalhãesPJC,etal.Cardiovascular effects of 1,8-cineole,a terpenoid oxide present in many plant essential oils,in normotensive rats[J].Can.J.Physiol.Pharmacol,2002,80(12):1125-1131.
[17]Soares MCMS,Damiani CEN,Moreira CM,et al.Eucalyptol,an essential oil,reduces contractile activity in rat cardiac muscle[J].Brazilian Journal of Medical and Biological Research,2005,38(3):453-461.
[18]Mclean S,Boyle R R,Brandon S,et al.Pharmacokinetics of 1,8-cineole,a dietary toxin,in the brushtail possum(Trichosurus vulpecula):Significance for feeding[J].Xenobiotica,2007,37(9):903-922.
[19]Santos F A,Rao V S N.1,8- Cineol,a Food Flavoring Agent,Prevents Ethanol- Induced Gastric Injury in Rats[J].Digestive Diseases and Sciences,2001,46(2):331-337.
[20]Santos F A,Silva R M,Tomé A R,et al.1,8-Cineole protects against liver failure in an in-vivo murine model of endotoxemic shock[J].Journal of Pharmacy and Pharmacology,2001,53(4):505-511.
[21]Ciftci O,Ozdemir I,Tanyildizi S,et al.Antioxidative effects of curcumin,β - myrcene and 1,8- cineole against 2,3,7,8-tetrachlorodibenzo- p- dioxin induced oxidative stress in rats liver[J].Toxicology and Industrial Health,2011,27(5):447-453.
[22]McLean SR,Brandon,S,Boyle RR,et al.Development of tolerance to the dietary plant secondary metabolite 1,8-cineole by the Brushtail Possum(Trichosurus vulpecula)[J].Journal of Chemical Ecology,2008,34,(5):672-680.
[23]Boyle RR,McLean S.Constraint of feeding by chronic ingestion of 1,8- cineole in the brushtail possum(Trichosurus vulpecula)[J].Journal of Chemical Ecology,2004,30(4):757-775.

