大豆与大豆芽中异黄酮的含量、组成及分布比较研究
刘 琴,牛文慧,张薇娜,胡秋辉
(南京财经大学食品科学与工程学院,江苏省粮油品质控制及深加工技术重点实验室,江苏南京210046)
异黄酮(isoflavone)是一种弱的植物雌激素,而大豆是人类获得异黄酮的主要途径。已知大豆中的大豆异黄酮共有12种,包括染料木素(genistein,Ge)、大豆素 (daidzein,De)、黄豆黄素 (glycitein,GLe)及其相应的糖苷结合形式、乙酰基葡萄糖苷结合形式和丙二酰基葡萄糖苷结合形式,均为以3-苯丙吡喃酮为母核的化合物。临床实验证明:作为一种主要的植物来源雌激素[1],大豆异黄酮能有效预防和治疗骨质疏松[2]、更年期综合症[3],具有降血糖[4]、抗高血脂[5]和抑制细菌生长等[6]多种生物活性,此外,它们还具有黄酮类化合物普遍具有的抗氧化作用[7],能降低慢性非传染性疾病如心血管病[8]、糖尿病[9]及癌症(特别是乳腺癌[10]和前列腺癌[11])的发病率,因此大豆异黄酮已被用做临床药物和保健品。豆芽富含蛋白质、纤维素、矿物质及维生素,且具有热量低,爽口等优点,是深受中国、韩国、日本等亚洲老百姓的喜爱蔬菜。大豆芽中蛋白质、异黄酮等营养和功能性成分与大豆原料差异也引起了人们的研究兴趣。于立梅[12]等研究表明,大豆中的蛋白质、还原糖、VC和异黄酮含量在发芽后均较未发芽时增加。李振艳[13]等也报道了γ-氨基丁酸、大豆异黄酮等功能性因子含量在发芽过程中都有明显提高。在有关大豆发芽过程中大豆异黄酮含量的变化的报道中,对大豆异黄酮的测定大都是用光度法,即测定的是大豆异黄酮总含量的变化,对于大豆发芽后异黄酮组成及在豆芽芽茎和子叶中的含量分布的研究还很少。本研究通过液质联用结合串联质谱技术,对大豆芽和大豆原料中异黄酮的总含量和组成进行了比较研究,并对异黄酮在豆芽子叶和芽茎中的分布进行了进一步分析,该研究可为评价大豆芽作为一种餐桌上常见的蔬菜所具有的功能性提供基础研究的数据。
1 材料与方法
1.1 材料与仪器
大豆原料于2011年10月一次性购于江苏省苏果超市,产地东北,属小粒种大豆(13.90g/百粒种重)。染料木苷标品,色谱纯甲醇、醋酸购于Sigma-Aldrich公司;染料木素、大豆苷、大豆素、黄豆黄苷和黄豆黄素标品均购于阿拉丁试剂公司;其他分析纯试剂购于中国国药集团化学试剂有限公司。
FW-100型高速万能粉碎机 天津市华鑫仪器厂;SHA-B水浴恒温振荡器 金坛市荣华仪器制造有限公司;Allegra 64R高速冷冻离心机 美国贝克曼公司;Mill-Q Academic超纯水系统 美国 Mill Pore公司;FD-STD冷冻干燥机 美国Labconco公司;Agilent 1100 HPLC/MS(SL)型带自动进样器的高效液相色谱与质谱联用仪 美国 Agilent公司;Zorbax SB-C18型反相色谱柱(4.6mm×250mm,5μm) 美国Agilent公司;UV-2900紫外可见分光光度计 日本日立公司。
1.2 实验方法
1.2.1 豆芽的制作 选取大豆籽粒用清水漂洗后于27℃纯水中浸泡8h,然后将大豆单层平铺托盘中,并用纱布覆盖,放入27℃左右的人工气候箱中发芽。分别收集不同芽长的豆芽测定其中大豆异黄酮总含量。选取芽长为3cm的大豆,将其芽茎与子叶进行分离,分别测定子叶和芽茎中的异黄酮组成[14]。
1.2.2 样品预处理 将大豆原料、胚芽和子叶分别用粉碎机预粉碎,并用石油醚(30~60℃)做溶剂,用索氏抽提法除油后再次粉碎并过80目筛;不同芽长的豆芽,豆芽芽茎和豆芽子叶样品均经冷冻干燥后,再用上述方法除油和粉碎。处理后的样品置于4℃冰箱中保存备用。
1.2.3 大豆异黄酮的提取 准确称取0.3g上述预处理后的样品粉末,按料液比为1∶30(g/mL),加入70%乙醇进行提取,提取温度为70℃,提取时间为3.0h。提取液用冷冻离心机离心后取上清液进行大豆异黄酮分析。每个样品进行3次平行提取,之后的分析取3个平行提取液测定的平均值[15]。
1.2.4 分光光度法测定大豆异黄酮的总含量 以染料木素为标准品,配制不同浓度的染料木素溶液,测定它们在260nm下的吸光度,以浓度(mg/mL)为横坐标,吸光度值为纵坐标,得到的标准曲线方程为:y=121.58x+0.0184,R2=0.9991。以70%乙醇水溶液为空白,测定不同大豆异黄酮提取液在波长为260nm下的吸光度值,带入标准曲线方程求出大豆异黄酮总含量,结果表示为mg(Ge当量)/g(样品干重)。
1.2.5 大豆异黄酮的组分鉴定 大豆异黄酮提取液中各个组分是根据液相洗脱过程中流出峰的紫外特征吸收,对应的质谱峰及其二级质谱所得碎片峰进行鉴定的。
液相色谱方法:以含0.1%HAc的水为流动相A,含0.1%HAc的甲醇为流动相 B,控制流速为0.5mL/min,柱温为35℃,采用 Zorbax SB-C18反相色谱柱(4.6mm ×250mm,5μm),按照如下梯度洗脱:0~20min,20% ~30%B;20~30min,30% ~35%B;30~40min,35% ~40%B;40~60min,40% ~80%B;60~65min,80% ~20%B;65~70min,20%B。采用DAD检测器,检测波长为260nm。
质谱条件:雾化气N230Psi;干燥气N210 mL/min;毛细管温度为350℃,在正离子模式下控制毛细管电压为3.5kV。扫描范围:m/z 100~2000。二级质谱:控制碰撞电压使母离子的信号强度占峰度最高的子离子强度的20%。
根据不同大豆异黄酮标品标准曲线,计算不同提取液中各大豆异黄酮组分的含量,结果换算为mg/100g样品干重。
1.2.6 数据处理 每组实验均做三组平行,用作实验分析的数据均表示为平均值±标准差。采用统计软件SAS9.2进行数据分析,所有显著性分析均基于α=0.05的显著水平。
2 结果与分析
2.1 大豆芽在发芽过程中异黄酮总含量的变化
我们首先用分光光度法对原料和不同芽长的豆芽中的大豆异黄酮总含量进行了分析,结果见图1。由图1可见,大豆发芽后大豆异黄酮总含量增加了,大豆异黄酮总含量在豆芽芽长3cm时达到最高。对大豆胚芽、大豆子叶、3cm豆芽芽茎和豆芽子叶中异黄酮总含量的比较(表1)表明,大豆胚芽中异黄酮总含量远高于大豆子叶;豆芽芽茎中的异黄酮总含量也明显高于豆芽子叶,但低于大豆胚芽中的含量;而豆芽子叶中异黄酮含量略高于大豆子叶。

图1 原料和不同芽长的豆芽中大豆异黄酮总含量Fig.1 Total isoflavone contents in soybean and germinated soybean in different
2.2 HPLC/MS结合MS/MS分析大豆及豆芽中异黄酮的组成
为研究大豆发芽后异黄酮组成的变化,我们首先通过HPLC/MS结合MS/MS对各样品的大豆异黄酮提取液进行了分析,图2为大豆原料、豆芽芽茎和豆芽子叶的大豆异黄酮提取物的液相色谱图,表2给出了该图中各色谱峰的保留时间、对应的质谱、二级质谱碎片峰以及根据质谱结果给出的对应的大豆异黄酮。
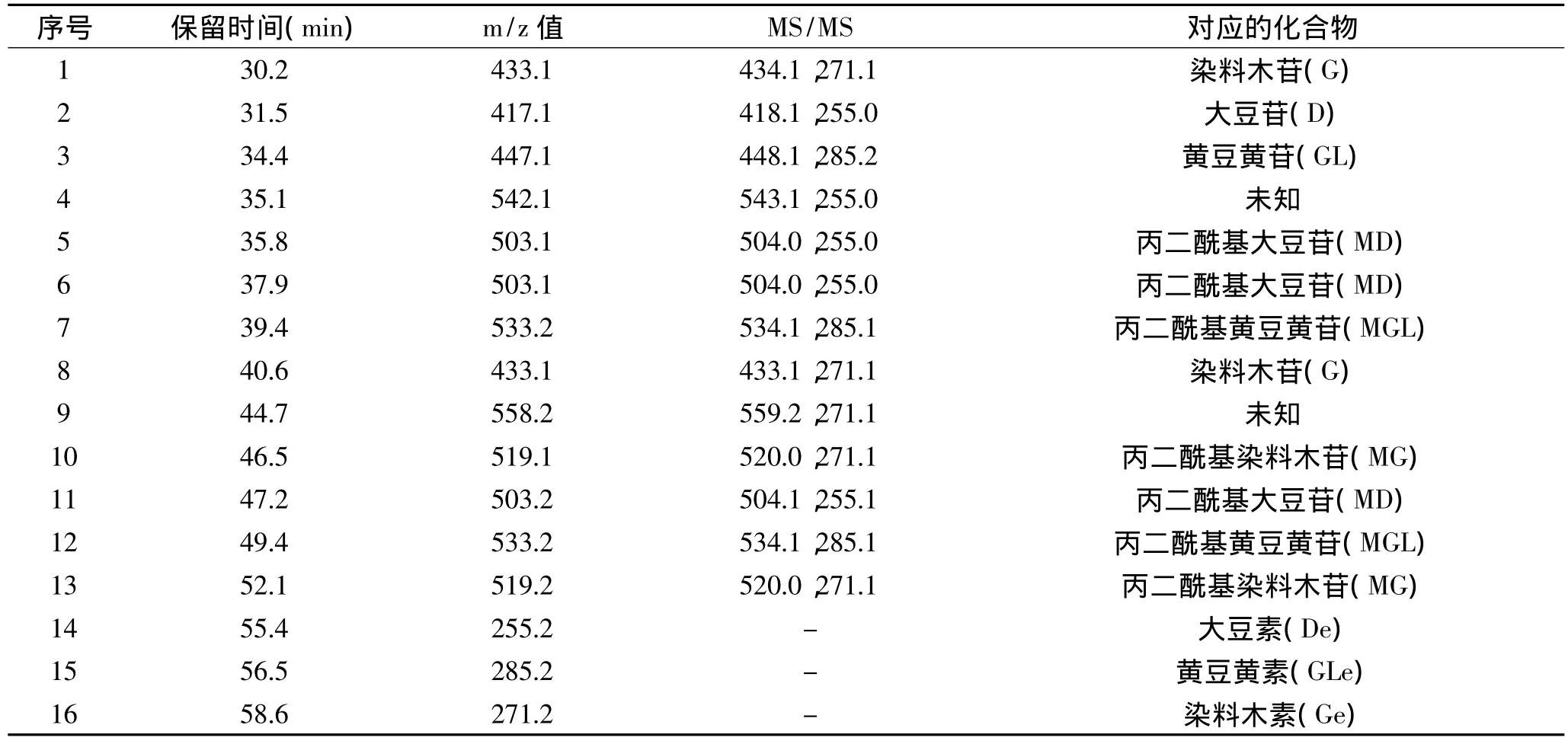
表2 大豆异黄酮提取液中主要色谱峰的保留时间、质荷比((m/z)、二级质谱碎片峰和对应的大豆异黄酮种类Table 2 Retention time,m/z value,fragments of MS/MS and corresponding isoflavone compounds of peaks recorded at HPLC chromatogram
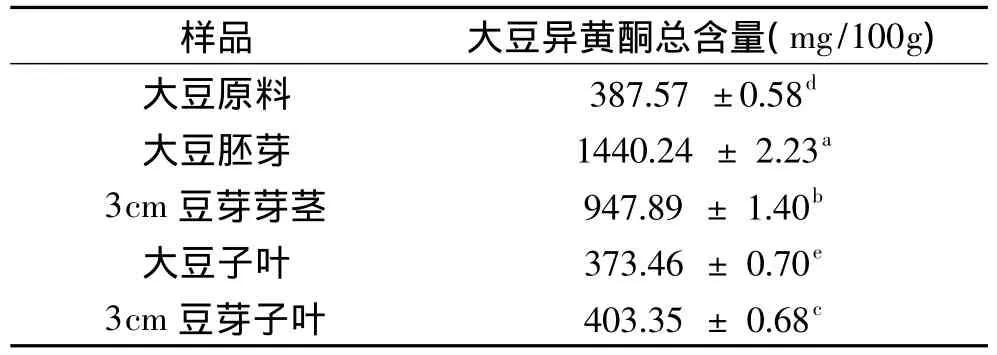
表1 大豆和芽长为3cm豆芽中大豆异黄酮的分布比较Table 1 Total isoflavone distribution in soybean and germinated soybean at lenghth of 3 cm
在液相色谱中共检测到16个主要峰,11种异黄酮,其中9个为已知的大豆异黄酮成分,两个为未知组分(峰4和峰6),两个未知组分的最大吸收波长均为260nm,峰4的串联质谱的碎片峰的基峰为255.0,对应于大豆素的正离子的m/z值,应属于大豆素类异黄酮,峰9串联质谱的基峰为271.1,对应于染料木素的m/z值,应属于染料木素类异黄酮,这两个化合物需进一步鉴定。此外,这两个组分只在豆芽芽茎中检测到,在大豆原料和豆芽子叶中均未检出。而乙酰基类大豆异黄酮未能在我们的样品中检出。
2.3 大豆及豆芽中各大豆异黄酮组分的含量及其分布
2.3.1 大豆异黄酮的标准曲线 按1.2.5中的色谱条件进样,以峰面积为纵坐标(Y),标准品浓度(mg/mL)为横坐标(X),分别得到染料木素、大豆素、黄豆黄素、大豆苷、染料木苷、黄豆黄苷的标准曲线方程如表3所示。
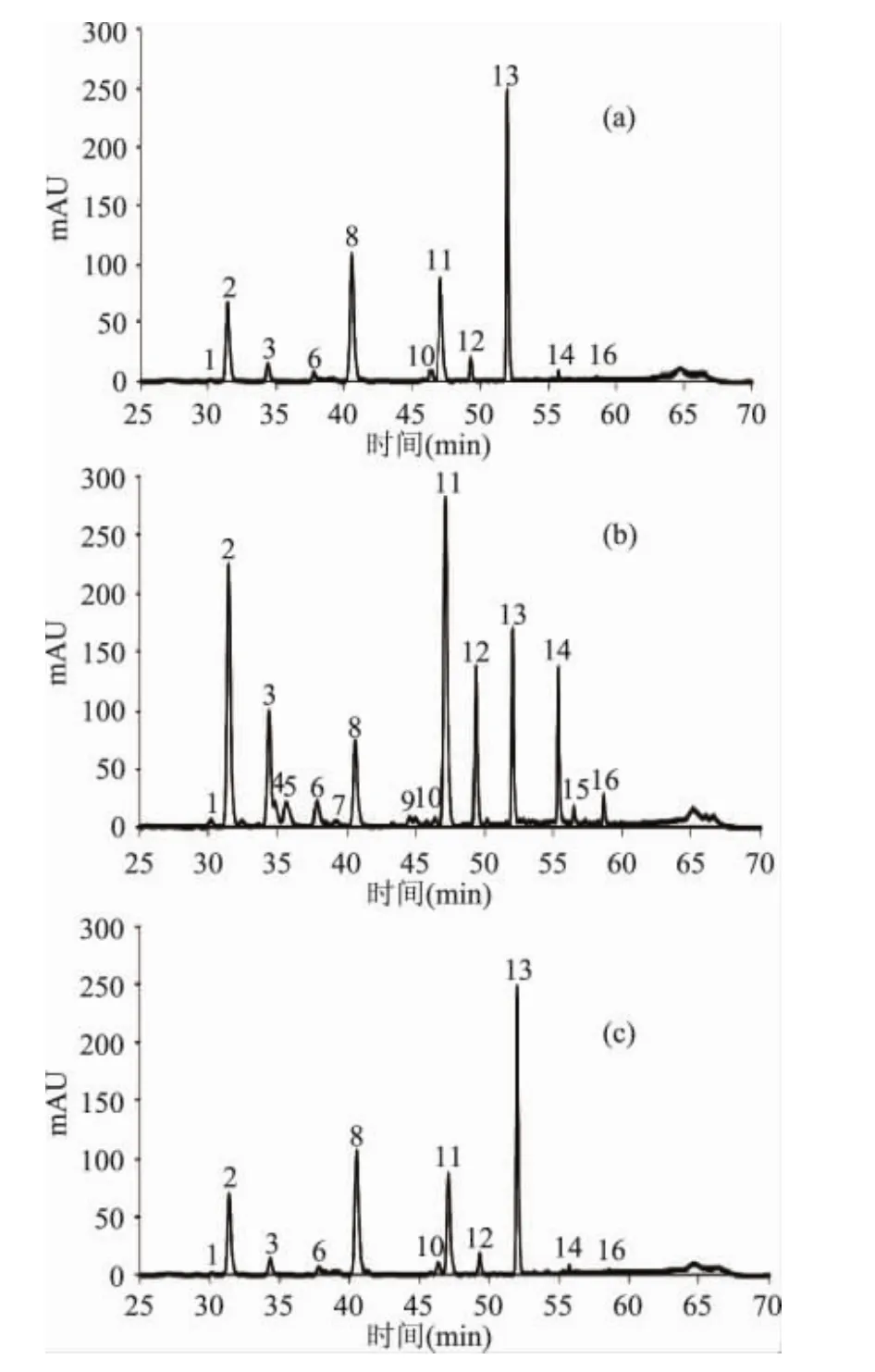
图2 大豆原料(a),3cm豆芽芽茎(b)及3cm豆芽子叶(c)的大豆异黄酮提取液的HPLC色谱图Fig.2 HPLC chromatogram of the isoflavone extractions from(a)soybean,(b)sprout and(c)cotyledon from germinated soybean respectively
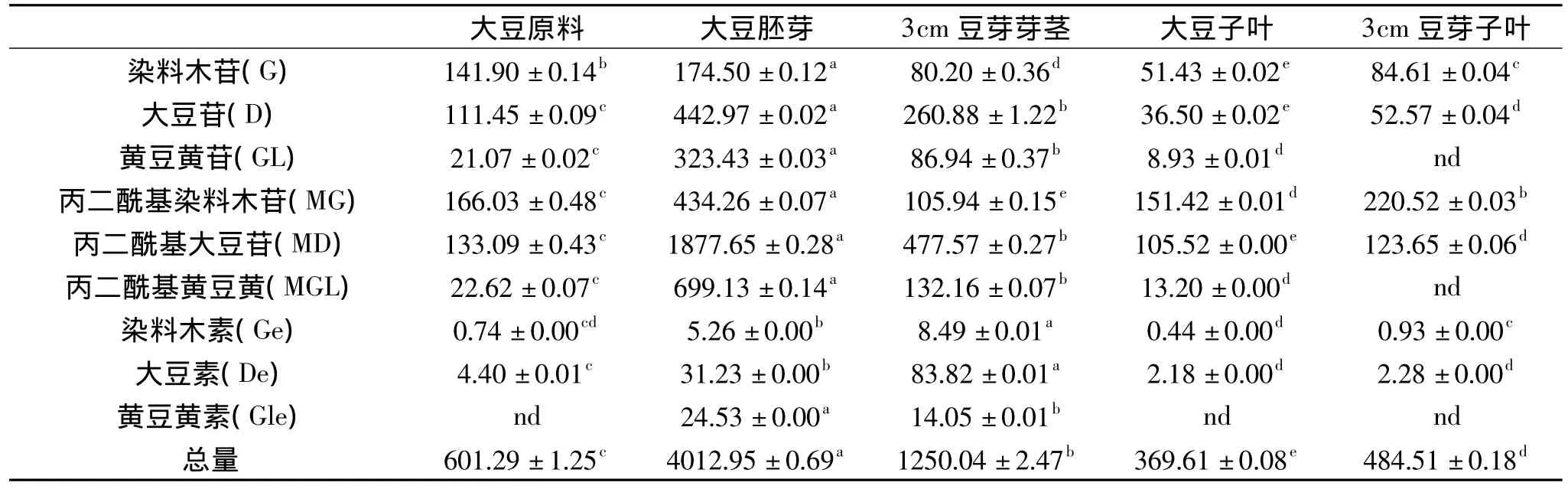
表4 大豆原料及3cm豆芽中各大豆异黄酮组分的含量及在原料胚芽、子叶及豆芽芽茎和子叶中的分布Table 4 Content of isoflavone in different samples

表3 各标准品的标准曲线Table 3 Standard curves of isoflavone standards
2.3.2 大豆及豆芽中各大豆异黄酮组分的含量及其分布 为比较大豆发芽前后各异黄酮含量及分布的变化,我们分别以染料木素、大豆素、黄豆黄素、大豆苷、染料木苷、黄豆黄苷对大豆原料,大豆胚芽、大豆子叶、3cm豆芽芽茎、3cm豆芽子叶中的各大豆异黄酮组分的含量进行了分析,其中丙二酰基染料木苷、丙二酰基大豆苷分别以染料木苷和大豆苷为标品进行定量分析,结果见表4。由表4可以看到,与光度分析结果一致,大豆籽粒的胚芽中各大豆异黄酮组分含量及总含量均远高于大豆子叶,其中大豆胚芽中的大豆异黄酮总含量为大豆子叶中的11倍左右,与Kim[16]等人的研究相符,其中大豆苷(D)、丙二酰基大豆苷(MD)含量分别为子叶中含量的12和17倍以上;黄豆黄苷(GL)、丙二酰基黄豆黄苷(MGL)含量分别为子叶中的32倍和53倍;染料木素(Ge)和大豆素(De)在胚芽中的含量分别为子叶中的12倍和14倍左右。黄豆黄素(Gle)在胚芽中含量远高于染料木素的含量,但在大豆子叶中未能检测到。
在豆芽中,豆芽芽茎中染料木苷(G)含量与豆芽子叶相近,丙二酰基染料木苷(MG)含量低于豆芽子叶外,其余各组分含量均显著高于豆芽子叶中的含量,其中大豆苷(D)和丙二酰基大豆苷(MD)的含量分别为豆芽子叶中的5倍和4倍左右;黄豆黄苷(GL)、丙二酰基黄豆黄苷(MGL)和黄豆黄素(GLe)在豆芽子叶中均未能检出,但在豆芽芽茎中的含量分别为86.94、132.16和14.05 mg/100g,高于染料木苷(G)、丙二酰基染料木苷(MG)和染料木素(Ge)的含量。豆芽子叶中各大豆异黄酮组分含量及总含量均高于大豆子叶,而豆芽芽茎中除大豆素(De)和黄豆黄素(GLe)外,其余各组分含量均显著低于大豆胚芽中的含量。
在大豆胚芽和豆芽芽茎中,丙二酰基大豆苷的含量最高,在大豆胚芽中占大豆异黄酮总含量的46.79%,而在豆芽芽茎中占38.2%;在大豆子叶和豆芽子叶中丙二酰基染料木苷的含量最高,分别占大豆异黄酮总含量的40.97% 和45.51%。在所有样品中,丙二酰基葡萄糖苷类异黄酮含量均高于相应的糖苷类,而苷元的含量最低。

图3 不同样品中各大豆异黄酮类别的干重百分含量Fig.3 Dry percentage of different isoflavones class in different samples
3 结论
对不同芽长的大豆芽中大豆异黄酮含量研究表明,大豆发芽后异黄酮总含量逐渐增加,在芽长为3cm时达到最高,其中芽茎中大豆异黄酮的总含量达到子叶的4倍以上,为大豆原料的2倍以上。由图3可以看出,大豆和大豆芽不同部位的大豆异黄酮组成存在显著差异,在大豆胚芽和豆芽芽茎中,大豆苷类(D+MD)异黄酮含量最高,其次是黄豆黄苷类(GL+MGL),染料木苷类大豆异黄酮(G+MG)含量次之,苷元类(De+Ge+Gle)含量最低。在大豆、大豆子叶和豆芽子叶中则是染料木苷类大豆异黄酮(G+MG)含量最高,其次是大豆苷类(D+MD)。有研究表明[17],在代谢过程中,大豆苷类异黄酮的生物可利用率高于染料木苷和黄豆黄苷类异黄酮,而异黄酮苷元的生物可利用度高于异黄酮糖苷和丙二酰基葡萄糖苷类异黄酮,我们的研究结果表明,豆芽芽茎中大豆异黄酮总含量,大豆苷类和苷元类异黄酮的含量显著高于大豆原料和豆芽子叶,因此相比较大豆本身,大豆芽芽茎可能是一种好的大豆异黄酮的食品来源。
[1]侯建峰.植物雌激素干预乳腺癌的研究进展[J].临床肿瘤学杂志,2010,15(1):82-85.
[2]Yukihiro I,Masayuki I,Akemi M,et al.Intake of fermented soybeans,natto,is associated with reduced bone loss in postmenopausal women:Japanese population-based osteoporosis(JPOS)study[J].Journal of Nutrition,2006,136:1323-1328.
[3]金庆跃,宋爱清,毛唯叶,等.大豆异黄酮对不同雌激素受体基因型绝经后妇女骨代谢的影响[J].中国老年学杂志,2011,31(2):503-504.
[4]韩小存,丁长河.大豆膳食纤维和大豆异黄酮对糖尿病影响[J].粮食与油脂,2012,6:7-9.
[5]逄晓云,沈金芳,贡沁燕,等.大豆异黄酮对大鼠血脂的影响及其体内外抗氧化作用研究[J].中国临床药理学与治疗学,2008,13(1):62-67.
[6]吴伟,王储炎,吴传华,等.大豆异黄酮的研究概况[J].农产品加工,2008,3(3):33-36.
[7]Hagen M K,Ludke A,Araujo A S,et al.Antioxidant characterization of soy derived products in vitro and the effect of a soy diet on peripheral markers of oxidative stress in a heart disease model[J].Canadian Journal of Physiology and Pharmacology,2012,90(8):1095-1103.
[8]Adams M R,Golden D L,William s J K.Soy Protein containing isoflavones reduces the size of atherosclerotic plaques without affecting coronary artery reactivity in adult male monkeys[J].Journal of Nutrition,2005,135:2852-2856.
[9]廖苇萍,石元刚.黄芪多糖和大豆异黄酮对糖尿病大鼠糖代谢的影响[J].第三军医大学学报,2007,29(5):416-418.
[10]Anna H W,Mimi C Y,Chui C T,et al.Plasma isoflavone levels versus self-reported soy isoflavone levels in Asian-American women in Los Angeles County[J].Carcinogenesis,2004,25(1):77-81.
[11]Chris H T,Kira G,Xiao H,et al.Phase I pharmacokinetic and pharmacodynamic analysis of unconjugated soy isoflavones administered to individuals with cancer[J].Cancer Epidemiology,2003,12:1213-1220.
[12]于立梅,钟惠曾,于新,等.大豆发芽过程中营养成分变化规律的研究[J].中国粮油学报,2010,25(8):19-22.
[13]李振艳,张永忠,任红波.大豆发芽过程在异黄酮、γ-氨基丁酸等成分含量变化的研究[J].食品工业科技,2009,30(12):356-361.
[14]Luz M P,Mark A B,José Marcos G M.Effect of time and temperature on bioactive compounds in germinated Brazilian soybean cultivar BRS 258[J].Journal of Food Research International,2010,43:1856-1865.
[15]Guajardo-Flores D,García-Patiño M,Serna-Guerrero D.Characterization and quantification of saponins and flavonoids in sprouts,seed coats and cotyledons of germinated black beans[J].Journal of Food Chemistry,2012,134:1312-1319.
[16]Kim J A,Hong S B,Jung W S,et al.Comparison of isoflavones composition in seed,embroyo,cotyledon and seed coat of cooked-with-rice and vegetable soybean(Glycine max L.)varieties[J].Food Chemistry,2007,102:738-744.
[17]陈宝江,崔扬健.大豆异黄酮作用机制及在动物生产中的应用[J].动物科学与动物医学,2003,20(10):53-55.

