食用精炼大豆油DNA提取及单管巢式PCR检测
姚 芹,宋 浩,陈 枫
(1.苏州农业职业技术学院,江苏省食品安全快速检测工程技术研究开发中心,江苏苏州215008;2.苏州市吴江区农业委员会,江苏苏州215200;3.苏州市吴江区农产品检测中心,江苏苏州215200)
近年来,转基因产品的安全性问题日益受到全世界的关注。据报道2012年我国进口了5838万t大豆,其中绝大部分都是转基因大豆,我国大豆加工的最大行业是浸油业,因此大豆油的转基因检测十分重要。大豆油在得到粗油后有较为复杂的精炼过程,包括沉降、脱胶、脱酸、脱色、脱臭、脱蜡和脱致癌物等,仅沉降和脱胶两个步骤就除去大豆粗油中绝大多数的 DNA[1-2]。高质量 DNA 模板的获取,是转基因大豆油进行检测的前提。最常用检测转基因的方法是基于DNA的检测技术,基于蛋白质的检测技术并不适用于分析检测深加工食品[3]。目前国内外针对大豆油是否含有转基因成分主要检测的基因有35S、NOS、CTP、CP4EPSPS 及其物种转化事件特异性基因。巢式及半巢式PCR技术可以使检测的下限下降几个数量级,故在DNA残留量微少的转基因大豆油检测中被成功使用[4-5]。单管巢式PCR是在普通PCR和巢式PCR反应的基础上发展起来的一种PCR技术,目前在医学,兽医学的微量DNA检测方面应用较多[6-9],但在转基因大豆油检测中未见报道。本实验先用从转基因大豆中提取出的高质量大豆DNA为模板,利用针对转基因Roundup Ready大豆外源基因设计的2条引物进行温度梯度PCR,筛选出内外两轮扩增的最佳退火温度,在此退火温度基础上对采用两种不同方法从食品精炼大豆油中提取的DNA进行单管巢式PCR检测,并成功检测到了转基因成分,为转基因大豆油的检测提供了一种快速,方便,敏感度高的方法。
1 材料与方法
1.1 材料与仪器
从阿根廷进口的含CaMV35s启动子、CP4EPSPS基因的转基因Roundup Ready大豆、阴性大豆 苏州吴江区农委馈赠;转基因大豆精炼油 金龙鱼精炼一级大豆油;DNA提取试剂盒 上海博耀生物科技有限公司;TaqDNA聚合酶、dNTPs、DNA Ladder 上海生工生物工程有限公司;引物 金唯智生物科技有限公司合成;PCR仪 Mastercycler ep Eppendorf中国有限公司;Biorad GelDoc XR伯乐凝胶成像系统 美国。
1.2 实验方法
1.2.1 CTAB法提取大豆基因组DNA 分别称取阴性大豆、转基因Roundup Ready大豆0.3g加液氮研磨成粉末状,迅速移入1.5mL离心管中,加入1.8mL CTAB提取液 I,2.0mL CTAB提取液Ⅱ,5μL巯基乙醇混匀,于65℃水浴30min,其间不停的振荡,冷却后加入 1.5mL 的酚/氯仿/异戊醇,混匀,13000r·min-1离心10min;取上清,加入等体积的氯仿/异戊醇,混匀,13000r·min-1离心 10min;取上清,加入 0.8 倍体积的异丙醇,混匀13000r·min-1离心 10min;取沉淀,用70%的乙醇洗2次,自然干燥,150μL TE溶解,待用。
1.2.2 改良试剂盒法提取精炼大豆油中的DNA 分别取6mL待检油于三角瓶中,加入3mL的TE缓冲液和洁净转子,在磁力搅拌器上搅拌0.5h。转至10mL 离心管中,12000r·min-1离心 20min,弃油相,在1.5mL离心管中加入0.5mL水相。加入0.6mL溶液A,室温振荡3~5min。将溶液全部转移到离心吸附柱中,室温放置 2min。12000r·min-1室温离心 1min,弃收集管中穿透液。加入0.8mL通用洗柱液到离心吸附柱中,12000r·min-1室温离心 1min,弃收集管中穿透液。12000r·min-1室温离心30s。在离心吸附柱的滤膜的中部加入30μL通用洗脱液,然后将离心吸附柱套入一新的1.5mL离心管中,室温放置10min。12000r·min-1室温离心1min,离心管中收集的样品即为大豆精炼油DNA。
1.2.3 冷冻干燥法提取大豆毛油、精炼大豆油中的DNA 参照白立群等[10]分别取添加了2μg大豆DNA的大豆毛油和精炼大豆油20mL于50mL离心管中,加20mL无菌水,震荡40min,5000×g离心30min,小心将水相转移到培养皿中,将培养皿放于-80℃冷冻过夜,然后将培养皿转至真空干燥机中至水分完全蒸发,加2mL CTAB提取缓冲液至培养皿,65℃温浴10min,用CTAB提取缓冲液小心仔细地反复冲洗培养皿,将冲洗液转移到1.5mL离心管中,400μL/管,加1μL 2.5%线性丙烯酰胺,1/10体积的3.2mol/L NaAc,1mL 无水乙醇,混匀,-20℃放置 1h,15000g 离心10min去除上清液,加400μL无菌水充分溶解沉淀,15000g离心10min去除上清液,70%乙醇洗沉淀1次,晾干,加100μL无菌水充分溶解沉淀,备用。
1.3 PCR引物序列
单管巢式PCR引物设计在Primer Primer5.0引物设计软件上对引物序列做了一些改动。外源基因及内源基因扩增引物位置见图1,引物序列及扩增片段大小见表1。
1.4 单管巢式PCR反应体系构建及反应条件

图1 单管巢式PCR引物位置图片Fig.1 Positions of primers in Single-tube nested PCR
内源基因Lectin扩增:采用25μL体系,在PCR管中依次加入 ddH2O 12.25μL,10 ×PCR Buffer 2.5μL,3mmol/L dNTP 2μL,10pmol/L 的 Lectin-Fout和 Lectin-Rout各 1μL,150pmol/L 的 Lectin-Fin 和Lectin-Rout各 2μL,DNA 模板 2μL,TaqDNA 聚合酶0.25μL。循环条件为:94℃预变性4min;接外循环94℃变性 25s,56℃ 退火 25s,72℃ 延伸 30s,25 个循环;接内循环94℃变性25s,45℃退火30s,72℃延伸30s,30 个循环;后延伸 5min。

表1 单管巢式PCR所用的引物名称、引物序列及扩增片段大小Table 1 Information of primers in Single-tube nested PCR
外源基因CP4EPSPS扩增:采用25μL体系,在PCR管中依次加入 ddH2O 12.25μL,10×PCR Buffer2.5μL,3mmol/L dNTP 2μL,5pmol/L 的CP4EPSPS-Fout和 CP4EPSPS-Rout各 1μL,150pmol/L的 CP4EPSPS-Fin和 CP4EPSPS-Rout各2μL,DNA 模板 2μL,TaqDNA 聚合酶 0.25μL。循环条件为:94℃预变性4min;接外循环94℃变性25s,62℃退火 25s,72℃ 延伸 30s,25 个循环;接内循环94℃变性 25s,51℃ 退火 30s,72℃ 延伸 30s,30 个循环;后延伸5min。
1.5 单管巢式PCR退火温度的优化
为优化单管巢式PCR反应,对内外引物最适退火温度进行筛选。对两段预扩增片段的外引物进行温度梯度PCR,温度梯度设为9℃,在外引物退火温度的基础上对内引物进行温度梯度PCR,温度梯度设为9℃。
2 结果与讨论
2.1 对外引物进行梯度PCR扩增,筛选最佳退火温度
两段DNA片段内外引物梯度PCR扩增,均以转基因Roundup Ready大豆为材料。图2、图3分别为内源基因Lectin和外源基因CP4EPSPS外引物退火温度梯度PCR结果。

图2 内源基因Lectin PCR外引物最佳退火温度筛选Fig.2 Screening of Lectin gene outer primer optimal annealing temperature

图3 外源基因CP4EPSPS PCR外引物最佳退火温度筛选Fig.3 Screening of CP4EPSPS gene outer primer optimal annealing temperature
由图2、图3可以看出,随着退火温度的变化,产物量也发生变化,其中图2中55℃时条带最亮,图3中62℃时条带最亮,故通过梯度PCR温度筛选得到内源基因Lectin和外源基因CP4EPSPS外引物的最佳退火温度分别为:55、62℃。
2.2 对内引物进行梯度PCR扩增,筛选最佳退火温度
图4、图 5内源基因 Lectin和外源基因CP4EPSPS内引物退火温度梯度PCR结果。
通过图4、图5的梯度PCR得到内源基因Lectin和外源基因CP4EPSPS内引物的最佳退火温度分别为:45℃和51℃,两对基因外引物与内引物之间的温度差分别为10℃和11℃,在单管巢式PCR体系中,第一轮扩增只允许外引物复性、扩增,而内引物不能与模板复性,故一般外引物退火温度较高,第二轮扩增采用较低的退火温度,实现以内引物介导的第二轮扩增。故在单管巢式PCR实验中,一般采用先固定外引物退火温度,在此基础上筛选内引物退火温度的方法提高单管巢式PCR实验的特异性和重复性。
2.3 单管巢式PCR扩增

图4 内源基因Lectin PCR内引物最佳退火温度筛选Fig.4 Screening of Lectin gene inner primer optimal annealing temperature
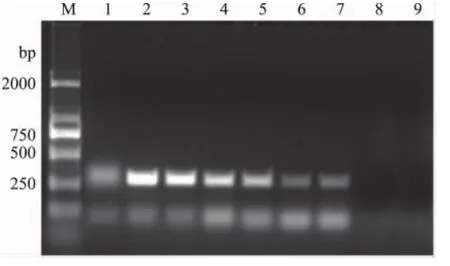
图5 外源基因CP4EPSPS PCR内引物最佳退火温度筛选Fig.5 Screening of CP4EPSPS gene inner primer optimal annealing temperature
使用内源基因Lectin和外源基因CP4EPSPS各自的内外引物最佳退火温度为条件,非转基因的阴性大豆作为对照,无条带产生。改良试剂盒法和冷冻干燥法提取大豆精炼油DNA为模板进行单管巢式PCR反应,获得的片段长度为396、300bp,与预期结果相符。本实验采用改良试剂盒法,通过延长水相乳化的时间和延长通用洗脱液醇类与DNA共沉淀的时间来提高DNA提取的质量,另外本实验还在预处理时采用冷冻干燥法[10]对大豆油进行浓缩,使微量DNA浓度提高到沉淀剂作用范围,两种方法提取出的DNA都能满足单管巢式PCR的扩增要求,且条带清晰。在对转基因大豆油进行单管巢式PCR前先筛选过内外引物的最佳退火温度,故PCR结果无非特异性条带产生。
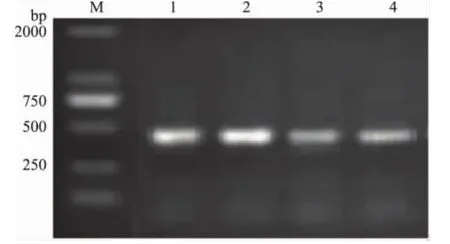
图6 内源基因Lectin单管巢式PCRFig.6 Single-tube nested PCR of Lectin gene

图7 外源基因CP4EPSPS单管巢式PCRFig.7 Single-tube nested PCR of CP4EPSPS gene
3 结论
本实验设计的单管巢式PCR 4条引物,分别位于花椰菜花叶病35s启动子,叶绿素转移肽基因CTP及草甘膦基因CP4EPSPS区域,针对的是特异转化的外源基因。常规的巢式PCR方法一般将第1次PCR的产物取出加入到第2次PCR的反应体系中,该法操作烦琐、费时,容易造成污染,本实验采用2次PCR的4个引物置于同一PCR管中进行扩增,但一次性加入引物的单管巢式PCR方法对内外引物的退火温度有特殊要求,即外引物的退火温度高,内引物的退火温度低,在引物设计时就加以注意,并在实验中进行了内外引物的最佳退火温度筛选,故反应条带异性强,重复性高。本实验用转基因精炼一级大豆油为原料提取DNA,进行转基因成分的单管巢式PCR检测,灵敏度高、特异性强,且快速方便,为转基因大豆精炼油的检测提供了新方法。
[1]何景,徐文涛,黄昆仑.食用油DNA提取及检测技术的研究进展[J].食品工业科技,2012(12):382-391.
[2]陈颖,王媛,徐宝梁,等.食品加工工艺对大豆内源基因降解变化规律的影响[J].中国粮油学报,2012,20(4):60-64.
[3]吴清平,董晓辉,张菊梅,等.转基因食品检测技术研究进展[J].中国卫生检验杂志,2007,17(10):1910-1911.
[4]黄昆仑,罗云波.用巢式和半巢式PCR检测转基因大豆Roundup Ready及深加工食品[J].农业生物技术学报,2003,11(5):461-466.
[5]张明辉,高学军,于艳波,等.三重巢式PCR技术检测抗草甘膦转基因大豆深加工产品[J].农业生物技术学报,2006,14(5):752-756.
[6]郑秀红,贾立军,邢莹,等.猪附红细胞体单管巢式PCR诊断方法的建立及应用[J].中国兽医学报,2011(2):205-208.[7]周潇,刘巧,李慧兰.单管半巢式PCR法检测梅毒螺旋体的分析探讨[J].中国中医药资讯,2010(15):149-150.
[8]杨建荣,戴利亚,陈占国.单管巢式PCR结合熔解曲线分析检测乙肝病毒YMDD变异[J].使用医学杂志,2007(2):195-198.
[9]曾轶兵,吴移谋,黄澍杰,等 .Development and Clinical Application of a Single-tube Nested PCR Method to Amplify the DNA Polymerase I Gene of Treponema Pallidum[J].中华性传播感染杂志,2004(2):195-198.
[10]白立群,吴亚君,韩建勋,等.一种有效的大豆精炼油DNA提取新方法——冷冻干燥法[J].食品与发酵工业,2009(12):155-159.

