中国耐多药结核分枝杆菌二线抗结核药物敏感性分析
赵冰 宋媛媛 逄宇 李强 欧喜超 夏辉 赵雁林
耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)是全世界结核病控制工作面临的重大难题,耐多药结核病全球分布不均,中国和印度是世界上耐多药疫情最为严重的两个国家,上述两国每年新发耐多药结核病患者例数占全世界50%以上[1]。由于对一线药物中的利福平(RFP)和异烟肼(INH)同时耐药,耐多药结核病的治疗主要依靠二线抗结核药物,特别是氟喹诺酮类和二线注射类药物[2]。因此,了解一个国家或地区耐多药患者对二线抗结核药物的耐药性,对于指导耐多药患者形成有效的化疗方案具有重要意义。前期文献表明,不同国家地区的结核病患者对二线抗结核药物的耐药率差别较大。在韩国,耐多药患者对氧氟沙星(Ofx)耐药率超过40%[3],而俄罗斯仅有1.3%的耐多药患者对Ofx耐药[4],目前尚缺乏中国耐多药患者中对二线抗结核药物的耐药状况分析。
本研究选取2007年全国耐药基线调查的耐多药结核分枝杆菌菌株[5],对其进行7种二线抗结核药物敏感性试验并分析,以了解我国二线抗结核药物的耐药率,为制定合理的耐多药结核病化疗方案和控制措施提供科学依据。
材料和方法
一、菌株来源
2007—2008年,国家结核病参比实验室组织实施了全国首次耐药基线调查[5],2008—2009年国家参比实验室采用比例法完成所有菌株对4种一线抗结核药物[RFP、INH、链霉素(S)和乙胺丁醇(EMB)]和2种二线抗结核药物[Ofx和卡那霉素(Km)]的传统药敏试验。本研究从此次基线调查所收集的菌株中,选取了2008年4月至2008年7月全国耐药基线调查点的126株耐多药菌株,均为国家参比实验室菌株库中保藏。选用罗氏培养基对选取的菌株进行复苏传代。标准菌株H37Rv来自于国家参比实验室菌株库保存标准株。
二、主要试剂
罗氏培养基及分枝杆菌药敏罗氏培养管均为国家结核病参比实验室自制。配制药敏培养基所用药粉均购置于美国Sigma-Aldrich公司。
三、比例法药物敏感性试验
具体的操作依照参考文献[6]进行。药敏试验中共包括2种一线抗结核药物和7种二线抗结核药物,具体浓度如下:S:4.0 μg/ml;EMB:2.0 μg/ml;Ofx:2.0 μg/ml;Km:30.0 μg/ml;卷曲霉素(Cm):40.0 μg/ml;乙硫异烟胺(Eth):40.0 μg/ml;丙硫异烟胺(Pto):40.0 μg/ml;环丝氨酸(Cs):30.0 μg/ml;对氨基水杨酸(PAS):1.0 μg/ml。每批药敏试验选取H37Rv菌株作为对照。对菌株的药物敏感性结果判断标准如下:耐药百分率=(含药培养基上生长的菌落数/对照培养基上生长的菌落数)×100%。如果耐药百分率<1%,则认为受试菌对该抗结核药物敏感;如果耐药百分比>1%,则认为受试菌对该抗结核药物耐药。
四、统计学分析
采用SPSS 15.0软件进行统计分析,结核分枝杆菌对各种抗结核药物的耐药情况计数资料的组间比较采用卡方检验,当计数资料的频数小于5的情形时,进行Fisher精确概率法检验,仅当P<0.05时,认为差异有统计学意义。
结 果
一、耐多药菌株耐药谱状况
在126株耐多药结核分枝杆菌菌株中,有60株(47.6%)分离于初治患者,其余66株(52.4%)分离于复治患者。传统药敏试验结果表明,对于一线药物S和EMB,总体耐药率分别为73.0%和58.7%;对于二线药物,Ofx和Eth耐药率最高,分别为25.4%和23.0%;其次为Km和Cs,其耐药率分别为17.5%和13.5%;最后为Cm、Pto和PAS,耐药率均为3.2%。不同抗结核药物耐药率在初治和复治患者中具有可比性(P值均>0.05),除Km和Cs。Km在初治患者和复治患者的耐药率分别为33.3%和3.0%,统计表明两者差异有统计学意义(χ2=20.025,P<0.01);此外,初治患者Cs耐药率为21.7%,显著高于复治患者的6.1%(χ2=6.558,P=0.017)(表1)。

表1 不同类别患者的耐多药菌株药物耐药谱分析
注S:链霉素;EMB:乙胺丁醇;Km:卡那霉素;Ofx:氧氟沙星;Cm:卷曲霉素;Eth:乙硫异烟胺;Pto:丙硫异烟胺;Cs: 环丝氨酸;PAS:对氨基水杨酸
二、二线抗结核药物交叉耐药情况分析
对Km耐药的12株中,有3株同时对Cm耐药;而在对Cm耐药的4株中,有3株同时对Km耐药(表2)。
对Eth耐药的29株中,有4株(13.8%)同时对Pto耐药;而在对Pto耐药的4株中,有4株同时对Eth耐药。
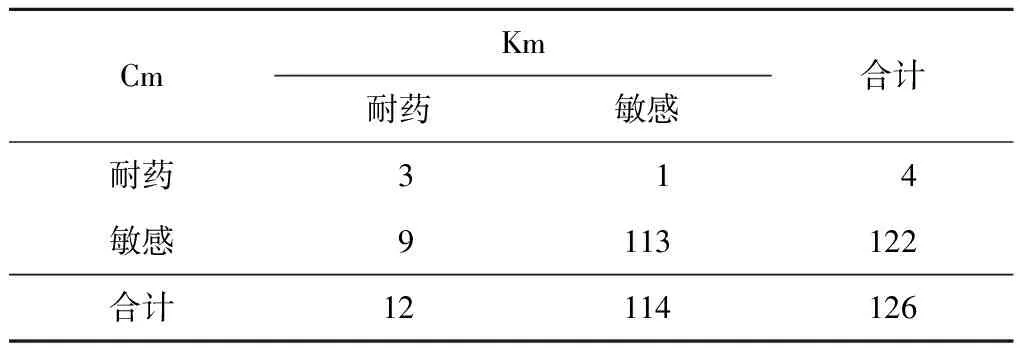
表2 Km与Cm交叉耐药情况分析(株)
注Km:卡那霉素;Cm:卷曲霉素

表3 Eth和Pto交叉耐药情况分析(株)
注Eth: 乙硫异烟胺; Pto: 丙硫异烟胺
讨 论
本研究结果显示,我国分离的耐多药结核分枝杆菌菌株对Ofx、Eth、Km和Cs具有较高的耐药率。在我国多个地区进行的研究表明,山东省72.6%的耐多药结核分枝杆菌对二线抗结核药物耐药[7];河南省耐多药结核病患者对二线抗结核药物Ofx和阿米卡星(Am)的耐药率达48.1%[8],上海市耐多药结核病患者中,对Ofx、Km的耐药率分别为38.4%和14.3%[9],武汉市耐多药患者中,分别有26.8%和5.3%的患者对Ofx和Km耐药[10]。与上述资料比较,本研究结果低于山东和河南的监测结果,与上海和武汉的结果相近。上述差异反映出我国不同地区耐多药菌株对于二线抗结核药物的耐药率差别较大,经济发达地区的耐药率较低,而经济欠发达地区的耐药率较高。耐药率高低通常反映一个地区耐多药结核病诊断能力状况,同样也可作为抗结核药物化疗效果评价。一方面,对耐多药结核病患者的早期发现,特别是对患者标本中分离的菌株进行准确的传统药物敏感性试验(DST)的结果将成为指导患者用药的重要依据,我国“十二五”规划中进一步加强地市级实验室开展传统药敏试验的能力,将有效解决对耐药患者,特别是耐多药患者的诊断问题。根据药敏试验结果合理制定耐多药患者的化疗方案,将对提高耐多药患者疗效、减少二线药物耐药情况的发生有重要意义;另一方面,治疗的规范性对患者的治疗转归情况有重要影响。分析上述耐多药患者的治疗方案及患者后续随访情况,将有助于不同地区制定有效的耐多药患者管理方案。此外,菌株的来源可能也会影响其耐药率,来自专科医院就诊的患者的耐药率高于来自于CDC的患者,上述因素也可能影响研究结果。
在分析初治和复治耐多药患者的耐药率时,笔者发现初治耐多药患者对Km和Cs的耐药率显著高于复治耐多药患者。初治耐多药患者为首次就诊并接受抗结核治疗者,因此,其所感染的致病菌应为其他患者传播而来。这种不同患者耐药率的差异可能反映出对Km和Cs耐药的菌株具有更强的传染性,然而受限于本研究中样本量相对较少,对更大样本的耐多药菌株的耐药率分析将有助于证实上述推论。
Km和Cm同属于二线注射类抗结核药物。与前期研究结果一致,本研究表明两者间存在单向交叉耐药,大部分Cm对耐Km的菌株仍然敏感;Cm是一种有效的抗结核药物,而且不良反应小,因此在对氨基糖苷类抗结核药物耐药率较高的地区,可以考虑使用Cm[12-13]。Eth与Pto同属属二线异烟酸衍生物类抗结核药物,研究表明Eth和Pto存在交叉耐药,但与INH无交叉耐药性。本研究发现Eth和Pto存在单向耐药,对Pto耐药的菌株全部对Eth耐药,而对Eth耐药的菌株仅有13.8%同时对Pto耐药。虽然硫代异烟酰胺类抗结核药物Pto和Eth抗结核作用仅为INH的1/5,但是由于耐多药菌株对INH耐药现象比较普遍,因此上述两种药物成为治疗耐多药结核病化疗方案中的重要组成部分[12]。本研究结果提示,选取Pto可能比应用Eth具有更好的适用性和抗菌效能。
综上所述,中国耐多药结核分枝杆菌菌株对二线抗结核药物具有较高的耐药性,特别是Ofx和Eth。这对结核病控制,特别是耐多药结核病控制带来严峻的挑战,也提示在耐多药结核病患者中应开展二线抗结核药物敏感性检测,从而为耐多药患者形成合理的化疗方案提供依据。
参 考 文 献
[1] World Health Organization. Anti-tuberculosis drug resistance in the world: fourth global report[R/OL]. Geneva: WHO, 2008.[2013-08-04].http://whqlibdoc.who.int/hq/2008/WHO_HTM_TB_2008.394_eng.pdf.
[2] World Health Organization. Multidrug and extensively drug-resistant TB (M/XDR-TB): 2010 global report on surveillance and response[R/OL]. Geneva: WHO. 2010.[2013-08-04].http://whqlibdoc.who.int/publications/2010/9789241599191_eng.pdf.
[3] Jeon CY, Hwang SH, Min JH, et al. Extensively drug-resis-tant tuberculosis in South Korea: risk factors and treatment outcomes among patients at a tertiary referral hospital. Clin Infect Dis, 2008, 46(1): 42-49.
[4] Toungoussova OS, Mariandyshev AO, Bjune G, et al. Resis-tance of multidrug-resistant strains ofMycobacteriumtuberculosisfrom the Archangel oblast, Russia, to second-line anti-tuberculosis drugs. Eur J Clin Microbiol Infect Dis, 2005, 24(3): 202-206.
[5] 中华人民共和国卫生部. 全国结核病耐药性基线调查报告 (2007—2008年). 北京:人民卫生出版社,2010.
[6] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006:46-51.
[7] 王海英,王燕,于春宝,等.2004—2007年山东省部分结核分枝杆菌耐药情况检测分析.预防医学论坛,2008,14(12):1075-1076.
[8] 张国龙,杜长梅,苍泽卓也,等.中日合作对河南省结核菌二线药物耐药监测研究.医药论坛杂志,2005,26(19):14-16.
[9] 沈鑫,李静,高谦,等. 2009年上海市耐药肺结核患者抗结核药物耐药状况调查. 中华结核和呼吸杂志,2011, 34(6): 451-453.
[10] 周美兰,陈梓,王坚杰,等. 武汉市涂阳肺结核患者耐药率及耐药谱分析. 中国防痨杂志,2013,35(2):97-102.
[11] 曹广云, 肖和平, 闫丽萍, 等. 三种注射用抗结核药物对结核分枝杆菌的耐药情况分析. 中国防痨杂志,2010,32(4): 227-230.
[12] 常珊, 付育红, 李琦, 等. 结核分枝杆菌临床分离株对四种注射用抗结核药物耐药及交叉耐药分析. 中国防痨杂志,2013, 35(1): 37-40.

