肺结核患者全血γ干扰素释放试验影响因素的探讨
杨新婷 杨扬 杜凤娇 卜建玲 梁清涛 李琦 陈效友
机体在感染结核分枝杆菌后,体内存在特异的效应T淋巴细胞,致敏的T淋巴细胞在体外再次受到结核分枝杆菌特异抗原的刺激时,会分泌并释放IFN-γ,这就是γ-干扰素释放试验(interferon-gamma release assay,IGRAs)所依据的基本原理。其所选用的结核分枝杆菌特异抗原是来自于RD1区的2个早期分泌蛋白:早期分泌抗原靶-6(early secretory antigenic target, ESAT-6)与培养滤过蛋白-10(culture filtrate protein,CFP-10);因其仅存在于结核分枝杆菌复合群,在所有的卡介苗和绝大多数非结核分枝杆菌中缺乏,因此可保证其较高的特异性。此外,ESAT-6和 CFP-10还是重要的T细胞抗原,能诱导机体产生记忆性免疫应答[1-2]。
目前已经有2个商业化的IGRAs的试剂盒分别通过美国和欧洲FDA的批准得以在临床上用于诊断结核潜伏感染(latent tuberculosis infection,LTBI)和辅助诊断活动性肺结核(active tuberculosis,ATB)。第一种是酶联免疫斑点实验(enzyme-linked immunospot assay,ELISPOT),其商品化的试剂盒为T-SPOT.TB(T-SPOT)试剂盒,试验需要分离外周血单个核细胞(peripheral blood mononuclear cell, PBMC),然后与RD1区抗原共同孵育,使用酶联免疫斑点的方法检查分泌干扰素的特意效应T淋巴细胞;第二种是方法是全血γ干扰素释放试验,其商品化试剂盒为QuantiFERON-TB GOLD(QFT-G)和QuantiFERON-TB GOLD In Tube(QFT-GIT),其主要优势为不用分离PBMC,直接将肝素化的全血与RD1区抗原共同孵育,使用ELISA的方法检测弥散至血浆中IFN-γ的水平来达到诊断的目的。由于采集的血浆可以保存,再加上操作简便、技术简单,在免疫功能正常的人群中有着和ELISPOT一样好的敏感度和特异度,这就使得全血γ干扰素释放试验更加适用于我国经济基础薄弱的国情和大规模流行病学调查的研究。全血γ干扰素释放试验作为体外细胞免疫的诊断试验,近年来用于临床活动性肺结核的辅助诊断,在复杂的临床工作中,结核病患者的不同状态、菌量负荷、淋巴细胞数量、疾病严重程度均有可能影响细胞免疫状态从而影响实验结果,本研究拟就3种抗原刺激下的全血干扰素释放试验在肺结核患者中的影响因素进行初步探讨。
资料和方法
一、一般资料
选取2010年6月至2012年6月期间首都医科大学附属北京胸科医院住院肺结核患者、新职工和健康体检的学生志愿者共计141例(名),男86例(名),女55例(名),所有受检者均为HIV阴性,无妊娠,无应用免疫抑制剂和免疫增强剂史,抗结核治疗<1周。
二、选例标准
菌阳肺结核组:痰集菌连续至少2次(+)或痰结核分枝杆菌培养阳性至少1次;共计44例,年龄(46.6±18.4)(17~90)岁。菌阴肺结核组:至少3次痰集菌及1次痰结核分枝杆菌培养阴性,具有典型活动性肺结核临床症状和影像学表现,排除其他非结核肺部疾病,经抗结核治疗病变吸收良好病情好转的患者;共计47例,年龄(38.3±16.8)(16~76)岁。陈旧性肺结核组:有或无明显的结核病史,无结核病的临床症状和体征,胸部X线或CT发现硬结、条索、钙化病灶;共计15例,年龄(57.4±12.6)(20~76)岁。健康对照组:为新职工和健康体检的学生,无明显的结核病接触史、无临床症状和体征、X线胸片检查无异常表现、无其他疾病的健康人群;共计35名,年龄(21.8±2.11)(18~27)岁。为探讨肺结核患者胸部CT病变广泛程度对实验结果的影响,根据结核病患者(包括菌阳及菌阴肺结核组和陈旧性肺结核组)影像学特点,将每一个肺段计为1分,病变累及超过1/2肺段的计为1分,不足1/2肺段的计为0.5分,累计得出每一位肺结核患者的CT评分,按是否≥4分将患者分为肺部病变累及少组(0~3.9分)和肺部病变累及多组(4~15分)。
该项研究经首都医科大学附属北京胸科医院伦理委员会审核并通过,征得受试对象同意并签署知情同意书。
三、试验方法
标本收集和检测:结核病组患者于入院次日清晨抽取空腹静脉血5 ml,置于真空肝素抗凝管中;健康对照组统一采血,清晨抽取空腹静脉血5 ml,置于真空肝素抗凝管中。采血后6 h内将静脉血1 ml加入24孔培养板内共5孔,每孔依次加入聚羟基脂肪酸酯(polyhydroxyalkanoates, PHA)(阳性对照)、PPD、ESAT-6、 ESAT-6/CFP-10和生理盐水(阴性对照)并于5%CO2、37 ℃细胞培养箱孵育过夜约16~22 h,次日收集血浆至少300 μl,于-20 ℃保存;收集的血浆采用美国BD公司生产的IFN-γ检测试剂盒,严格按照试剂盒要求进行操作。抗原的终浓度分别为PHA(20 μg/ml)、PPD(20 μg/ml)、ESAT-6(40 μg/ml)、 ESAT-6/CFP-10(20 μg/ml),最后1孔加入等体积生理盐水。
四、统计学方法
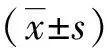
结 果
一、各抗原刺激后健康对照组和活动性结核病患者组血浆中IFN-γ的含量
分别以抗原ESAT-6、 ESAT-6/CFP-10融合抗原和抗原PPD刺激,检测刺激后血浆中IFN-γ含量,活动性肺结核患者组显著高于健康对照组,两者差异有统计学意义(P<0.01)(表1)。
二、不同影响因素下抗原刺激后IFN-γ含量
(一)菌阳和菌阴肺结核患者组的比较
比较3种抗原(ESAT-6、ESAT-6/CFP-10和PPD)刺激后菌阳肺结核组和菌阴肺结核组间血浆IFN-γ含量,结果显示,菌阳肺结核组与菌阴肺结核组之间IFN-γ含量差异无统计学意义(P>0.05)(表2)。
(二)陈旧性肺结核组、菌阳肺结核组和菌阴肺结核组的比较
在3种抗原刺激后,比较陈旧性肺结核组、菌阴肺结核组和菌阳肺结核组间血浆IFN-γ含量后发现,各抗原表现复杂,ESAT-6和ESAT-6/CFP-10抗原刺激后分泌IFN-γ的量在菌阴肺结核组和陈旧性肺结核组之间差异无统计学意义(P>0.05);ESAT-6抗原刺激后分泌IFN-γ的量在菌阳肺结核组和陈旧性肺结核组之间差异无统计学意义(P>0.05),但ESAT-6/CFP-10抗原刺激后分泌IFN-γ的量在菌阳肺结核组和陈旧性肺结核组之间差异有统计学意义(P<0.05),PPD在菌阴肺结核组和陈旧性肺结核组、菌阳肺结核组和陈旧性肺结核组之间差异均有统计学意义(P<0.05)(表3,4)。
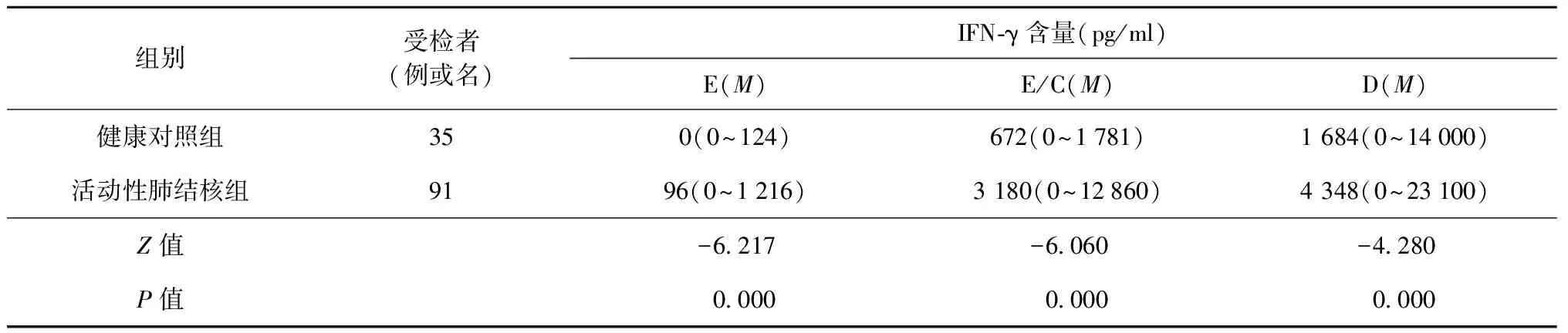
表1 各抗原刺激后健康对照组和活动性肺结核患者组血浆中IFN-γ的含量
注本试验中部分数据呈偏态分布,因此用中位数(M)表示,括号内为IFN-γ含量的最小值和最大值;E、E/C、D分别表示以ESAT-6、ESAT-6/CFP-10融合抗原和PPD为抗原刺激后血浆中IFN-γ的含量
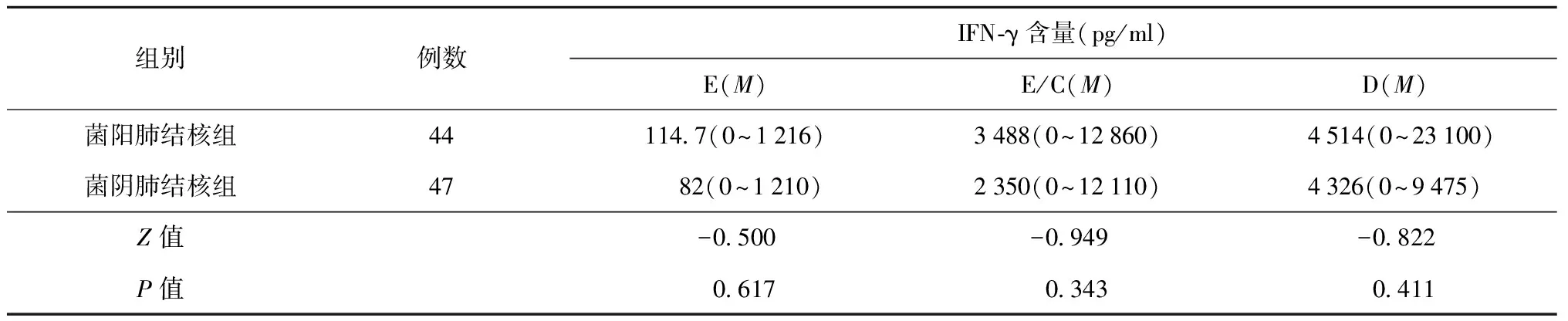
表2 各抗原刺激后菌阳和菌阴肺结核患者组血浆中IFN-γ的含量
注本试验中部分数据呈偏态分布,因此用中位数(M)表示,括号内为IFN-γ含量的最小值~最大值;E、E/C、D分别表示以ESAT-6、ESAT-6/CFP-10融合抗原、PPD为抗原刺激后血浆中IFN-γ的含量
(三)不同评分结果的肺结核患者IFN-γ含量
3种抗原刺激后发现,病变面积大(4~15分)的患者ESAT-6和ESAT-6/CFP-10刺激后血浆IFN-γ含量低于病变面积小的患者,差异有统计学意义(P<0.05);而PPD刺激后血浆IFN-γ含量在两组之间接近,差异无统计学意义(P>0.05)(表5)。
(四)不同的外周血淋巴细胞计数结果患者的IFN-γ含量
外周血淋巴细胞计数分为<1.0×109/L组和≥1.0×109/L组,3种抗原刺激后结果显示,血浆IFN-γ含量在<1.0×109/L组显著低于≥1.0×109/L组,差异有统计学意义(P<0.05)(表6)。
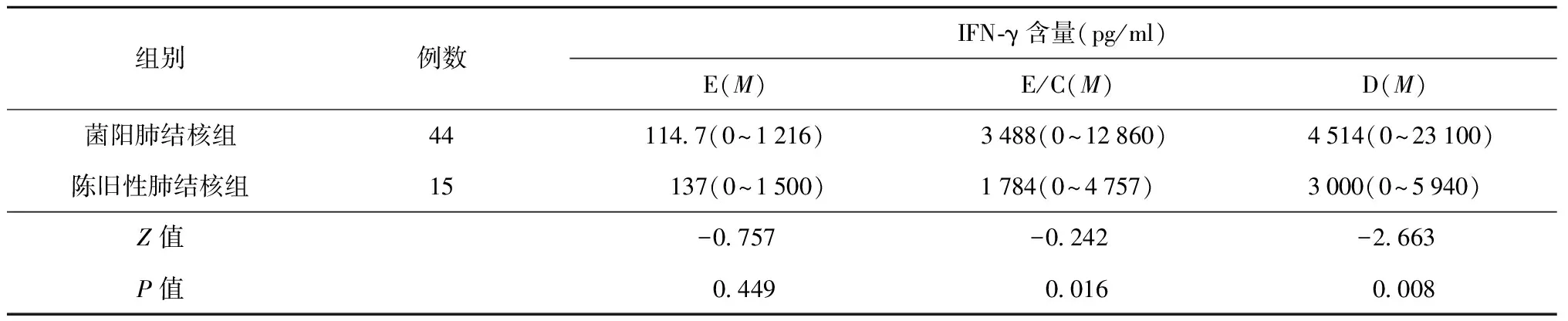
表3 各抗原刺激后菌阳肺结核组与陈旧性肺结核组患者血浆中IFN-γ的含量
注本试验中部分数据呈偏态分布,因此用中位数(M)表示,括号内为IFN-γ含量的最小值~最大值;E、E/C、D分别表示以ESAT-6、ESAT-6/CFP-10融合抗原、PPD为抗原刺激后血浆中IFN-γ的含量
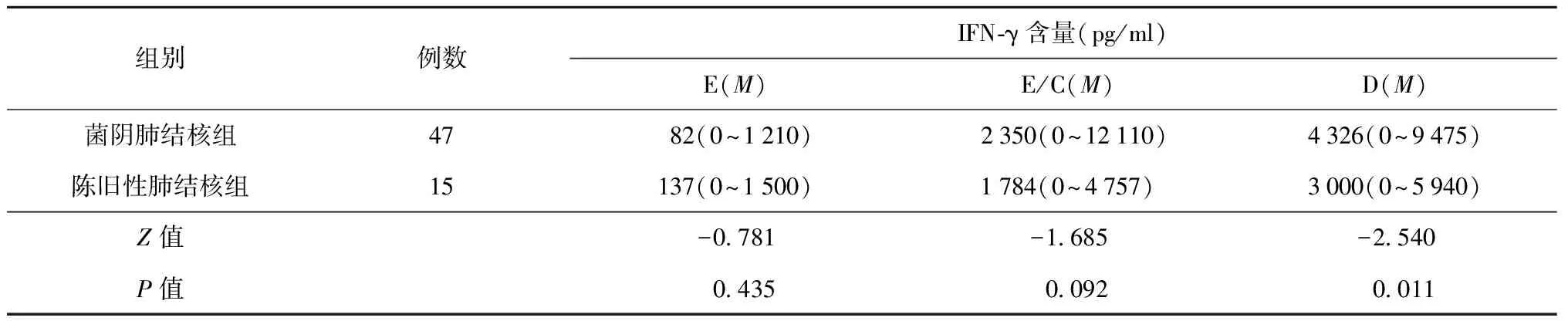
表4 各抗原刺激后菌阴肺结核组与陈旧性肺结核组患者血浆中IFN-γ的含量
注本试验中部分数据呈偏态分布,因此用中位数(M)表示,括号内为IFN-γ含量的最小值和最大值;E、E/C、D分别表示以ESAT-6、ESAT-6/CFP-10融合抗原、PPD为抗原刺激后血浆中IFN-γ的含量

表5 各抗原刺激后不同病变范围的肺结核患者血浆中IFN-γ的含量
注本试验中部分数据呈偏态分布,因此用中位数(M)表示,括号内为IFN-γ含量的最小值~最大值;E、E/C、D分别表示以ESAT-6、ESAT-6/CFP-10融合抗原、PPD为抗原刺激后血浆中IFN-γ的含量
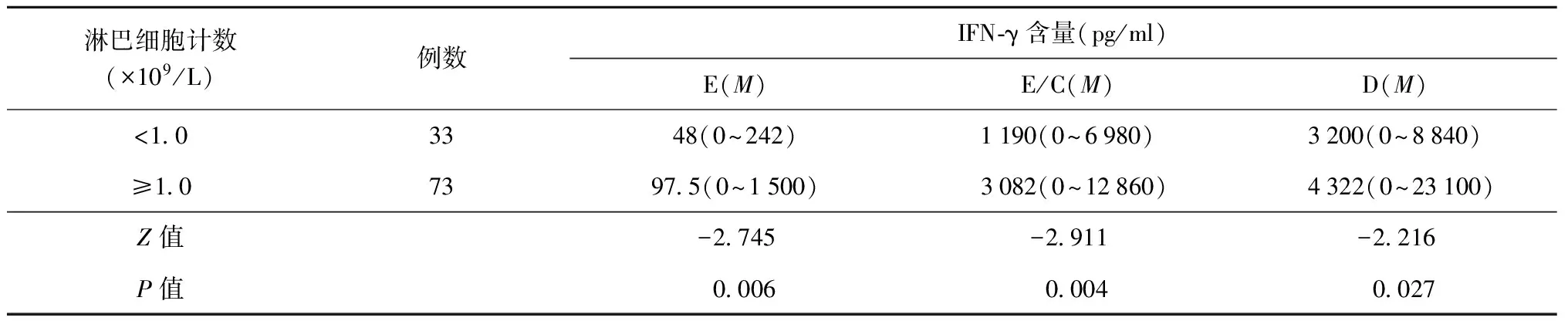
表6 各抗原刺激后不同的淋巴细胞计数的结核病患者血浆中IFN-γ的含量
注本试验中部分数据呈偏态分布,因此用中位数(M)表示,括号内为IFN-γ含量的最小值~最大值;E、E/C、D分别表示以ESAT-6、ESAT-6/CFP-10融合抗原、PPD为抗原刺激后血浆中IFN-γ的含量
讨 论
全血γ干扰素释放试验作为新的体外细胞免疫检测的手段,因其不受卡介苗接种后的交叉反应,以及不受绝大多数非结核分枝杆菌的影响,主要用于LTBI的诊断[3],其敏感度和特异度可以高达90%以上[4-6];尽管IGRAs目前尚不能很好地鉴别LTBI和ATB,但因其在ATB中很好的阳性检出率[7-8],近年来被广泛用于ATB的辅助诊断。在活动性肺结核中,ELISPOT的总敏感度波动于77%~79%之间[9],QFT-IT波动于55%~58%之间[10-11],在探讨其敏感度降低的原因上,多数学者推测可能为ATB患者临床复杂多样,菌量负荷、病变广泛程度、疾病严重程度、年龄、基础疾病、营养状态等均可导致其细胞免疫功能低下从而影响实验结果,本研究拟在结核分枝杆菌负荷、病变的活动性、影像学和外周血淋巴细胞计数4个方面来探讨这些因素对全血干扰素释放试验的影响。
痰菌阳性常提示体内结核分枝杆菌菌量负荷较重,机体结核分枝杆菌应该处于活跃复制的阶段,结核分枝杆菌分泌性蛋白如ESAT-6和CFP-10的分泌量就会较高;同样菌阳的患者往往病情较重,细胞免疫功能降低。在本研究中,两组之间IFN-γ的分泌量差异无统计学意义,提示本研究中的3种抗原刺激所引起的IFN-γ的分泌量不受是否排菌的影响,因此该试验对菌阴肺结核的诊断有着重要的意义。相似的结论可见于其他的研究报告[12]。
陈旧性肺结核是指无临床症状、影像学表现为硬结条索钙化且痰菌阴性的人群。我国属于结核病高流行地区,人群感染结核分枝杆菌比率普遍较高,部分人群自身免疫和营养功能良好而获得自愈。在笔者探讨该方法能否区别陈旧性肺结核和菌阳肺结核和菌阴肺结核中,3种抗原呈现不一致的表现,分析其主要原因可能与陈旧性肺结核组样本量过少有关。此外,结核分枝杆菌潜伏感染、活动性结核病、陈旧性肺结核只是机体感染结核分枝杆菌的不同阶段,反映了机体免疫系统在对抗结核分枝杆菌进入机体后的一系列过程,其三者之间的界限很难界定。无论哪个阶段,机体都曾经感染过结核分枝杆菌,体内均存在结核分枝杆菌特异的记忆T淋巴细胞,因此在体外再次受到结核分枝杆菌特异抗原的刺激时,均会释放分泌IFN-γ。同样复杂矛盾的结果在对ATB和LTBI的比较中也能看到,即基于ESAT-6和CFP-10抗原的干扰素释放试验并不能区分活动性结核病和结核分枝杆菌潜伏感染[13]。另一个主要原因可能是我国为结核病高感染率国家,部分人群高暴露于结核分枝杆菌环境中,在部分陈旧性肺结核患者中,尽管机体已经清除了结核分枝杆菌的感染,但是由于持续暴露于结核分枝杆菌的环境之中[14],从而机体长久保留了效应T淋巴细胞[15]。
肺部病变累及的面积常常反应结核病的严重程度。在本研究中,对24例病变累及4个肺段以上和82例不足4个肺段的肺结核患者抗原刺激的IFN-γ分泌量的比较上,其中ESAT-6和ESAT-6/CFP-10融合抗原无论在IFN-γ的分泌量和IFN-γ分泌的阳性率之间差异都有统计学意义;其可能的原因为在重症肺结核患者中,细胞免疫功能受到抑制,CD4+T淋巴细胞的功能受到抑制[16]。
参与抗原特异IFN-γ分泌的效应T淋巴细胞主要是CD4+T淋巴细胞,因此,外周血淋巴细胞的绝对值可能对结果产生影响[17]。结果显示,外周血淋巴细胞计数<1.0×109/L和外周血淋巴细胞计数≥1.0×109/L两组之间抗原刺激的IFN-γ分泌量差异有统计学意义,提示外周血淋巴细胞的数量对试验结果可能产生影响,相似的结论主要在HIV与Mtb双重感染的人群中得到证实。
本研究旨在初步探讨影响干扰素释放试验的因素,部分组别因选例困难导致入组人数偏少,需要进一步扩大样本量探讨陈旧性肺结核与活动性肺结核的干扰素释放试验的差异;此外,根据研究显示,淋巴细胞数量对实验结果有影响,下一步需要对淋巴细胞进行分组,进一步探讨CD4+T淋巴细胞的数量对实验结果的影响。
基于RD1区抗原刺激的全血γ干扰素释放试验在菌量负荷的影响因素下的IFN-γ分泌量差异无统计学意义,但是受到外周血淋巴细胞计数和病变累及程度的影响。各抗原对疾病的活动性表现不一,需要扩大样本量进一步证实。
[1] Elhay MJ, Oettinger T, Andersen P. Delayed-type hypersensitivity responses to ESAT-6 and MPT64 fromMycobacteriumtuberculosisin the guinea pig. Infect Immun,1998,66(7):3454-3456.
[2] Dillon DC, Alderson MR, Day CH,et al. Molecular and immunological characterization ofMycobacteriumtuberculosisCFP-10, an immunodiagnostic antigen missing inMycobacteriumbovisBCG. J Clin Microbiol,2000,38(9):3285-3290.
[3] 熊勇超, 侯月云, 赵建忠,等. γ干扰素释放试验在检测结核分枝杆菌潜伏感染中的应用.中国防痨杂志,2012,34(9):613-616.
[4] Brock I, Weldingh K, Lillebaek T, et al. Comparison of tuberculin skin test and new specific blood test in tuberculosis contacts. Am J Respir Crit Care Med,2004, 170(1):65-69.
[5] Ewer K, Deeks J, Alvarez L, et al. Comparison of T-cell-based assay with tuberculin skin test for diagnosis ofMycobacteriumtuberculosisinfection in a school tuberculosis outbreak. Lancet,2003, 361(9364):1168-1173.
[6] Lalvani A, Pathan AA, Durkan H, et al. Enhanced contact tracing and spatial tracking ofMycobacteriumtuberculosisinfection by enumeration of antigen-specific T cells. Lancet, 2001, 357(9273):2017-2021.
[7] 杨新婷,贾红彦,李琦,等. 全血γ干扰素释放试验在菌阴肺结核中诊断价值的临床观察. 中国临床医生,2013,41(3):42-45.
[8] 曾谊,冯枭,宋梅梅,等. 酶联免疫斑点试验在菌阴肺结核诊断中的价值. 中国防痨杂志,2012,34(2):100-102.
[9] Menzies D, Pai M, Comstock G. Meta-analysis: new tests for the diagnosis of latent tuberculosis infection: areas of uncertainty and recommendations for research. Ann Intern Med,2007, 146(5):340-354.
[10] Dewan PK, Grinsdale J, Kawamura LM. Low sensitivity of a whole blood interferon-gamma release assay for detection of active tuberculosis. Clin Infect Dis, 2007, 44(1):69-73.
[11] Dogra S,Narang P,Mendiratta DK,et al. Comparison of a whole blood interferon- gamma assay with tuberculin skin testing for the detection of tuberculosis infection in hospitalized children in rural India. J Infect, 2007, 54(3):267-276.
[12] Chen X, Yang Q, Zhang M, et al. Diagnosis of active tuberculosis in China using an in-house gamma interferon enzyme-linked immunospot assay. Clin Vaccine Immunol, 2009,16(6):879-884.
[13] Ravn P, Munk ME, Andersen AB, et al. Prospective evaluation of a whole-blood test usingMycobacteriumtuberculosis-specific antigens ESAT-6 and CFP-10 for diagnosis of active tuberculosis. Clin Diagn Lab Immunol,2005,12(4): 491-496.
[14] 刘旭辉,乐军,张忠顺,等. γ-干扰素释放试验(IGRA)的诊断价值探讨(高感染率背景下的研究结果).中国防痨杂志,2010,32(12):801-805.
[15] Dheda K, Pooran A, Pai M, et al. Interpretation ofMycobacteriumtuberculosisantigen-specific IFN-gamma release assays (T-SPOT.TB) and factors that may modulate test results. J Infect, 2007,55(2):169-173.
[16] 于春宝,左云,王俊玲,等.肺结核病人细胞免疫功能的研究. 临床肺科杂志,2008,13(2): 138-139,141.
[17] 杨新婷,贾红彦,李琦,等. 全血γ干扰素释放试验在菌阴肺结核中诊断价值的临床观察. 中国临床医生,2013,41(3):42-45.

