肺恶性肿瘤消融治疗的现状与展望
王英 李文涛
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
肺恶性肿瘤导致的死亡约占癌症总死亡率的1/3。肺叶切除加纵隔淋巴结清扫仍是早期非小细胞肺癌(non-small cell lung cancer,NSCLC)的首选治疗方案[1-3]。对于选择性的肺转移瘤患者,手术切除同样显示了生存获益。有研究报道,选择性结直肠癌肺转移患者的5年总生存率超过50%[4]。但由于高龄、疾病晚期或严重并发症等原因,只有15%~30%的原发性肺癌具有手术机会[5-6],且反复切除造成功能性肺实质不断减少。因此,对于不能耐受手术或拒绝手术、术后复发、放化疗失败及肺内多发病灶的肺恶性肿瘤患者,消融治疗因其肿瘤局部控制率高、微创、可反复多次治疗病灶等优势越来越受到关注[7]。肿瘤的消融治疗包括射频、冷冻、微波、激光、化学消融等,其中以前3种应用较为广泛。
1 射频消融
射频是一种高频交流变化电磁波的简称。射频消融(radiofrequency ablation,RFA)的频率范围<30 MHz,临床应用一般为375~500 kHz。电极针提供交替电流,产生高频电磁场,肿瘤组织内的分子试图追随交替电流的轨迹而相互撞击摩擦,产生的热量造成肿瘤区域凝固性坏死。
1995年,Goldberg等[8]首先将RFA应用于动物肺肿瘤治疗,2000年RFA应用于人类肺肿瘤治疗[9]。目前应用广泛的3种RFA系统分别为Boston Scientific、RITA和Cool-tip。前两种射频电极与射频发生器、电极板偶联,14~17 G的射频电极可伸展出4~16个探针,电极板置于患者对侧胸壁或大腿外侧;第3种由射频电极、射频发生器和冷循环泵组成,射频电极为单针或带有一组3个的簇状探针,通过冷循环系统及时带走针尖的热量,防止针尖炭化。射频治疗时间取决于电极周围组织阻抗的加和(或)温度升高,即温控和(或)阻控。
在影像学设备的导引下,将射频电极置于肿瘤内部,开启发生器,产生高频电磁场,使周围组织内的分子相互撞击摩擦产热,当温度加热至60 ℃以上时可导致细胞死亡。因此,RFA目的为最大限度地产生一个组织坏死区域,该区域包括肿瘤组织、可能有肿瘤细胞浸润的瘤周组织及部分正常的肺实质。
肺恶性肿瘤RFA治疗的技术成功率超过95%[10-11],围手术期死亡率极低(0.4%),主要并发症包括气胸(8%~35%)、胸腔积液(4%~30%)、肺出血(8%~10%)、肺脓肿(1%~6%)、肺炎、支气管胸膜瘘、皮下气肿、皮肤灼伤、种植转移。其中,气胸的胸管引流率<10%,肺出血多为自限性,约3%出现中度咯血[10-11]。据报道,靶病灶的持续完全缓解率为85%~90%。肺恶性肿瘤患者RFA的长期生存数据相对较少。在RAPTURE研究中,不适合外科手术、放疗及化疗的106例患者共183个肺内病灶行CT引导下RFA治疗,术后随访2年。其中,NSCLC、结直肠癌肺转移及其他肺转移瘤患者的1年、2年生存率分别为70%、48%,89%、66%,92%、64%[10]。Simon等[12]报道,Ⅰ期NSCLC、结直肠癌肺转移患者的5年生存率分别为27%、57%。Zemlyak等[13]对不适合标准切除的Ⅰ期NSCLC患者行亚肺叶切除(sublobar resection,SLR)、RFA、冷冻消融(cryoablation)治疗的生存分析显示,3组的3年总生存率和3年无癌生存率分别为87.1%、87.5%、77%,60.8%、50%、45.6%。其中,SLR组与RFA组的3年总生存率无显著差异,但优于冷冻消融组;SLR组的3年无癌生存率优于后两组,而后两组间无显著差异。
研究报道,病灶大小是术后肿瘤局部复发的最重要危险因素,而术后即刻病灶周围磨玻璃密度影(ground-glass opacity,GGO)与肿瘤能否完全消融有关。多数研究者认为,>5 cm的肺内病灶不适宜行RFA,3~5 cm者因高复发率应予谨慎考虑,<3 cm的病灶术后复发率明显降低。术后组织病理显示中心高密度为凝固性坏死,周围GGO与一定程度的组织损伤有关。早在术后2~3周,GGO开始回缩,为组织修复过程。此过程中中央凝固性坏死有所吸收,周围肉芽组织逐渐被纤维组织取代[14]。动物实验的组织标本苏木精-伊红(hematoxylin-eosin,HE) 染色切片显示,术后4~6周凝固性坏死周围为大量纤维组织[15]。为达到肿瘤治疗的安全范围,对GGO的大小尚有争议。一般认为,RFA后病灶周围GGO大小在5~10 mm是必要的。Baere等[16]研究认为,肿瘤消融直径达到原病灶直径的2倍可提高RFA技术成功率。
2 冷冻消融
冷冻消融的原理为探针穿刺肿瘤后首先迅速降温(可达-140 ℃)形成冰球,维持一段时间后再快速升温。此一降一升为1个循环,如此几个循环,反复冻融使肿瘤区域坏死。降温后细胞内和细胞外迅速形成冰晶,导致肿瘤细胞脱水、破裂;同时,冷冻使微血管收缩,血流减慢,微血栓形成,阻断血流,导致肿瘤细胞缺血坏死。
目前,应用较为广泛的冷冻系统(图1A)多基于氩气制冷,主要有Cryohit及Cryocare两种系统,可允许放置1~15个直径1.5~2.4 mm的冷冻探针。每个探针通过冷冻-融化-冷冻模式达到所在区域的肿瘤坏死。治疗过程中通过CT或MRI的介导,肿瘤组织内形成的冰球清晰可见,使消融区域与周围组织之间形成鲜明的边界(图1B)。当肿瘤靠近重要组织脏器,由于冰球对周围组织结构的损伤可限制在其最外侧边界的3~7 mm内,操作者可据此最大限度地灭活肿瘤病灶,同时不损及周围重要组织脏器。冷冻治疗中冰球明确的可见性大大增加了操作的安全性及术者信心,使其应用日益广泛。而且,对于较大肿瘤,同样可通过多针多位点消融达到肿瘤坏死。

图1 CT引导下冷冻消融治疗A:冷冻消融系统;B:巨大肺转移瘤的多针分次冷冻治疗,术中可见冰球与周围组织的明确分界(箭头所示)
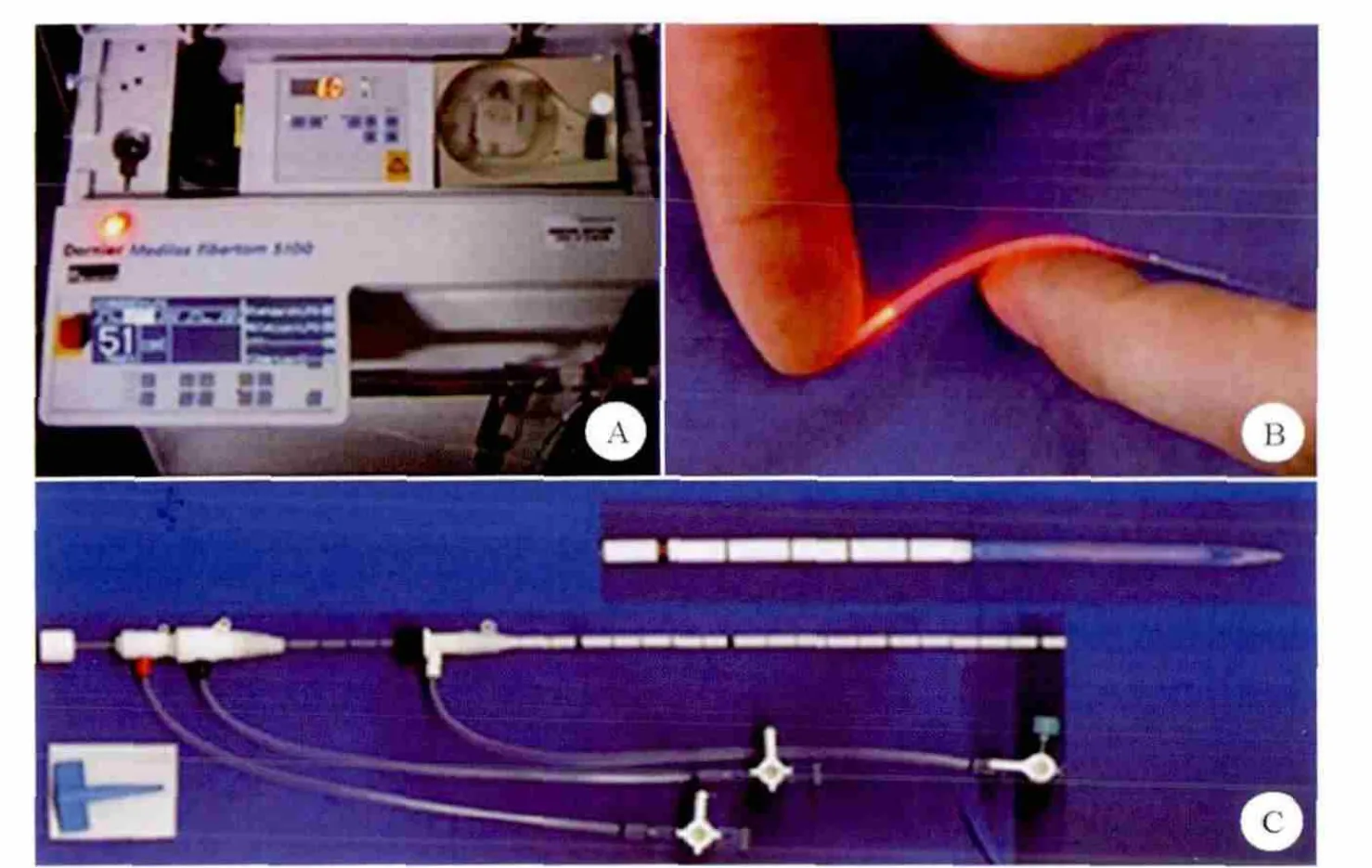
图2 激光消融系统A:Nd:YAG激光器;B:可弯曲激光棒;C:内在冷却系统
关于肺肿瘤冷冻消融的文献报道较少。Wang等[17]对187例胸部恶性肿瘤患者冷冻消融的技术成功率、可行性与安全性进行了报道。其中肺原发恶性肿瘤165例,转移22例;原发肺肿瘤中Ⅲ~Ⅳ期143例,其中89%为传统治疗失败者。术后即刻冰球清晰可见,CT值显著下降。由于肿瘤周边肺组织密度极低,冰冻范围很难界定,因此作者仅记录了软组织肿块的冰球覆盖范围。肿瘤大小及位置与能否被冰球完全覆盖显著相关(P<0.001),肿块>4 cm及中央型肿块为难以被冰球完全覆盖的危险因素。随访至6个月,肿瘤局部控制率为86%。此外,Kawamura等[18]对35个肺转移灶的1年肿瘤局部控制率为80%,主要并发症有气胸(12%~50%)、胸腔积液(14%)、咯血(36%~62%),次要并发症有咳嗽、发热、皮下气肿、皮肤灼伤。
3 微波消融
微波消融(microwave ablation,MVA)利用电磁波产生组织热效应,此点与RFA类似。两者不同之处在于微波消融的频谱范围要高得多,为300 MHz~300 GHz,临床应用一般为900~2450 MHz。与RFA相比,由于广泛得多的微波能量沉积(可达到探针周围2 cm),微波消融可产生一个大得多的热效应区。
目前,微波消融系统种类较多,美国报道有6种。使用915 MHz或2450 MHz的发生器,电极为单针并带有数目不等的长度为0.6~4.0 cm的活性探针。绝大部分的微波消融系统获得了美国食品药品管理局(Food and Drug Administration,FDA)的批准。Dupuy等[19]认为,微波消融较RFA具有更好的热量传导性能和较弱的热沉效应,从而减少肿瘤的局部复发,且多探针同时使用能增大肿瘤的消融范围、缩短治疗时间。
Wolf等[20]报道原发及转移性肺恶性肿瘤的66次微波消融治疗,病灶>3 cm者复发率明显提高,1年、2年、3年的精算存活率分别为65%、55%、45%。Little等[21]报道23例患者29个肺病灶的微波消融,技术成功率为93%,随访至6个月靶病灶局部控制率为88%。气胸为主要并发症,发生率为43%,胸管引流率3%。
4 激光消融
激光消融(laser ablation)是一种热损毁技术,借助掺铊钇铝石榴石晶体(Nd:YAG,波长1064 nm)或连续红外线(820 nm)二极管激光器,通过可弯曲的、包有外鞘的光纤传输能量,使光能转换成热能,导致组织内蛋白质变性、细胞死亡。光纤的冷却在一个同轴系统中,从而允许了更高的能量沉积。此外,多根光纤的插入可产生更大的消融范围。
MRI温度测定法已应用于肝脏肿瘤,以精确估计激光消融区域。由于充气肺组织信号不足,尚无肺肿瘤MRI温度测定法应用的相关报道,目前仅限于CT引导。激光消融系统(图2)种类较少,主要有Biotex,且目前在肺肿瘤中的应用也较少。Rosenberg等[22]报道肺转移瘤患者激光消融的长期安全性与疗效,64例患者108个病灶的技术成功率为79%(85/108),1年、2年、3年、4年、5年总生存率分别为81%、59%、44%、44%、27%。气胸发生率38%,胸管引流率5%,肺出血率13%,均为自限性。
5 问题与展望
绝大多数肺恶性肿瘤患者因高龄、疾病晚期或严重并发症等原因,治疗手段有限,消融治疗能使其获益已取得共识。但对肺恶性肿瘤消融治疗的明确适应证和禁忌证,何种患者选择何种消融治疗方式能取得最大的获益仍未知。目前,肺恶性肿瘤消融治疗的前瞻性研究仍较少,消融治疗后患者超过3年的长期随访数据更匮乏。
消融治疗作为肿瘤多学科综合治疗的方式之一,并非孤立存在。RFA结合肝动脉化疗栓塞(transarterial chemoembolization,TACE)、微波消融结合TACE在肝癌治疗中已有较多报道。对于肺恶性肿瘤,Dupuy等[23]报道放疗联合RFA的局部控制与生存率优于单纯放疗。肺恶性肿瘤消融治疗与其他治疗方式结合的令人鼓舞的前景仍有待多中心、大样本临床研究证实。
[1]YAN TD,BLACKD,BANNONPG,etal.Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of videoassisted thoracic surgery lobectomy for early-stage nonsmall-cell lung cancer [J].J Clin Oncol,2009,27(15):2553-2562.
[2]SAKURABA M,MIYAMOTO H,OH S,et al.Videoassisted thoracoscopiclobectomy vs.conventional lobectomy via open thoracotomy in patients with clinical stage IA non-small-cell lung carcinoma [J].Interact Cardiovasc Thorac Surg,2007,6(5):614-617.
[3]SAWADA S,KOMORIE,YAMASHITAM,et al.Comparison in prognosis after VATS lobectomy and open lobectomy for stage Ⅰ lung cancer:retrospective analysis focused on a histological subgroup [J].Surg Endosc,2007,21(9):1607-1611.
[4]ROY-CHOUDHURY S.Thoracic ablation:primary lung cancer,metastases,chest wall disease [M].Techniques in Interventional Radiol,2013:97-113.
[5]KELEKIS AD,THANOSL,MYLONAS,et al.Percutaneous radiofrequency ablation of lung tumors with expandable needle electrodes:current status [J].Eur Radiol,2006,16(11):2471-2482.
[6]SIMON T G,DUPUY D E.Radiofrequency ablation,microwave ablation,and cryoablation for lung tumors [M].Interventional Oncol,2012:149-159.
[7]SHAHDR,GREEN S,ELLIOT A,et al.Current oncologic applications of radiofrequency ablation therapies[J].World J Gastrointest Oncol,2013,5(4):71-80.
[8]GOLDBERG S N,GAZELLE G S,COMPTON C C,et al.Radiofrequency tissue ablation in the rabbit lung:efficacy and complications [J].Acad Radiol,1995,2(9):776-784.
[9]DUPUY D E,ZAGORIA R J,AKERLEY W,et al.Percutaneous radiofrequency ablation of malignancies in the lung [J].AJR Am J Roentgend,2000,174(1):57-59.
[10]LENCIONIR,CROCETTIL,CIONIR,etal.Response toradiofrequency ablation of pulmonary tumors:a prospective,intention-to-treat,multicentre clinical trial (the RAPTURE study) [J].Lancet Oncol,2008,9(7):621-628.
[11]BARGELLINII,BOZZIE,CIONIR,etal.Radiofrequency ablation of lung tumors [J].Insights Imaging,2011,2(5):567-576.
[12]SIMON C J,DUPUYDE,DIPETRILLO T A,et al.Pulmonary radiofrequency ablation:long term safety and efficacy in 153 patients [J].Radiology,2007,243(1):268-275.
[13]ZEMLYAK A,MOORE WH,BILFINGER T V.Comparison of survival after sublobar resections and ablative therapies for stage I non-small cell lung cancer [J].J Am Coll Surg,2010,211(1):68-72.
[14]TOMINAGA J,MIYACHI H,TAKASE K,et al.Timerelated changes in computed tomographic appearance and pathologic findings after radiofrequency ablation of the rabbit lung:preliminary experimental study [J].J Vasc Interv Radiol,2005,16(12):1719-1726.
[15]王英,李文涛,许立超,等.CT引导下兔肺内VX2肿瘤的射频消融治疗 [J].中国癌症杂志,2013,23(5):347-352.
[16]DEBAÈRE T,PALUSSIÈRE J,AUPÉRIN A,et al.Midterm local efficacy and survival after radiofrequency ablation of lung tumors with minimum follow-up of 1 year:prospective evaluation [J].Radiology,2006,240(2):587-596.
[17]WANGH,LITTRUPP J,DUAN Y,et al.Thoracic masses treated with percutaneous cryotherapy:initial experience with more than 200 procedures [J].Radiology,2005,235(1):289-298.
[18]KAWAMURAM,IZUMI Y,TSUKADAN,et al.Percutaneous cryoablation of small pulmonary malignant tumors under computed tomographic guidance with local anesthesia for nonsurgical candidates [J].J Thorac Cardiovasc Surg,2006,131(5):1007-1013.
[19]DUPUY D E.Image-guided thermal ablation of lung malignancies [J].Radiology,2011,260(3):633-655.
[20]WOLFF J,GRANDD J,MACHAN J T,et al.Microwave ablation of lung malignancies:effectiveness,CT findings,and safety in 50 patients [J].Radiology,2008,247(3):871-879.
[21]LITTLE M W,CHUNG D,BOARDMANP,et al.Microwave ablation of pulmonary malignancies using a novel high-energy antenna system [J].Cardiovasc Intervent Radiol,2013,36(2):460-465.
[22]ROSENBERG C,PULS R,HEGENSCHEID K,et al.Laser ablation of metastatic lesions of the lung:long term outcome [J].AJR Am J Roentgenol,2009,192(3):785-792.
[23]DUPUYDE,DIPETRILLO T,GANDHI S,et al.Radiofrequency ablation followedby conventional radiotherapy for medically inoperable stage Ⅰ non-small cell lung cancer [J].Chest,2006,129(3):738-745.
