前瞻性单臂单中心临床研究:肺恶性肿瘤的射频消融治疗
王英 李文涛 何新红 李国栋 许立超
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
肺恶性肿瘤导致的死亡约占癌症总死亡量的1/3。肺叶切除加纵隔淋巴结清扫仍是早期非小细胞肺癌(non-small cell lung cancer,NSCLC)的首选治疗方案[1-3],但只有30%左右的原发性肺癌具有手术机会[4]。同时,肺是恶性肿瘤的第二大转移器官[5]。对于不能耐受手术、拒绝手术、术后复发、放化疗失败及肺内多发病灶的肺恶性肿瘤患者,射频消融因其微创、可反复多次治疗病灶等优势越来越受到关注[6]。本文研究肺恶性肿瘤射频消融治疗的安全性、可行性与治疗效果,探讨术后的疗效评估标准。
1 资料和方法
1.1 临床资料
2012年1月—2013年9月,共27例患者入组。主要选择标准为:经病理组织学或细胞学确诊的肺恶性肿瘤患者;单侧肺病灶数≤4个且任一病灶最大径≤5 cm;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分≤2分,预计生存期≥3个月。主要排除标准为:①相对禁忌证:病灶与气管、主支气管、食管、大血管的距离<1 cm;②绝对禁忌证:凝血功能障碍;严重不可控制的感染;主要器官功能衰竭,失代偿的心、肺功能衰竭(如充血性心力衰竭、有临床症状的冠心病和药物不能控制的心律失常)。
1.2 治疗方法
射频发生器CelonLab POWER,冷循环泵CelonLab AquaFlow Ⅲ,射频针型号T20、T30、T40,相应的射频电极长度分别为2、3和4 cm,最大输出功率分别为20、30和40 W。若同一病灶采用双针或多针,其功率为各个射频针功率的总和。
患者术前30 min予以地西泮(安定)10 mg肌内注射。移送至CT室后连接心电监护装置,根据CT扫描(120 kV,100 mA,层厚3 mm)及三维重建结果,确定穿刺点、进针方向和深度,根据病灶最大径及CT扫描层数确定射频针型号及数量。2%利多卡因局部麻醉后将射频针按预定方向和角度穿刺病灶。CT扫描明确射频电极位于病灶内合适位置后开始消融治疗,消融终点定为周围磨玻璃密度影(ground-glass opacity,GGO)超出肿瘤边缘0.5~1 cm(图1)。对于较大及不规则的肿瘤病灶,采取多针多位点消融(图2)。患者术中疼痛予以吗啡10 mg皮下注射。最后针道消融、拔针,包扎穿刺点。再次CT扫描,观察病灶变化和有无气胸、出血等并发症发生。明确患者无异常后送返病房,心电监护4~8 h。高风险患者(有放疗病史、肺功能差等)预防性使用抗生素。术后12 h行胸部正侧位X线检查,再次明确并发症发生情况。
1.3 随访与评估
影像学随访采用CT、MRI或正电子发射计算机断层扫描(positron emission computed tomography,PET)/CT,收集术后即刻及术后1、3、6、9、12、18个月的影像学资料。统计技术成功率,气胸、胸腔积液、肺出血等并发症的发生率。
图1 病灶周围磨玻璃密度影
局部疗效的评估以射频术后1个月病灶大小为新的基线,术后6个月评价疗效,评价标准采用修订的实体肿瘤疗效评价标准(Response Evaluation Criteria In Solid Tumors,RECIST)。至少满足以下2条者定义为完全缓解(complete response,CR):①病灶最大径较术后1个月缩小>30%;②病灶呈CT完全低密度或T2低信号(内部可有囊腔或空洞形成),不伴有肿瘤周边结节性生长及不规则强化;③PET检查标准摄取值(standardized uptake value,SUV)<2.5。至少满足以下2条者定义为部分缓解(partial response,PR):①病灶最大径较术后1个月缩小≥30%;②病灶中央坏死或空洞形成,但伴有肿瘤周边结节性生长及不规则强化;③PET检查SUV或2-氟-2-脱氧-D-葡萄糖(fluorodeoxyglucose,FDG)摄取较前降低。满足以下任意2条者为疾病稳定(stable disease,SD):①病灶最大径较术后1个月缩小<30%;②病灶出现实性肿块,但不伴有周围组织器官侵犯;③PET检查SUV或FDG摄取较前无改变。满足以下任意1条者为疾病进展(progression disease,PD):①病灶最大径较术后1个月增大≥30%;②病灶出现实性肿块,伴有周围组织器官侵犯;③PET检查SUV较前增高。
局部病灶无进展期(time to local progression,TTLP):从术后第1 天至靶病灶进展;无进展生存期(progression-free survival,PFS):从术后第1天至靶病灶进展或肺内出现新发病灶,或出现区域淋巴结或远处转移;总生存期(overall survival,OS):从术后第1天至死亡或最后一次随访。TTLP以每个病灶为单位进行分析,PFS、OS以每例患者为单位进行分析。
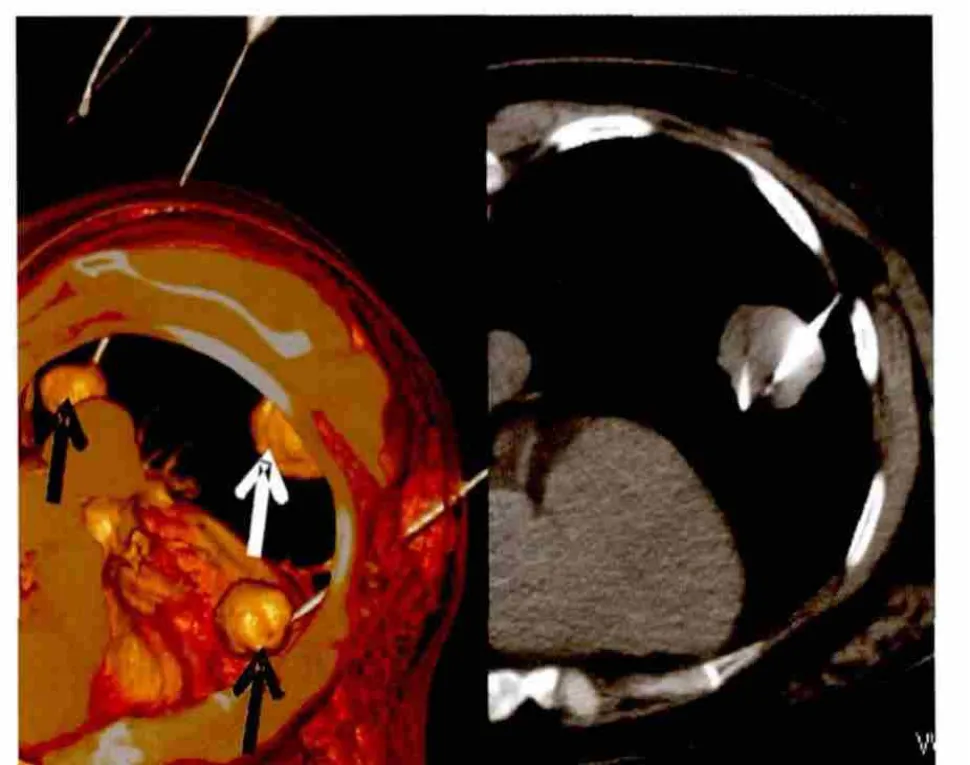
图2 HCC肺转移影像学表现左肺3个转移灶,2个较小病灶(黑箭头所示)单针同时消融,1个较大病灶(白箭头所示)双针消融
1.4 统计学处理
采用SPSS13.0统计分析软件,计量资料采用mean±SD表示,病灶大小的分析采用配对t检验,生存分析采用Kaplan-Meier法,P<0.05为差异有统计学意义。
2 结果
2.1 患者资料
2012年1月—2013年9月,27例患者51个病灶共行35次射频术,治疗肺内病灶数目1~5个,平均(1.9±1.2)个。男性17例、女性10例;年龄24~81岁,平均(52±14.1)岁。51个病灶术前病灶大小(6.3~41.3)mm,平均为(18.8±9.2)mm。27例患者均通过穿刺活检获得明确的病理诊断。若为两肺多发病灶,每侧至少1个病灶获得病理诊断。27例患者中,鳞癌2例、腺癌13例、神经内分泌癌2例、间叶源性恶性肿瘤4例、低分化癌2例、肝细胞癌2例、透明细胞癌1例、腺样囊性癌1例。肺原发恶性肿瘤6例、肺转移瘤21例。27例患者中,肿瘤分期为Ⅳ期占85.2%(23/27)。21例为其他治疗后疾病进展的,其中将射频消融作为首选治疗方式的有6例(28.6%)。
2.2 安全性与可行性
51个病灶技术成功率为98.0%(50/51),1个小结节未能治疗为多次穿刺导致气胸引起。35次射频消融术无围手术期死亡发生,主要并发症为气胸11.4%(4/35),胸管引流率2.9%(1/35);肺出血8.6%(3/35),1例咯血(2.9%);胸腔积液8.6%(3/35),胸管引流率5.7%。次要并发症包括发热>38.5 ℃、胸痛、皮下气肿、呕吐,予以对症处理。并发症发生与处理情况见表1。

表1 并发症与处理情况
2.3 疗效评价
根据修订的RECIST(表2),随访至少6个月后,51个靶病灶完全缓解45个、部分缓解1个、稳定2个、进展3个,完全缓解率为88.2%(45/51)。45个完全缓解的病灶,术前病灶大小为(14.6±7.2)mm,术后1个月、术后6个月病灶大小分别为(25.4±11.0)mm、(16.4±8.2)mm。就病灶大小分析,完全缓解病灶术后1个月较术前增大,术后6个月较术后1个月缩小,差异均有显著统计学意义(P=0.000,P=0.002)。
截至最后一次随访,本组研究随访时间6~18个月,平均(10.7±3.5)个月;23例患者存活、4例患者死亡。患者死亡直接原因分别为脑转移2例、呼吸衰竭1例、肠梗阻1例,均为肿瘤相关性死亡。本研究TTLP为(10.0±2.8)个月,PFS为(8.0±3.0)个月,OS为(10.0±3.5)个月。其中,肺原发恶性肿瘤与肺转移瘤的PFS差异无统计学意义(P=0.177)(图3A)。本研究将肺转移瘤分为间叶源性恶性肿瘤肺转移、结直肠癌肺转移及其他类型肺转移瘤3类,发现间叶源性恶性肿瘤肺转移的PFS显著低于后两者(P=0.001),而后两者之间PFS差异无统计学意义(P=0.467)(图3B)。
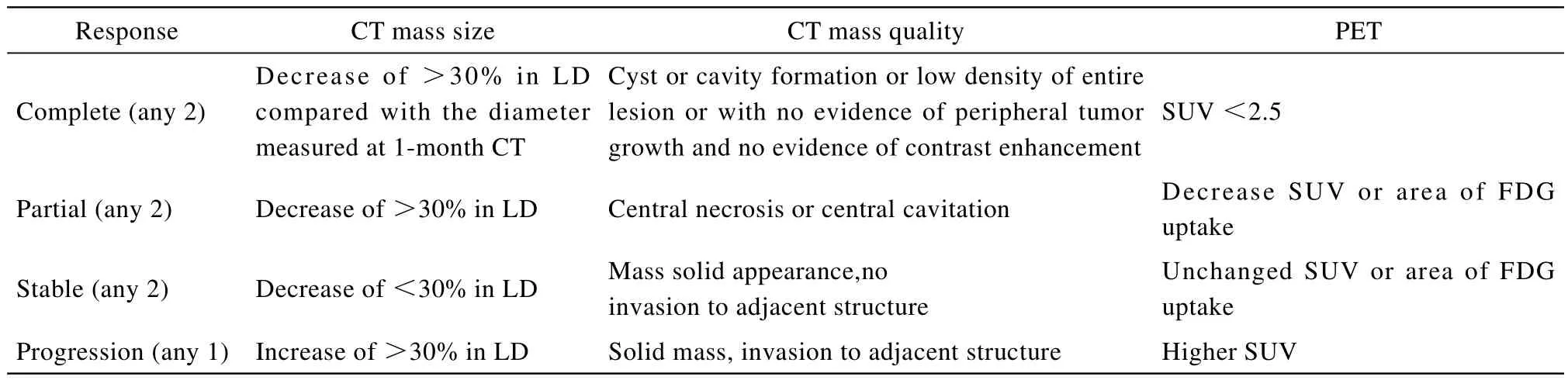
表2 修订后的实体肿瘤反应评估标准

图3 肺恶性肿瘤患者PFS A:肺原发恶性肿瘤与肺转移瘤患者的PFS;B:不同类型肺转移瘤患者的PFS
3 讨论
本组无围手术期死亡发生,主要并发症包括气胸、肺出血及胸腔积液。气胸的发生率及引流率分别为11.4%、2.9%。胸腔积液的发生率及引流率分别为8.6%、5.7%。本组胸腔积液需引流者均合并感染,患者伴有发热、白细胞及中性粒细胞比值升高。肺出血发生率8.6%,2例表现为CT图像的片状高密度影,1例表现为咯血(咯血量<5 mL)。次要并发症包括发热、胸痛、皮下气肿、呕吐,为自限性或仅需对症处理。本组主要并发症发生率为28.6%,与文献报道[7-9]相符。
51个病灶技术成功率为98.0%(50/51),1个右下肺小结节未能治疗为多次穿刺导致气胸引起。下肺病灶由于呼吸运动移动度较大,对较小病灶有时需反复调针才能命中,而多次调针可能导致气胸。一旦发生气胸,病灶即发生移位;加之穿刺造成的肺出血使CT图像模糊,病灶难以辨识,很可能导致手术无法进行。研究认为,对于小结节性病灶,达到射频针命中病灶的要求难度系数高。若术中重建明确病灶位于射频针消融范围内,则可进行消融。本研究中有1个6.3 mm的病灶,三维重建显示病灶紧贴射频针边缘,由于术中使用的T20射频针(消融最大径为2 cm)消融范围完全涵盖该病灶,遂予以消融治疗,随访至术后6个月发现病灶完全消失。
根据修订的RECIST(表2),本组病例随访至少6个月后,51个靶病灶完全缓解45个、部分缓解1个、稳定2个、进展3个,完全缓解率为88.2%(45/51)。De Baere等[10]报道,射频消融后靶病灶的长期完全缓解率在85%~90%;Lencioni等[8]RAPTURE研究中,术后1年靶病灶完全缓解率为88%,且NSCLC与肺转移瘤的完全缓解率无显著差异。
目前局部疗效的评价尚无公认标准,但越来越多的研究者不主张采用RECIST。尽管普遍认为肿瘤完全消融后在影像学随访中不应显示出病灶增大,但将病灶大小作为评价肿瘤反应的特定指标并不可靠,因为肿瘤延迟性的局部残留或复发已被证实[7,11]。早在2005年,Fernando等[12]提出“Modified RECIST criteria”,肿瘤射频术后的CT疗效评价包括病灶大小和密度。2008年,Lencioni等[8]又在RAPTURE研究中提出肿瘤射频消融的“完全消融”和“不完全消融”标准,包括病灶大小、形态和增强扫描3个方面的指标,并将病灶术后1个月的大小作为疗效评估的新基线,Bargellini等[13]称为“Amended RECIST criteria”。此外,Abbas等[14]认为囊腔和空洞形成提示肿瘤的完全缓解。研究报道,增强扫描时,任何>15 HU的中心强化均提示残留或复发[15],消融灶周围>9 mm的不均匀结节性强化提示残留[16]。由于病灶周围炎性反应存在,射频术后1~3周表现FDG摄取明显增高,因此为区别术后炎性反应与残留、复发,至少4周的间期是必要的[17-18]。PET/CT随访发现,射频术后1个月炎性反应相关FDG摄取值最大,术后3个月是排除炎性相关FDG摄取的良好时间界点[19]。而Alafate等[20]最新研究认为,射频术后前6个月,靶病灶SUV值呈下降趋势,术后6个月FDG摄取较术后3个月更少受炎性改变的影响。由于肿瘤消融安全范围的存在及术后病灶周围炎性反应的发生,本研究发现完全缓解病灶术后1个月较术前增大,术后6个月较术后1个月减小,差异均具有统计学意义(P<0.05),且与上述修订的RECIST相符合。基于以上阐述,本研究认为射频术后局部疗效的评价以术后1个月为新基线,术后6个月评估疗效更为适宜,具体评价标准可参照修订的RECIST。
本研究主要存在以下不足:首先,入组患者较少,样本量较小;其次,随访时间短,肿瘤局部残留或复发可能尚未表现,某些指标如OS仍不足以展开生存分析;再次,随访方案有待进一步优化。针对前两点,本研究将继续进行,增大样本量、延长随访时间。此外,将持续关注肺恶性肿瘤治疗的研究,做到横向分析与纵向分析结合。
[1]YAN TD,BLACKD,BANNONPG,etal.Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of videoassisted thoracic surgery lobectomy for early-stage nonsmall-cell lung cancer [J].J Clin Oncol,2009,27(15):2553-2562.
[2]SAKURABA M,MIYAMOTO H,OH S,et al.Videoassisted thoracoscopic lobectomy vs conventional lobectomy via open thoracotomy in patients with clinical stageⅠA non-small-cell lung carcinoma [J].Interact Cardiovasc Thorac Surg,2007,6(5):614-617.
[3]SAWADA S,KOMORIE,YAMASHITA M,et al.Comparison in prognosis after VATS lobectomy and open lobectomy for stage Ⅰ lung cancer:retrospective analysis focused on a histological subgroup [J].Surg Endosc,2007,21(9):1607-1611.
[4]KELEKIS A D,THANOS L,MYLONA S,et al.Percutaneous radiofrequency ablation of lung tumors with expandable needle electrodes:current status [J].Eur Radiol,2006,16(11):2471-2482.
[5]ROY-CHOUDHURY S.Thoracic ablation:primary lung cancer,metastases,chest wall disease [M].Techniques in Interventional Radiology,2013:97-113.
[6]SHAH D R,GREEN S,ELLIOT A,et al.Current oncologic applications of radiofrequency ablation therapies[J].World J Gastrointest Oncol,2013,5(4):71-80.
[7]DEBAÈRE T,PALUSSIÈRE J,AUPÉRIN A,et al.Midterm local efficacy and survival after radiofrequency ablation of lung tumors with minimum follow-up of 1 year:prospective evaluation [J].Radiology,2006,240(2):587-596.
[8]LENCIONIR,CROCETTIL,CIONIR,et al.Response toradiofrequency ablation of pulmonary tumors:a prospective,intention-to-treat,multicentre clinical trial (the RAPTURE study) [J].Lancet Oncol,2008,9(7):621-628.
[9]SCHLIJPERR C,GRUTTERS J P,HOUBENR,et al.What tochoose as radicallocal treatment for lung metastases fromcolorectalcancer:Surgeryor radiofrequency ablation? [J].Cancer Treat Rev,2014,40(1):60-67.
[10]DEBAERE T.Lung tumor radiofrequency ablation:where do we stand? [J].Cardiovasc Intervent Radiol,2011,34(2):241-251.
[11]BELANDMD,WASSERE J,MAYO-SMITH W W,et al.Primary non-small cell lung cancer:review of frequency,location,and time of recurrence after radiofrequency ablation[J].Radiology,2010,254(1):301-307.
[12]FERNANDO H C,HOYOS A D,LANDRENEAU R J,et al.Radiofrequency ablation for the treatment of nonsmall cell lung cancer in marginal surgical candidates [J].J Thorac Cardiovasc Surg,2005,129(3):639-644.
[13]BARGELLINII,BOZZIE,CIONIR,etal.Radiofrequency ablation of lung tumors [J].Insights Imaging,2011,2(5):567-576.
[14]ABBAS G,PENNATHUR A,LANDRENEAU R J,et al.Radiofrequency and microwave ablation of lung tumors [J].J Surg Oncol,2009,100(8):645-650.
[15]ABTIN F G,ERADAT J,GUTIERREZ A J,et al.Radiofrequency ablation of lung tumors:imaging features of the postablation zone [J].Radio Graphics,2012,32(4):947-969.
[16]SIMON T G,BELANDMD,MACHAN J T,et al.Charlson Comorbidity Index predicts patient outcome,in cases of inoperable non-small cell lung cancer treated with radiofrequency ablation [J].Eur JRadiol,2012,81(12):4167-4172.
[17]OKUMA T,MATSUOKA T,OKAMURA T,et al.18F-FDG small animal PET for monitoring the therapeutic effect of CT-guided radiofrequency ablation on implanted VX2 lung tumors in rabbits [J].J Nucl Med,2006,47(8):1351-1358.
[18]OKUMA T,OKAMURA T,MATSUOKA T,et al.Fluorine-18-fluorodeoxyglucose positron emission tomography for assessment of patients with unresectable recurrent or metastatic lung cancers after CT-guided radiofrequency ablation:preliminary results [J].Ann Nucl Med,2006,20(2):115-121.
[19]DEANDREIS D,LEBOULLEUX S,DROMAIN C,et al.Role of FDG PET/CT and chest CT in the followup of lung lesions treated with radiofrequency ablation [J].Radiology,2011,258(1):270-276.
[20]ALAFATE A,SHINYA T,OKUMURA Y,et al.The Maximum standardized uptake value is more reliable than size measurement in early follow-up to evaluate potential pulmonary malignancies following radiofrequency ablation[J].Acta Med Okayama,2013,67(2):105-112.

