丙戊酸联合顺铂对人肝癌细胞的增殖抑制作用研究
蒋凤琴,袁玉梅,汪荣华,姚 冲,曹恒斌
原发性肝癌是严重危害人类健康的疾病之一,目前对原发性肝癌的治疗仍以手术切除为首选方法。对无法手术的患者,化疗单独使用效果不理想,目前多采用肝动脉栓塞化疗(TACE)。TACE可增加病灶局部浓度,提高疗效,还能减轻全身毒性反应。常用的药物有顺铂(DDP)、吉西他滨等。丙戊酸(VPA)作为一线抗癫疒间药物,已长期应用于临床,其药理毒理已比较明确。在临床用药剂量范围内,能够有效抑制去乙酰化酶(HDACs)活性,通过诱导细胞凋亡和分化、促使细胞周期阻滞而抑制多种肿瘤细胞增殖。多项研究均证实了VPA对肝癌细胞具有抑制作用[1-4]。本研究通过使用不同浓度的VPA联合顺铂对人肝癌细胞系HepG2、BEC7404、SMMC7721的抑制作用,离体评价VPA联合顺铂对人肝癌细胞的疗效,探索其对肝癌在联合化疗过程中的增效作用。
1 仪器与材料
1.1 仪器 酶联免疫检测仪(Dynex,日本);显微镜(Leica,德国);细胞培养箱(Thermo,美国);恒温培养箱(上海实验仪器厂);水浴箱(上海新苗医疗器械制造有限公司);净化操作台(苏州净化设备有限公司);离心机(上海手术器械厂)。
1.2 材料 VPA(购自Sigma公司);顺铂(购自齐鲁制药有限公司,0100241DB);MTT(购自Amresco公司);DMSO(购自Amresco公司);DMEM(购自GIBCO公司);胎牛血清(购自GIBCO公司);青霉素/链霉素双抗(购自GIBCO公司);胰蛋白酶(购自GIBCO公司);人肝癌细胞系HepG2细胞(购自中国科学院细胞库);人肝癌细胞系BEC7404细胞(购自中国科学院细胞库);人肝癌细胞系SMMC7721细胞(购自中国科学院细胞库)。
2 方法
2.1 细胞培养 取人肝癌细胞系HepG2、BEC7404、SMMC7721细胞,应用含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM高糖培养基,在37℃、5%CO2、饱和湿度下培养。每2 d换1次培养液。细胞生长至对数期用0.25%胰蛋白酶消化,传代培养,台盼蓝染色证实活细胞≥95%并计数细胞,备用。
2.2 细胞形态观察 取对数生长期人肝癌细胞系 HepG2、BEC7404、SMMC7721细胞,以5 ×104/孔接种于6孔板。37℃、5%CO2孵箱培养24 h后,分别加入终浓度为300 μg/mL 的VPA、18 μg/mL 的 DDP,DDP+VPA 组为 18 μg/mL+300 μg/mL。处理24、48、72 h后,在倒置显微镜下观察细胞形态学变化。
2.3 细胞增殖检测 用0.25%胰蛋白酶消化对数生长期人肝癌细胞系HepG2、BEC7404、SMMC7721,细胞计数调整为5×104/mL,每孔100 μL接种于96孔板,37℃、5%CO2过夜贴壁培养24 h后,分别加入3种不同浓度的VPA溶液10 μL,使细胞培养液浓度梯度为 300 μg/mL、100 μg/mL、33 μg/mL,加入3种不同浓度的DDP溶液10 μL,使细胞培养液浓度梯度为 18 μg/mL、6 μg/mL、2 μg/mL,得VPA联合DDP共9组(见表1),并设不加药物的细胞作为对照组。

表1 VPA+DDP的9组浓度梯度(μg/mL)
用含10%胎牛血清的DMEM培养液培养24、48、72 h 后,每孔加入 MTT 液(5 mg/mL)10 μL,37℃避光培养4 h,弃细胞培养液后,每孔加入DMSO 100 μL,溶解紫蓝色结晶,轻轻振荡 10 min,使结晶物充分溶解。将96孔板置全自动酶标仪上,用酶标仪测定吸光度(OD)值,测定每孔490 nm波长OD值,实验重复2次,每一次、每一浓度及每时段均设3复孔。计算不同作用时间各组物质对A549细胞及HepG2细胞的抑制率。按下式计算药物对细胞增殖的抑制率(IR):IR=(对照组OD值-实验组OD值)/对照组OD值×100%。联合用药对细胞增殖抑制率的计算用q表示,q=R(A+B)[RA+(1-RA)/RB]。R(A+B)为两药联合使用时对细胞的抑制率,RA为A药对细胞的抑制率,RB为B药对细胞的抑制率。若q值在0.85~1.15范围内,表示两药作用相加;q值>1.15表明两药作用协同;q值<0.85表示两药合用有拮抗作用。
3 结果
3.1 细胞形态的影响 单独使用VPA或使用DDP处理人肝癌细胞系 HepG2、BEC7404、SMMC7721细胞,在24 h后其细胞数目开始减少,但细胞形态未见明显变化;VPA联合DDP处理,其细胞数目减少略为明显,细胞形态略有变化。但随着处理时间延长,VPA组、DDP组、VPA+DDP组的细胞数目均减少,细胞形态发生改变。至72 h后,VPA组、DDP组、VPA+DDP组细胞数目减少十分明显,其中,VPA+DDP组较单独用药组减少更为显著,其细胞形态大小不等,多成球形,高倍镜检可见核固缩加剧、胞浆减少,胞质内出现空泡,细胞脱壁呈半悬浮状态,培养基中有较多的细胞碎片及死细胞。见图1(处理72 h)。结果表明,在对肝癌细胞系HepG2、BEC7404、SMMC7721的增殖抑制上,VPA联合DDP组具有更为显著的抑制效果,且随着作用时间的延长,其抑制作用有增强的趋势。
3.2 VPA联合DDP对人肝癌细胞的增殖抑制作用 使用三组不同浓度的VPA、DDP、VPA+DDP处理对数生长期的 HepG2、BEC7404、SMMC7721细胞24、48、72 h后,MTT比色法显示,对照组细胞生长率明显高于各实验组,各实验组之间差异有统计学意义,联合用药组对细胞增殖的抑制率(IR)更为显著,且随着药物浓度增加及作用时间延长,各组对细胞增殖IR明显增加。见表2~表7。表明VPA联合DDP对人肝癌细胞生长有更强的抑制作用,且这种抑制作用的强度与药物浓度、作用时间有关。
3.3 联合用药对人细胞增殖抑制率的影响 通过计算各组药物对细胞增殖的抑制率(IR),进一步计算VPA联合DDP对人肝癌细胞增殖IR的增强是否具有协同作用。使用q值来表示两药联用的协同作用。结果表明,VPA为300 μg/mL及100 μg/mL时,两药物联合使用有明确的协同作用;当VPA为33 μg/mL时,其协同作用不够明确。DDP的浓度及作用时间对两药物的协同作用无明显影响。见表8。

图1 VPA、DDP、VPA+DDP 对 HepG2、BEC7404、SMMC7721 的增殖抑制

表2 VPA、DDP对HepG2细胞增殖的影响

表3 VPA+DDP对HepG2细胞增殖的影响

表4 VPA、DDP对BEC7404细胞增殖的影响
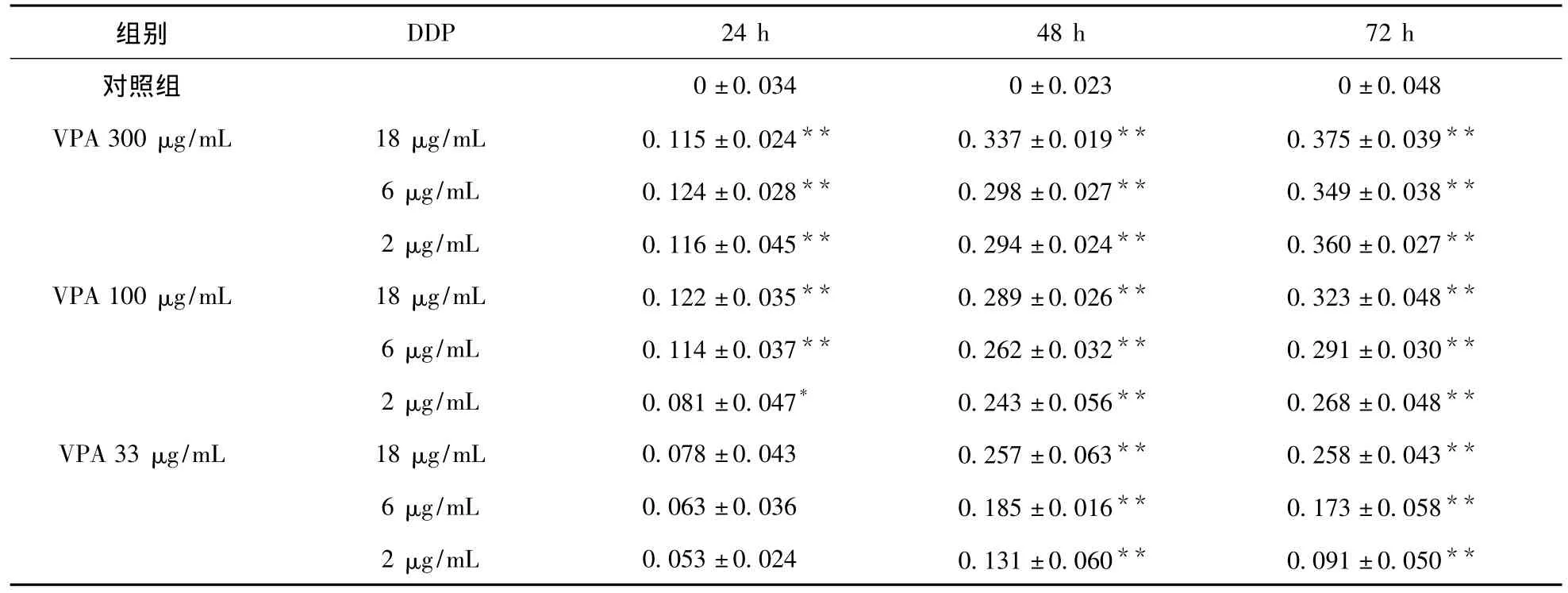
表5 VPA+DDP对BEC7404细胞增殖的影响

表6 VPA、DDP对SMMC7721细胞增殖的影响
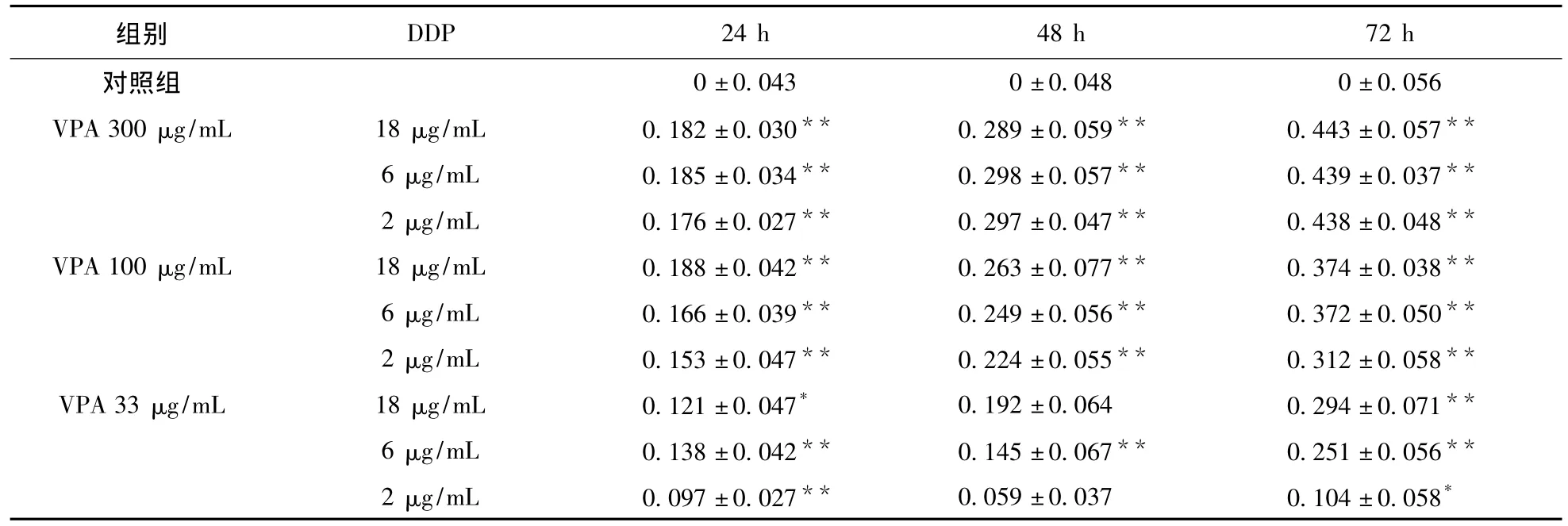
表7 VPA+DDP对SMMC7721细胞增殖的影响
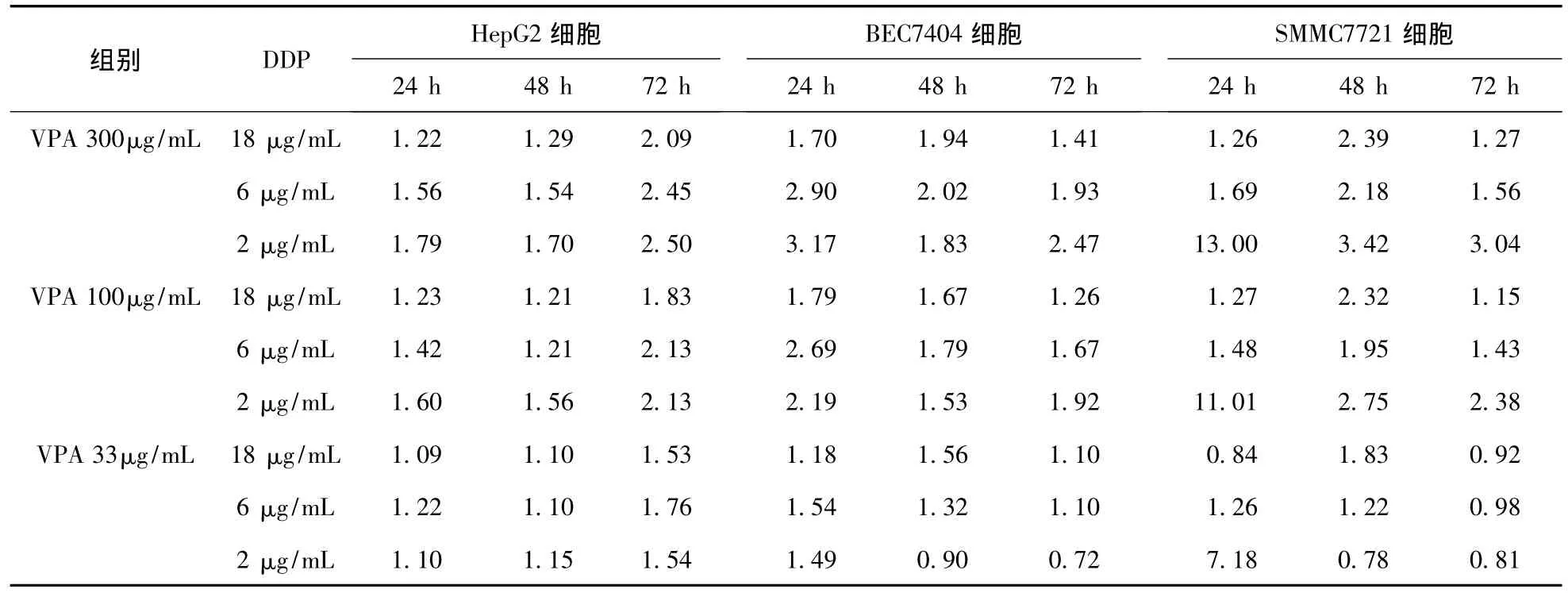
表8 联合用药对HepG2细胞增殖抑制率的q值
4 讨论
当前国际上将去乙酰化酶抑制剂(HDACI)作为治疗肿瘤的一个新的前沿,VPA作为Ⅰ和Ⅱ型HDACI,可以有效促使多种肿瘤细胞的形态和代谢改变,抑制细胞生长、分化及凋亡用[5-6]。Takai等[7]发现,VPA能有效抑制子宫内膜癌细胞的生长,细胞周期分析显示,HDACIs可以减少S期细胞的比例,增加G0-G1与/或G2-M的细胞比例。侯华英等[8]探讨VPA对人宫颈癌细胞HeLa的增殖机制,结果表明,VPA通过增加Caspase3蛋白表达,下调bcl-2蛋白的表达,诱导HeLa细胞凋亡、抑制细胞增殖。罗恒等[9]发现,VPA可抑制肺癌A549细胞生长,改变细胞周期分布,促进细胞凋亡。
在治疗肝癌方面,Armeanu等[1]发现,VPA 对肝癌细胞具有抗增殖与凋亡作用,且对肝细胞没有影响。时昌文等[2-4]证实了丙戊酸钠对肝癌细胞系HepG2的生长抑制作用与浓度呈剂量依赖趋势,上调Caspase3、Caspase9的蛋白表达及活性可能是VPA诱导细胞凋亡的主要途径。此外,VPA通过逆转肿瘤细胞组蛋白低乙酰化修饰水平来抑制肝癌细胞侵袭转移,下调MMP-2与MMP-9蛋白表达可能是其发挥作用的主要机制之一。
VPA作为HDACI,可以增强多种化疗药物的疗效。Trus等[10]发现,VPA联合全反式维甲酸(ATRA)在治疗急性骨髓系白血病(AML)中,可以增强肿瘤细胞的敏感性。两组不同临床试验分别显示出VPA联合ATRA对部分患者具有缓解作用[11-12]。Catalano等[13]研究发现,VPA 在治疗癫疒间的浓度范围,可以增强阿霉素对未分化甲状腺癌细胞的作用。VPA可以促使微管蛋白乙酰化,增强紫杉醇(Taxol)在甲状腺癌细胞株中的凋亡活性[14]。Hubaux 等[15]证实,在小细胞肺癌(SCLC)的临床前治疗上,VPA联合标准一线化疗方案(DDP联合依托泊苷),可以有效提高化疗药物的疗效。李益清等[16]报道,丙戊酸联合阿糖胞苷(Ara-C)对白血病细胞株 HL-60及耐药细胞株HL-60/HT具有协同疗效,VPA还能抑制HL-60/HT,降低耐药细胞株对Ara-C的耐药性。
VPA在治疗癫疒间时的血浆浓度一般≤100 μg/mL,高于此浓度可能会发生较严重的不良反应。本研究将100 μg/mL作为基值,选择3组浓度梯度,考察了VPA联合化疗药物DDP对人肝癌细胞的抑制作用。结果表明,联合用药组的抑制率较单药组显著增强,并且与药物浓度、作用时间呈依赖趋势,在VPA较高浓度(≥100 μg/mL)时,联合组具有明显的协同优势。
[1] Armeanu S,Pathil A,Venturelli S,et al.Apoptosis on hepatoma cells but not on primary hepatocytes by histone deacetylase inhibitors valproate and ITF2357[J].J Hepatol,2005,42(2):210-217.
[2] 时昌文,李杰,赵霞,等.丙戊酸钠对肝癌细胞系 HepG2的生长抑制作用[J].中华肿瘤防治杂志,2007,14(7):510-513.
[3] 赵霞,时昌文,孙京杰,等.应用 VPA调节组蛋白乙酰化修饰对肿瘤细胞 Caspase的影响[J].中国免疫学杂志,2009,25:229-233.
[4] 赵霞,时昌文,汪运山,等.戊酸钠调节组蛋白乙酰化对肝癌细胞浸润转移影响的研究[J].中华肿瘤防治杂志,2009,16(2):93-96.
[5] 赵慧慧,邱少敏,何耿劲.丙戊酸钠对人肝癌细胞株Bel-7402增殖及VEGF、bFGF表达的影响[J].实用肿瘤杂志,2011,26(6):577-580.
[6] 钱方方,蒋小猛,徐岷等.丙戊酸钠对肝癌SMMC-7721细胞增殖和细胞周期的影响及机制[J].世界华人消化杂志,2012,20(10):74-78.
[7] Takai N,Desmond JC,Kumagai T,et al.Histone deacetylase inhibitors have a profound antigrowth activity in endometrial cancer cells[J].Clin Cancer Res,2004,10(3):1141-1149.
[8] 侯华英,姜玉华.丙基戊酸钠对宫颈癌细胞HeLa增殖的影响机制[J].现代妇产科进展,2008,17(4):277-280.
[9] 罗恒,刘明忠.丙戊酸钠抑制肺癌细胞株A549增殖的研究[J].同济大学学报,2009,30(2):38-43.
[10] Trus MR,Yang L,Suarez Saiz F,et al.The histone deacetylase inhibitor valproic acid alters sensitivity towards all trans retinoic acid in acute myeloblastic leukemia cells[J].Leukemia,2005,19(7):1161-1168.
[11] Bug G,Ritter M,Wassmann B,et al.Clinical trial of valproic acid and all-trans retinoic acid in patients with poor-risk acute myeloid leukemia[J].Cancer,2005,104(12):2717-2725.
[12] Kuendgen A,Schmid M,Schlenk R,et al.The histone deacetylase(HDAC)inhibitor valproic acid as monotherapy or in combination with all-trans retinoic acid in patients with acute myeloid leukemia[J].Cancer,2006,106(1):112-119.
[13] Catalano MG,Fortunati N,Pugliese M,et al.Valproic acid,a histone deacetylase inhibitor,enhances sensitivity to doxorubicin in anaplastic thyroid cancer cells[J].J Endocrinol,2006,191(2):465-472.
[14] Catalano MG,Poli R,Rugliese M.et al.Valproic acid enhances tubulin acetylation and apoptotic activity of paclitaxel on anaplastic thyroid cancer cell lines[J].Endocr Relat Cancer,2007,14(3):839-845.
[15] Hubaux R,Vandermeers F,Crisanti MC,et al.Preclinical evidence for a beneficial impact of valproate on the response of small cell lung cancer to first-line chemotherapy[J].Eur J Cancer,2010,46(9):1724-1734.
[16] 李益清,尹松梅,谢双锋,等.丙戊酸对 HL-60/HT细胞P27Kip1、P170表达水平及耐药性的影响[J].南方医科大学学报,2009,29(3):423-427.

