罗非鱼头蛋白质的提取及性质研究*
刘慧清,周春霞,洪鹏志,王瑛
(广东省水产品加工与安全重点实验室,广东省普通高等学校水产品深加工重点实验室,广东海洋大学食品科技学院,广东湛江,524088)
目前,我国养殖的罗非鱼主要出口到欧美等市场[1]。消费形式以罗非鱼片为主,加工下脚料大部分低价卖给饲料厂,蛋白利用率低。罗非鱼下脚料含有丰富的蛋白质,氨基酸和微量元素等。为了更好地利用蛋白资源,国内外开展了大量提取鱼蛋白的研究,主要的提取方法包括酶解法[2]、加热浸提法[3]、酸/碱溶解-等电点沉淀法[4-5]。加热浸提法和酶解法是较为传统的方法,水解鱼蛋白降解大部分为小分子蛋白,肽及氨基酸等混合物。酸/碱溶解-等电点沉淀法是1997年Hultin等[6]首先提出的提取蛋白的新方法,因其制备的蛋白质变性程度低,回收率高,功能特性好等,引起了国外学者的普遍关注,但国内的研究较少。本研究以罗非鱼头为原料,采用加热浸提、酶法水解、酸/碱溶解-等电点沉淀法制备罗非鱼头蛋白,比较分析4种蛋白质的性质,主要的目的是制备营养价值高,功能特性较好的高纯度鱼蛋白质。
1 材料与方法
1.1 实验材料
罗非鱼:湛江水产东风市场购买,立即运送到实验室,取鱼头(tilapia head,TH)、去腮、清洗、沥干、绞碎、分装(100 g/袋),于-80℃冷冻备用。
1.2 罗非鱼头蛋白的制备
加热浸提法:鱼头→4℃解冻→加蒸馏水[物料∶水 =1∶1.5(g∶mL),下同]→均质 2 min→85℃下搅拌60 min→离心(2560×g,15 min)→过滤→水解液→冷冻干燥→热提鱼蛋白(heating extraction fish protein,HFP)→真空包装后在4℃下贮藏
酶法水解:鱼头→4℃解冻→加蒸馏水[物料∶水=1∶1(g∶mL)]→水浴(pH 8.0 温度50℃)→加酶量E/S为0.1%→滴加NaOH标准溶液维持pH值恒定(pH-stat法[7]控制酶解)→反应达到所需的水解度后于100℃水浴灭酶15 min→离心(2 560×g,15 min)→过滤→水解液→冷冻干燥→酶解鱼蛋白(enzyme hydrolysis fish protein,EFP)→真空包装并在4℃下贮藏
酸/碱溶解-等电点沉淀法:鱼头→4℃解冻→加冰蒸馏水[物料∶水 =1∶9(g∶mL)]均质2 min→调节pH 值(pH 3.0、11.0)→低温低速搅拌提取 10 min→离心(10 000 r/min,20 min,4℃)→过滤→上清液调pH 5.5→离心(10 000 r/min,20 min,4℃)→沉淀加少量冰水分散,调pH值7.0→冷冻干燥→酸溶鱼蛋白(acid soluble fish protein,AFP)、碱溶鱼蛋白(alkaline soluble fish protein,ALFP)→真空包装并在4℃下贮藏
1.3 罗非鱼头蛋白回收率的测定
蛋白回收率用冷冻干燥所得蛋白粉的蛋白含量与罗非鱼鱼头原料蛋白含量的百分比来表示,蛋白含量用凯氏定氮法测定。
1.4 罗非鱼头蛋白白度值的测定
蛋白样品的白度(whiteness)值采用色差计测定,测定罗非鱼蛋白粉的颜色和光泽,用L*值,a*值,b*值表示。L*代表亮度,刻度从0(黑色)到100(白色);a*代表红色的强度(a*﹥0表示红色,a*﹤0表示绿色)。b*代表黄色的强度(b*﹤0表示蓝色,b*﹥0表示黄色)。所有样品平行测定3次,取平均值。公式如下:
白度 =100-[(100-L*)2+a*2+b*2]1/2
1.5 罗非鱼头蛋白溶解性的测定
配置浓度为5 g/L的蛋白溶液,调节到相应 pH值,充分搅拌后离心(5 000 r/min,20 min),分别检测离心后上清液中的蛋白含量和离心前体系中的蛋白含量,两者的比值表示溶解度的大小。蛋白含量用福林酚法测定。
1.6 乳化性的测定
采用浊度法[8]测定蛋白的乳化活性(emulsifying activity,EA)和乳化稳定性(emulsifying stability,ES)。
1.7 统计分析
数据统计分析采用JMP程序进行方差分析,差异显著性(P<0.05)分析使用t统计量程序,作图采用origin7.50软件作图。试验所得数据结果表示为平均值±标准差mean values±SD(standard deviation)。
2 结果与讨论
2.1 罗非鱼头蛋白的制备及基本成分分析
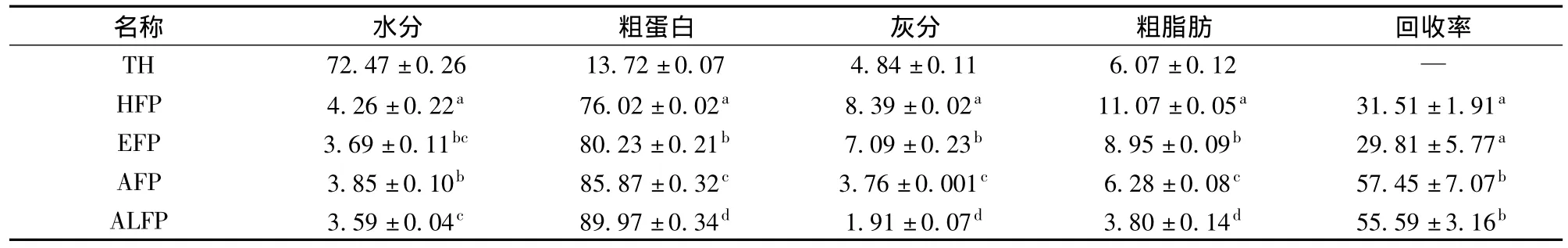
表1 罗非鱼头及其蛋白粉的一般营养成分 %Table 1 The general nutritional components of tilapia head and protein powders %
分别采用加热浸提、酶法水解、酸/碱溶解-沉淀法四种方法提取,冷冻干燥制备鱼蛋白粉,对其营养成分和回收率进行分析,结果如表1所示。由表1可得,采用酸/碱溶解-等电点沉淀法回收鱼蛋白粉的蛋白回收率分别为57.45%和55.59%,远高于热水提取(31.51%)和酶法水解(29.81%),由此表明,酸/碱溶解-等电点沉淀法可以有效回收罗非鱼鱼头蛋白。加热浸提和酶法水解回收的大部分是水溶性的肌浆蛋白,且热处理过程中蛋白变性,使溶解度下降,沉淀后离心被除去,导致了鱼蛋白的回收率低;酸/碱溶解-等电点沉淀法在极端酸碱条件下溶解并回收了大部分的肌原纤维蛋白和肌浆蛋白,只有一小部分的结缔组织蛋白,膜结构蛋白没有被利用[9],故蛋白回收率显著提高。
4种方法提取所得的蛋白粉样品的粗蛋白含量为76.02% ~89.97%,其中热提鱼蛋白和酶解鱼蛋白的蛋白含量低于80%,脂肪和灰分含量均较高,而酸提蛋白和碱提蛋白的蛋白含量均高于85%,且蛋白含量差异显著(P﹤0.05)。酸/碱溶解-等电点沉淀法也可以有效去除脂肪和灰分,主要原因是提取全过程在低温下进行,脂肪在低温下易凝固,高速冷冻离心并过滤可以除去绝大部分的中性脂质、膜脂和灰分[10],因而 AFP和 ALFP的纯度较高。总体分析,酸/碱溶解-沉淀法具有较高的回收率,蛋白质含量高,能有效去除脂肪和不溶性杂质,降低蛋白的氧化。
2.2 罗非鱼头蛋白粉的氨基酸组成分析
氨基酸含量和组成是衡量蛋白质营养价值的重要指标,表2列出了罗非鱼头及其蛋白粉17种氨基酸组成,其中9种必需氨基酸(组氨酸为婴儿必需氨基酸)。依据FAO/WHO理想模式,优质蛋白质必需氨基酸占总氨基酸的40%左右,必需氨基酸占非必需氨基酸的60%[11]。按照这一标准,罗非鱼头及其提取的酸溶蛋白和碱溶蛋白均符合上述指标要求,氨基酸平衡效果较好,属于优质蛋白质。
与罗非鱼鱼头原料相比,热水浸提降低了大部分的氨基酸含量,因为加热浸提法浸出物成分复杂,其中主要是一些含氮浸出物、游离的氨基酸、小肽、肽的衍生物、嘌呤碱等[12]。同时氨基酸在加热过程中与糖类化合物发生美拉德反应生成挥发性的风味物质,以气体的形式损失[13]。而 Pro,Gly,Ala的含量增加;酶法水解是一种温和的水解蛋白的方法,与原料蛋白的氨基酸组成相比,氨基酸含量有轻微的下降,但较好地保持了氨基酸的完整性;原料中的氨基酸是以大分子蛋白质形式存在,而酶解物的氨基酸是以游离氨基酸分子形式和肽分子形式存在的。酸/碱溶解-等电点沉淀法降低了Gly,Ala和Pro的含量,特别是甘氨酸的含量大幅下降,因为提取过程中去掉了大部分的胶原蛋白[14],而胶原蛋白中含有丰富的 Gly和Pro,另外可能因为部分甘氨酸是游离氨基酸,在蛋白质沉淀回收过程中部分被除去[15],酸溶蛋白和碱溶蛋白Ile,Leu,Lys的含量得到提高,其余氨基酸含量与原料基本保持一致。总体分析,4种提取方法中,加热浸提法氨基酸含量降低幅度最大,酶法水解下降程度较小,但加热浸提和酶法水解提取的蛋白必需氨基酸占总氨基酸均低于40%,必需氨基酸占非必需氨基酸未达到60%,未达到优质蛋白的范畴,故酸/碱溶解-等电点沉淀法能较好地保持氨基酸的完整性,氨基酸平衡效果较好。

表2 罗非鱼鱼头及其蛋白粉的氨基酸组成及含量 mg/g粗蛋白Table 2 Amino acid composition and content of from tilapia head and fish protein powders mg/g protein

表3 罗非鱼头及其蛋白粉的必需氨基酸评价Table 3 Evaluation of essential amino acid in the tilapia head and fish protein powders
2.3 罗非鱼头蛋白粉的必需氨基酸评价
根据FAO/WHO/UNU 1985年提出的蛋白质模式,对罗非鱼头蛋白必需氨基酸进行评价,AAS和CS见表3,从表中可以看出,除HFP外,TH、EFP、AFP和ALFP的AAS均大于1,符合成人对氨基酸的需求。按照婴儿模式,原料及其四种蛋白粉的第一限制性氨基酸都为色氨酸,第二限制性氨基酸组氨酸、异亮氨酸、蛋氨酸+胱氨酸。按照化学评分,除HFP两种限制性氨基酸是色氨酸和亮氨酸以外,TH、EFP、AFP和ALFP都为色氨酸和(蛋氨酸+胱氨酸)。相似的是,评分最高的都是赖氨酸。比较四种蛋白的评分,TH评分高于HFP和EFP,而低于AFP和ALFP,故可认为酸/碱溶解-等电点沉淀法提取的蛋白优于加热浸提、酶法水解提取的蛋白。
2.4 罗非鱼头蛋白粉的色差分析
罗非鱼头蛋白颜色分析如表4所示。

表4 罗非鱼头蛋白粉的色差Table 4 The whiteness of tilapia head protein powders
总体来看,4种蛋白粉的白度值都较低,主要原因是鱼头中含有较多的色素物质:肌红蛋白,血红蛋白和鱼皮黑色素等。与AFP和ALFP相比,EFP和HFP具有较高的L*值和较低的a*和b*值,因此酶解法和加热浸提法制得的蛋白白度值显著高于酸/碱溶-等电点沉淀蛋白(P<0.05)。主要原因是热提蛋白和酶解蛋白肌红蛋白和血红蛋白的变性引起,蛋白在加热过程中肌红蛋白变性生成变性珠蛋白高铁血色原,从而变为灰白色,白度值增加。酸/碱溶解-等电点沉淀法回收了绝大部分蛋白,色素物质也可能随着蛋白的提取而被提取出来,AFP和ALFP的a*值较高是由残留的未变性的血红蛋白引起,另一方面血红蛋白在极端pH环境中发生氧化[16],故b*值较高是由变性和氧化的血红蛋白和肌红蛋白引起[17],同时脂肪氧化也会使蛋白质颜色偏黄。故4种提取方法中,加热浸提和酶法水解得到的蛋白色泽较好,而酸/碱溶解-等电点沉淀法提取的蛋白色泽相对较差。
2.5 罗非鱼头蛋白粉的溶解性分析
pH值对罗非鱼头蛋白粉溶解性的影响如图1所示。由图1可知,四种蛋白溶解度随pH值的变化曲线呈两种不同的趋势。在实验pH值范围内,热提蛋白和酶解蛋白的溶解性较好,其溶解度均高于93%,由此也进一步表明这两种方法回收的蛋白以水溶性成分为主,因此蛋白回收率较低,溶解性较好。经过酸/碱溶解-等电点沉淀法提取的蛋白溶解度呈U型曲线,在pH 4.0~6.0内,蛋白的溶解性最差,偏离此pH值范围溶解度大大增强,这与Mohamed[18]等报道的罗非鱼肉分离蛋白U型溶解度曲线相似。由此进一步表明酸/碱溶解-等电点沉淀提取的蛋白包括盐溶性、水溶性和部分不溶性蛋白组分,蛋白回收率也较高。当pH值偏离等电点范围时,蛋白结构展开,蛋白质表面带净正电荷或净负电荷,水分子与之结合使之稳定,蛋白质的溶解度随之增大。当pH值接近等电点时,蛋白结构重新折叠,表面净电荷几乎为零,水合作用弱,蛋白质容易发生聚集沉淀[19]。比较而言,ALFP的溶解性较AFP好,可能与酸性条件下蛋白的变性和聚集程度更大有关[15]。总体分析,热水浸提和酶法水解提取的蛋白在pH 2.0~10.0内溶解性均较好,而酸/碱溶解-等电点沉淀法提取的蛋白在接近等电点pH值时溶解性较差,偏离等电点范围蛋白溶解度增强,由此推断,ALFP和AFP的等电点很可能在 pH 4.0 ~6.0 内。
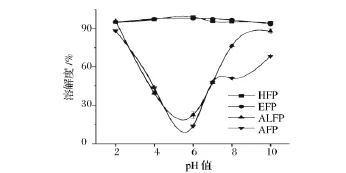
图1 pH值对罗非鱼头蛋白粉溶解性的影响Fig.1 Effect of pH on protein solubility of tilapia head protein powders
2.6 罗非鱼头蛋白粉的乳化性分析
pH值对罗非鱼蛋白对乳化活性和乳化稳定性的影响如图2所示。由图2可得:(1)在实验范围内,EAI和ESI值随pH值的变化趋势相同,呈现先下降后上升,在pH 4.0~6.0内,蛋白质的乳化活性和乳化稳定性最差。而当pH值偏离等电点范围时,蛋白溶解度提高,蛋白迅速扩散并在表面吸收。乳化性能随之增加。在等电点pH值附近,溶解性最差,蛋白质在油-水界面上的吸附也最少,导致乳化活性和乳化稳定性最差[20];(2)4种方法提取的蛋白比较,AFP和ALFP的蛋白乳化性显著高于HFP和EFP,原因是酸/碱溶解-等电点沉淀法提取的组分主要有肌浆蛋白和肌原纤维蛋白,肌原纤维蛋白的两亲性可以有效降低油-水界面的张力,且蛋白在提取过程中降解的蛋白暴露了疏水基团,大分子蛋白和疏水基团越多,体系的乳化性越好[21]。加热浸提和酶法水解蛋白质大分子降解为小分子,故体系的乳化性能相对较差;(3)碱溶蛋白的乳化性较酸溶蛋白好,也进一步表明碱溶蛋白提取过程中的变性程度相对酸溶蛋白要较。总体分析,酸/碱溶解-等电点沉淀法制备的蛋白乳化性显著高于加热浸提法和酶解法提取的蛋白,但酸/碱溶蛋白在接近等电点pH值时乳化性较差,偏离等电点范围蛋白乳化性较好。

图2 pH值对罗非鱼头蛋白粉乳化性的影响Fig.2 Effect of pH on emulsifying properties of tilapia head protein powders
3 结论
本研究采用加热浸提、酶法水解、酸溶-等电点沉淀和碱溶解-等电点沉淀4种方法提取罗非鱼头蛋白,经冷冻干燥制得鱼蛋白粉。比较分析,酸/碱溶解-等电点沉淀法提取蛋白的回收率较高,由此制备的蛋白粉纯度也较高,脂肪和灰分含量低,必需氨基酸占总氨基酸的比例高,但溶解度在pH 4.0~6.0内较差,在pH值低于4.0或高于6.0时,溶解度大大增强,乳化性也较好。而加热浸提、酶法水解制备的蛋白色泽较好,在实验pH值2.0~10.0内具有良好的溶解性,但乳化性差。
[1] 朱志伟,曾庆孝,林奕封.罗非鱼肉的酶解控制和复合研究[J].食品发酵与工业,2003,29(7):55-58.
[2] Geirsdottir M,Sigurgisladottir S.Enzymatic hydrolysis of Blue Whiting(Micromesistius poutassou);functional and bioactive properties[J].Journal of Food Science,2011,76(1):C14-C20.
[3] Yin H X,Wan Y T.Functional properties of protein fractions of Channel Catfish(Ictalurus punctatus)and their effects in an emulsion system [J].Journal of Food Science,2011,76(3):E283-E290.
[4] Yongsawatdigul J,Hemung B O.Structural changes and functional properties of Threadfin Bream sarcoplasmic proteins subjected to pH-shifting treatments and lyophilization[J].Journal of Food Science,2010,75(3):C251-C257.
[5] Pires C,Costa S,Batista A P,et al.Properties of protein powder prepared from Cape hake by-products[J].Journal of Food Engineering,2012,108(2):268-275.
[6] Hultin S D,Kelleher H O.Process for isolating a protein composition from a muscle source and protein composition[P].US,08/797,929.1997-02-12.
[7] Adler-Nissen J.Enzymic Hydrolysis of Food Proteins[M].London:Elsevier Applied Science Publishers Ltd.1986.
[8] Agyare K K,Addo K,Xiong Y L et al.Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J].Food Hydrocolloids.2009,23(1):72-81.
[9] Hultin H O,Kelleher S D.Surimi and Surimi Seafood[M].New York:Marcel Dekker,2000.
[10] Nolsøe H,Undeland I.The acid and alkaline solubilization process for the isolation of muscle proteins:state of the art[J].Food and Bioprocess Technology.2009,2:1-27.
[11] FAO/WHO/UNU Expert Consultation.Energy and Protein Requirements[M].Geneva:WHO Technical Report Series,1985.
[12] 毛羽扬.烹饪解疑[M].北京:科学出版社,2006.
[13] 张小强.热处理对鸡汤品质的影响[D].郑州:河南农业大学,2008:35.
[14] 付湘晋.白鲢鱼脱腥及其低盐鱼糜制备的研究[D].无锡:江南大学,2009:78-79.
[15] 刘诗长,周春霞,洪鹏志,等.罗非鱼肉分离蛋白的营养成分分析[J].现代食品科技,2011,27(7):843-846.
[16] Kristinsson H G,Hultin H O.Changes in trout hemoglo-bin conformations and solubility after exposure to acid and alkali pH[J].Journal of Agricultural and Food Chemistry.2004,52(11):3 633-3 643.
[17] Kristinsson H G,Hultin H O.The effect of acid and alkali unfolding and subsequent refolding on the pro-oxidative activity of trout hemoglobin[J].Journal of Agricultural and Food Chemistry.2004,52(17):5 482-5 490.
[18] Mohamed B K F,Xia W S.Influence of pH shift on functional properties of protein isolated of Tilapia(Oreochromis niloticus)muscles and of soy protein isolate[J].Food and Bioprocess Technology,2012,5(6):2 192-2 200.
[19] 安广杰,王璋.改性水解明胶的理化性质分析[J].食品科技,2007(8):84-87.
[20] 管斌,林洪,王广策.食品蛋白质化学[M].北京:化学工业出版社,2005.
[21] Mutilangi W A M,Panyam D,Kilara A et al.Functional properties of hydrolysates from proteolysis of heat-denatured whey protein isolate[J].Journal of Food Science,1996,61:270-274.

