NaCl 胁迫下海马齿(Sesuvium portulacastrum L.)植株内游离脯氨酸的合成积累途径
钱大文,周鸿凯 ,江大可,孙泽荣,陈晓宏,袁建活
(广东海洋大学 农学院,广东 湛江524088)
盐害是农业生产上最主要的非生物逆境之一[1],世界上约有20%的耕地和近一半的灌溉地受到盐胁迫的危害。在全球变暖的大环境下,全球海平面近10 多年来在加速上升。海平面上升将引发海水入侵、土壤盐渍化等问题,从而加剧耕地受盐胁迫的危害程度。如何利用和开发盐渍化土地,提高作物产量和改善生态环境是全世界100 多个国家面临的重大课题,各国科学家为此均做出了不懈的努力。科学家们试图克隆出耐盐基因并转移到目标作物(如水稻、小麦、玉米、甘蔗、大豆等)中,实现目标作物具有较强的耐盐性,以保持农业可持续性发展。如,Delauney 等[2]通过转入P5CS 基因来提高植物的抗渗透胁迫能力。Sawahel 等[3]通过花粉管法把P5CS 基因导入小麦。Capell 等[4]将多胺合成酶基因转入水稻,提高了水稻的耐逆性。Samis和Bowley[5]将Mn -SOD 基因转入紫花苜蓿中,其抗逆能力和生物产量皆有提高。植物耐盐相关基因的研究主要涉及渗透调节物质、离子区域化、大分子蛋白、基因表达的调控、保护酶等。
海马齿(Sesuvium portulacastrum L.)又名滨水菜、蟳螯菜或猪母菜,番杏科海马齿属植物,是一种多年生肉质喜沙的兼性多年生肉质草本植物,生长在海边沙地或盐碱地。海马齿在盐渍和非盐渍条件下均能生长,并能完成其生活史,拥有一套有别于淡土植物的遗传背景和耐盐碱生理机制,属于典型的盐生植物,其耐盐特性属于诱导性状[6]。对高盐、干旱和重金属离子具有很高的耐受性,如Messeddi 等[7]的研究认为,即使在高达1 mol/L 的NaCl 浓度下海马齿仍能生长,虽生长显著减缓,但不会导致盐离子中毒或矿质营养元素缺乏等症状的发生。大量资料表明了脯氨酸累积与植物对干旱和盐胁迫适应性之间表现出正相关性[8],而海马齿是一种高积累脯氨酸植物[9,10],所以海马齿具有较强的环境适应性。Ramani 等[11]以液质联用法研究盐度对碱苑(Aster tripolium)和海马齿(Sesuvium portulacastrum)中硫脂物质含量的影响,结果表明,后者较前者具有更强的盐度耐受性;Inès 等[9]研究发现,成年的海马齿植株对长时间缺水有很强的忍耐性,在恢复浇水后能继续生长。因此,海马齿对于盐碱地的开发利用、改善生态环境、提供耐盐碱基因等方面,具有很重要的实际利用潜力。
自20 世纪八九十年代以来,零星报道了盐胁迫下海马齿植株内氨基酸和矿物质等组分变化[12-13],真正的系统研究则始于21 世纪,对海马齿耐盐、耐旱及耐重金属镉离子(Cd2+)的生理机制方面作了较多研究报道[7,14-15],并开展分子遗传多样性、抗盐生理与分子机制、生态修复和经济用途等[16]方面的研究。但是,在盐胁迫下海马齿植株内脯氨酸合成积累的途径及其相关酶的活性方面的研究,仍为鲜见报道。本文以生长在雷州半岛海边的海马齿(Sesuvium portulacastrum L.)为材料,初步探讨了在盐胁迫条件下海马齿植株体内游离脯氨酸合成累积的途径及其P5CS、δ -OAT、SOD、POD 活性,以期为海马齿的开发利用、盐生植物的耐盐生理机制探索、发掘新的耐盐碱基因提供理论参考。
1 材料与方法
1.1 试验材料与试验设计
1.1.1 试验材料
于2010 年7 月5 日,在雷州半岛流沙湾的海滩上采集野生的海马齿(Sesuvium portulacastrum L.)回广东海洋大学培植,用海水浇灌。两个月后,选取生长均匀的植株,均匀剪取15 cm 长的苗茎24 段为种苗。试验的土壤为砾质沙土。
1.1.2 试验设计
采用盆栽试验的方法,3 次重复,完全随机设计。选用高25 cm、口径30 cm 的花盆,每盆装干砾质沙土2.0 kg;盐胁迫处理为施用NaCl 溶液。试验在玻璃温室进行,于2010 年9 月5 日,将36 段种苗按每盆2 株分别种入18 个花盆,种苗入土深度为8 cm,用营养液(体积比1∶1的海水和0.2%荷兰复合肥液临时混合液)浇淋500 mL。以后每天浇淋营养液200 mL,培育25 d、主茎长度达25 cm 时,每天用200 mL 自来水浇5 d 后,按NaCl 的6 个处理水平(0、0.2、0.4、0.6、0.8、1.0 mol·L-1)施用相应浓度的溶液200 mL,48 h 后取样(主茎顶端的嫩茎及叶片为测试样本,土壤的含水量为8.78% ±0.16%)分析测定。
1.2 测定方法
脯氨酸含量测定按照Bates 等[17]的方法;⊿1-毗咯琳-5 -羧酸合成酶(P5CS)的提取按照Kavi等[8]的方法,P5CS 的活性测定按照Garcia -Rios[18]的方法进行;鸟氨酸-δ -氨基转移酶(δ -OAT)的提取按照Delauney 等[2]的方法进行,δ -OAT 活性测定按Kim 等[19]的方法;超氧歧化酶(SOD)的测定按照南京建成生物工程研究所生产的试剂盒测定,试剂配置按照说明书操作;过氧化物酶(POD)活性测定采用愈创木酚法[20]。
1.3 统计分析方法
本研究数据的统计分析,应用统计分析软件SAS10.3 在PC 机上进行,用Duncan 法测定处理间各生理指标的差异显著性(P <0.05),并在图中进行标注。
2 结果与分析
2.1 游离脯氨酸积累量分析
图1 表明,NaCl 处理条件下,海马齿植物体内的游离脯氨酸有显著的积累效应:0.2 mol·L-1处理水平的游离脯氨酸量显著地比0 mol·L-1处理水平(CK)增加14.5%;0.6 mol·L-1水平的游离脯氨酸量达到高峰值347 μmol·g-1(FW),比CK 增加达33.5%;而后游离脯氨酸量开始下降。这一结果表明,在NaCl 的肋迫下,海马齿植物体内游离脯氨酸的积累量显著地增加,但在高浓度水平(0.8 mol·L-1)NaCl 的肋迫下,海马齿的游离脯氨酸的量又显著地下降。

图1 NaCl 胁迫下海马齿植株体内游离脯氨酸的含量
2.2 δ-OAT 的活性分析
由图2 可看出,NaCl 的施用对海马齿体内δ -OAT 酶的活性有激活效应,但随NaCl 的施用水平不同,δ-OAT 酶的活性有所差异。0.2mol·L-1处理水平的δ-OAT 酶的活性显著地比0mol·L-1处理水平(CK)增强3.1%;在0.4mol·L-1水平上δ -OAT 酶的活性达到最大值,显著地比CK 增强10.1%;随后δ-OAT 酶的活性逐步地降低。

图2 NaCl 胁迫下海马齿植株体内δ-OAT 的活性变化
2.3 P5CS 的活性分析
由图3 可知,NaCl 对海马齿体内P5CS 酶的活性产生显著的激活效应,但由于NaCl 的处理胁迫水平不同,其P5CS 酶的活性有显著的差异性:0.2 mol·L-1处理水平的P5CS 酶的活性显著地比0 mol·L-1处理水平(CK)增强26.7%;在0.6 mol·L-1水平上达到高峰值,比CK 增强46.1%;以后,P5CS 酶的活性显逐步降低的趋势。
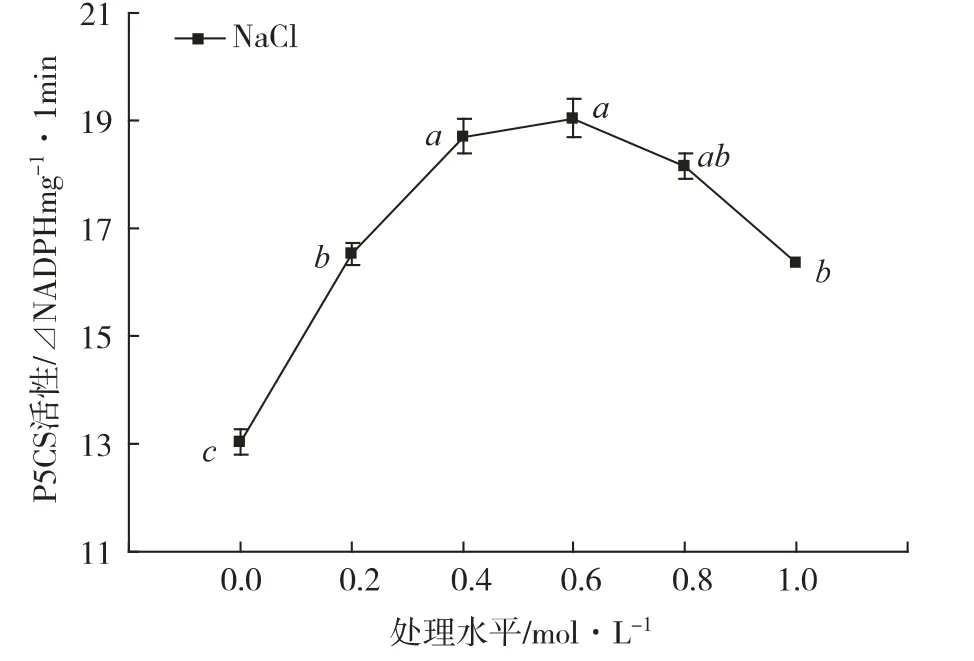
图3 NaCl 胁迫下海马齿植株体内P5CS 的活性变化
2.4 SOD 的活性分析
图4 表明,NaCl 的6 个处理水平上,海马齿的植物体内的SOD 活性有显著的差异性:0.2 mol·L-1处理水平的植物体内的SOD 活性比CK 显著地增强了70.2%;在0.6 mol·L-1水平上,其植物体内的SOD 活性达到高峰,显著地比CK 增强了1.38 倍。

图4 NaCl 胁迫下海马齿植株体内SOD 的活性变化
2.5 POD 的活性分析
图5 表明,NaCl 的6 个处理水平上,海马齿的植物体内的POD 活性有显著的差异性0.2 mol·L-1处理水平的植物体内的POD 活性比CK 显著地增强了59.6%;在0.6 mol·L-1水平上,其植物体内的POD 活性达到高峰,显著地比CK 增强了1.28 倍。

图5 NaCl 胁迫下海马齿植株体内POD 的活性变化
3 讨 论
3.1 海马齿在NaCl 胁迫下,植株内游离脯氨酸的合成积累途径
植物的脯氨酸合成、累积及代谢是一个受非生物胁迫和细胞内脯氨酸浓度高度调控的生理生化过程。脯氨酸代谢与生物体内的基础代谢过程相关联,包括合成途径和降解途径。脯氨酸的合成途径发生在细胞质中,而降解途径发生在线粒体中,这种代谢的区域化分布避免了物质的无效循环[21]。虽然对植物体内累积脯氨酸的可能途径看法不一[22-23],但一般认为渗透胁迫过程中高等植物脯氨酸的累积主要是由从头合成引起的[22],并且认为谷氨酸和鸟氨酸是脯氨酸合成的可能前体。产生脯氨酸的生物合成途径分别称为谷氨酸途径[24]和鸟氨酸途径[2]。每一个途径都受到关键酶的调节,⊿1-毗咯琳-δ-羧酸合成酶(P5CS)和δ -鸟氨酸转氨酶(δ-OAT)分别是这两个途径的关键酶[25,26]。在盐、干旱、重金属等逆境的胁迫下,哪一种途径对脯氨酸累积的影响占据主导地位,这与植物的种类、生理状态和植物体内的氮素水平有关[2,27]。Roosens等[28]以4 周龄的拟南芥为材料的研究表明,盐胁迫下植株内游离脯氨酸的增加主要是由于Glu→Pro途径引起的,而赵福庚等[29]的研究认为,盐胁迫可以明显激活大麦幼苗体内脯氨酸合成的鸟氨酸途径,使得Orn→Pro 途径成为脯氨酸合成积累的主要途径。余光辉等[30]的研究认为,在水分胁迫条件下,脯氨酸累积的规律性与δ -OAT 的活性变化呈现出很好的相关性,而与P5CS 的活性呈负相关,说明假俭草植物脯氨酸的累积主要受到δ -OAT 的活性调节。本研究表明,海马齿在NaCl 胁迫下,植株内的δ - OAT 和P5CS 活性均被显著地激活,δ -OAT 的活性在0.2 mol·L-1处理水平时比CK 增强3.1%,在0.4 mol·L-1水平达到最大值(比CK 增强10.1%);而P5CS 的活性在0.2 mol·L-1处理水平就显著地比CK 增强26.7%,在0.6 mol·L-1水平上达到高峰值(比CK 增强46.1%),并与游离脯氨酸积累量同步。因此,可以推断:海马齿受到NaCl 胁迫时,P5CS 和δ -OAT 的活性均被激活,其植株内合成脯氨酸的两条途径(Glu→Pro 和Orn→Pro)均被启动合成积累游离脯氨酸,但是以Glu→Pro 途径为主,Orn→Pro 途径为辅。这些研究结果表明,植物的游离脯氨酸合成积累是一个十分复杂的生理生化过程,涉及到多个基因的表达,植株内游离脯氨酸积累的数量是多种生理生化反应综合作用的结果。现有的研究表明,除脯氨酸的合成酶受激活外,还有其它的一些酶如脯氨酸运输酶[31]、谷氨酰胺合成酶[32]等也参与了脯氨酸的累积过程。因此,高等植物体内游离脯氨酸合成积累的机制,还有待于从植物细胞信号传递、脯氨酸运输、相关酶的作用机制等方面的进一步研究的揭示和证明。
3.2 海马齿在NaCl 胁迫下,植株内游离脯氨酸的积累效应
在NaCl 胁迫下海马齿植株内游离脯氨酸有显著的积累效应,在0.6 mol·L-1处理水平时达到积累的高峰值347μmol·g-1(FW),而后在0.8 mol·L-1的高浓度胁迫水平时,游离脯氨酸的积累量显著地降低。同时,与脯氨酸的合成、代谢有关的δ -OAT、P5CS、POD、SOD 的活性也呈现出与游离脯氨酸积累量一样的趋势,不过δ-OAT 活性在0.4 mol·L-1处理水平达到高峰期。表明了在一定浓度水平的NaCl 胁迫下,海马齿植株体内δ -OAT、P5CS 的活性均被显著地激活,合成脯氨酸的两个途径(Glu→Pro 和Orn→Pro)同时加强合成和积累脯氨酸,促进植株体内的游离脯氨酸快速积累。同时,由于植株体内的游离脯氨酸快速积累,植株体内SOD、POD的活性也被显著地激活,有效清除O-2、OH 和1O2等活性氧(ROS)的积累,缓解NaCl 导致的氧化胁迫,从而进一步提高植物的抗氧化能力。而当NaCl 的浓度过高时,这些酶的活性降低,植株体内的游离脯氨酸合成与积累受阻,导致植株体内的游离脯氨酸含量下降。这一结果进一步证明了,海马齿是一种高度耐盐植物。海马齿具有这种高耐盐特性,正是人类探索、发掘新的耐盐碱基因重要来源之一。
[1] Rhoades J D,Loveday J. Salinity in Irrigated Agriculture[C]∥Steward B A,Nielsen D R. American Society of Civil Engineers Irrigation of Agricultural Crops(Mo no graph 30). New York:American Society of Agronomists,1990:1089 -1142.
[2] Delauney A J,Hu C A,Kishor P B,et al. Cloning of omithine delta-amitransferas cDNA from vigan aconitifolin by trans-complementation in Escherichia coli and regulation of proline biosynthesis[J]. J Bio Chem,1993,268(25):18673 -18678.
[3] Sawahel W A,Hassan A H.Generation of transgenie wheat plants producing high level of the Osmoprotectant proline[J].Biotechnology Letters,2002,24(9):721 -725.
[4] Capell T,Bassie L,Christou P. Modulation of the polyamine biosynthetic pathway in transgenie rice cinfers tolerance to drought stress[J].PNAS,2004,101:9909 -9914.
[5] Samis K,Bowley S. Pyramiding Mn-superoxide dismutase tranagenes to improve persistence and biomass production in alfalfa[J].J Exp Bot,2002,53(372 ):1343 -1350.
[6] Zeng H C,Deng L H,Zhang C F. Cloning of salt toleran ce-related cDNAs from them angrove plant Sesuvium portulacastrum L.[J].J Integr Plant Biol,2006,48(8):952 -957.
[7] Messeddi D,Sleimi N,Abdelly C. Salt tolerance in Sesuvium portulacastrum[C]∥Horst W J,Schenk M K,Brkert A. Plant Nutrition — Food Security and Sustainability of Agro-ecosystems[M]. Nether lands:Springer Verlag,2001:406 -407.
[8] Kavi K P B,Hong Z L,Miao G H. Overexpression of ⊿1-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants[J]. Plant Physiol,1995,108:1387 -1394.
[9] Inès S,Dorsaf M,Tahar G,et al. Effects of water deficit on growth and proline metabolism in Sesuvium portulacastrum[J]. Environmental and Experimental Botany,2006,56(3):231 -238.
[10] Tahar G,Issam N,Inès S,et al. Cadmium effects on growth and mineral nutrition of two halophytes:Sesuvium portulacastrum and Mesembryanthemum crystallinum[J]. Journal of Plant Physiology,2005,162(10):1133 -1140.
[11] Ramani B,Zorn H,Papenbrock J. Quantification and fatty acid profiles of sulfolipids in two halophytes and a glycophyte grown under different salt concentrations[J]. Zeitschrift Fur naturforschung C-A Journal of Biosciences,2004,59(11 -12):835 -842.
[12] Joshi A J. Aminoacids and mineral constituents in Sesuvium portulacastrum L. a salt marsh halophyte[J]. Aquat Bot,1981,10:69 -74.
[13] Venkatesalu V,Raj K R,Chellappan K P. Sodium chlorides tress on organic constituents of Sesuvium portulacastrum L.,a salt marsh halophyte[J]. J Plant Nutr,1994,17(10):1635 -1645.
[14] Ghnaya T,Nouairi I,SlamaI. Cadmium effects on growth and mineral nutrition of two halophytes:Sesuvium portulacastrum and Mesembryanthemum crystallinum[J]. J plant physiol,2005,1133 -1140.
[15] Slama I,Ghnaya T,Hessini K. Comparative study of the effects of mannitol and PEG osmotic stress on growth and solute accumulation in Sesuvium portulacastrum[J]. Environ Exp Bot,2007,61(1):10 -17.
[16] 范伟,李文静,付桂,等. 一种兼具研究与应用开发价值的盐生植物—海马齿[J].热带亚热带植物学报,2010,18(6):689-695.
[17] Bates L S,Waldren R P,Teare I D. Rapid determination of free proline for water-stress studies[J].Plant and Soil,1973,39(1):205 -207.
[18] Garcia-Rios M,Fujita T,La Rosa P C,et al. Cloning of a polycistronic cDNA from tomato encoding gamma-glutamyl kinase and gamma-glutamyl phosphate reductase[J]. Proc Natl Acad Sci USA,1997,94(15):8249 -8254.
[19] Kim H R,Rho H W,Park J W,et al. Assay of ornithine aminotransferase with ninhydrin[J]. Anal Biochem,1994,223(2):205 -207.
[20] 高俊凤. 植物生理学实验技术[M]. 西安:世界图书出版公司,2000.
[21] Kiyosue T,Yoshiba Y,Yamaguchi-Shinozaki K. A nuclear gene encoding mitochondrial proline dehy-drogenase,an enzyme involved in proline metabolism,is upregulated by proline but downregu-lated by dehydration in Arabidopsis thaliana[J]. Plant Cell,1996,8:1323 -1335.
[22] Voetberg G S,Sharp R E. Growth at the maize primary root at low water potentia. Ⅲ. Role of increased proline deposition in osmotic adjustment[J]. Plant Physiol,1991,96:1125 -1130.
[23] Schwacke R,Grallath S,Breitkreuz K E. LeProT1,a transporter for proline,glycine-betaine and ɣ-aminobutyric acid in tomato pollen. Plant Cell. 1999,11:377 -391.
[24] Hu C A A,Delauney A J,Verma D P S. A bifunctional enzyme(⊿1-pryrroline-5-carboxylate synthestase)catalyzes the first two steps in proline biosynthesis in plants[J]. Proc Natl Acad Sci USA,1992,89:9354 -9358.
[25] Szabados L,Savoure A. Proline a multifunctional amino acid[J].Trends in Plant Science,2009,15(2):89 -97.
[26] Lehmann S,Funk D,Szabados L. Proline metabolism and transport in plant development[J]. Amino Acids,2010,39(4):949-962.
[27] Hervieu F,Le D L,Huaul T C. Contribution of ornithine aminotransferase to proline accumulation inNaCl treated radish cotyledons[J]. Plant Cell Environ,1995,18:205 -210.
[28] Roosens NHCJ,Thu T T,Iskandar H M. Isolation of ornithine—aminotransferase cDNA and effect of salt stress on its expression in Arabidopsis[J]. Plant Physiol,1998,117:263 -271.
[29] 赵福庚,孙诚,刘友良.盐胁迫激活大麦幼苗脯氨酸合成的鸟氨酸途径[J].植物学报,2001,43(1):36 -40.
[30] 余光辉,刘正辉,曾富华,等. 脯氨酸累积与其合成关键酶活性的关系[J].湛江师范学院学报,2002,23(6):57 -60.
[31] Igarashi Y ,Yoshiba Y ,Takeshita T. Molecular cloning and characterization of a cDNA encoding proline transporter in rice[J].Plant Cell Physiol,2000,41:750 -756.
[32] Brugierea N,Duboisb F,Limamia A M.Glutamine synthetase in the phloem plays a major role in controlling proline production[J]. Plant Cell,1999,11:1995 -2012.

