饲料中添加枯草芽孢杆菌对青鱼生长、消化酶活性和鱼体组成的影响
沈斌乾陈建明郭建林潘 茜孙丽慧叶金云
(1. 浙江省淡水水产研究所, 湖州 313001; 2. 湖州师范学院, 湖州 313001)
饲料中添加枯草芽孢杆菌对青鱼生长、消化酶活性和鱼体组成的影响
沈斌乾1陈建明1郭建林1潘 茜1孙丽慧1叶金云2
(1. 浙江省淡水水产研究所, 湖州 313001; 2. 湖州师范学院, 湖州 313001)
用不加枯草芽孢杆菌的对照饲料和分别添加2×106、2×107、2×108和5×108cfu/g枯草芽孢杆菌的4种实验饲料, 分别喂养初始均重为(4.16±0.03) g的5组三重复的青鱼鱼种8周。饲养试验在15只容积为80 L循环式水簇箱内进行, 水温控制为(25±0.5) ℃。结果表明: 饲料中添加枯草芽孢杆菌的实验组青鱼鱼体终重和鱼体增重比不添加的饲料组显著提高, 而饲料系数则显著降低(P<0.05), 不同枯草芽孢杆菌添加量对青鱼鱼体增重和饲料系数均无显著影响(P>0.05)。饲料中添加枯草芽孢杆菌对青鱼的成活率无显著影响(P>0.05)。青鱼摄食添加枯草芽孢杆菌的实验饲料后其肠蛋白酶活性比不添加组显著升高(P<0.05), 并随着枯草芽孢杆菌添加量的增加而显著上升(P<0.05), 但添加量到2×107cfu/g后继续增加则不再显著变化(P>0.05)。青鱼摄食添加枯草芽孢杆菌的实验饲料后, 其肠淀粉酶活性均比不添加组显著升高(P<0.05), 且随枯草芽孢杆菌添加量增大呈不断升高的趋势。青鱼摄食添加2×107、2×108和5×108cfu/g枯草芽孢杆菌的饲料后, 其肝胰脏蛋白酶活性显著高于摄食不添加或添加2×106cfu/g枯草芽孢杆菌的实验组(P<0.05)。青鱼摄食添加枯草芽孢杆菌的实验饲料后, 其肝胰脏淀粉酶、肝胰脏脂肪酶和肠脂肪酶的活性均与不添加的实验组无显著差异(P>0.05)。青鱼鱼种摄食添加枯草芽孢杆菌的饲料与摄食不添加枯草芽孢杆菌的饲料相比, 其全鱼营养组成均无显著差异(P>0.05)。因此, 在实验条件下, 饲料中添加2×106—5×108cfu/g的枯草芽孢杆菌能促进青鱼鱼种的生长和降低饲料系数, 而对鱼体组成没有影响。
枯草芽孢杆菌; 青鱼; 生长; 消化酶活性; 全鱼组成
在养殖鱼类上应用的益生菌是指添加到饲料或应用于养殖水中在一定程度上改善养殖鱼的水环境或肠道内微生物平衡, 从而对寄主产生包括刺激免疫、提高抗病力、降低胁迫反应、改善胃肠道形态、增进食欲、促进生长和饲料利用、改善鱼肉品质等有利影响的微生物细胞[1]。芽孢杆菌属的一些菌种(Bacillus spp.) 因具抗逆性强, 易储存等独特的生物学特性而受到人们广泛的关注, 是水产养殖中研究和使用较多的一类益生菌。而且, 枯草芽孢杆菌(B. subtilis)和地衣芽孢杆菌 (B. licheniformis)已在我国得到批准可用作饲料添加剂。枯草芽孢杆菌制剂添加到一些鱼虾饲料的应用试验表明, 饲料中添加芽孢杆菌能改变那些鱼虾肠道内细菌群落, 显著提高消化酶的活性和非特异性免疫反应, 促进生长[2—8]。但有关枯草芽孢杆菌在青鱼饲料中的应用尚未见报道。本研究通过在饲料中添加枯草芽孢杆菌开展青鱼饲养实验, 以期评估饲料中枯草芽孢杆菌对青鱼生长性能、消化酶活性和鱼体组成的影响,为青鱼饲料中合理应用枯草芽孢杆菌提供理论依据。
1 材料与方法
1.1 芽孢杆菌制剂
实验用芽孢杆菌制剂是由本所鱼病室从水产养殖土壤中分离获得的枯草芽孢杆菌B115菌株, 经30℃、180 r/min振荡培养后的菌液。使用前用平板计数法测定制剂中细菌数量。
1.2 实验饲料
以褐鱼粉、豆粕、菜籽粕和面粉等为主要原料配制基础饲料, 其配方的原料组成(表1)。在基础配方的基础上, 分别加入0、2×106、2×107、2×108和5× 108cfu/g的枯草芽孢杆菌配制5种实验用饲料。饲料制作时, 先将原料粉碎, 使原料粉末能全部通过孔径为0.355 mm试验筛, 按配方比例称取各原料置于盆内混合均匀, 加入适量的水或枯草芽孢杆菌与水混合物, 再次充分混匀后, 用绞肉机制成直径约为1.2 mm的面条状饲料, 在室温下风干后制成颗粒, 在4℃下保存备用。各饲料的营养成分分析结果(表2)。

表1 基础饲料原料组成(%干饲料)Tab. 1 Formulation of basal diet (% dry diet)

表2 实验饲料的营养成分分析(%干饲料)Tab. 2 Nutritional facts of the test diets (% dry diet)
1.3 实验鱼
实验鱼种取自本所实验鱼场同一培育池的当年鱼种, 平均尾重(4.16±0.03) g。实验前于水泥池用基础饲料驯养二周后随机分养到5组各3个重复的15只水族箱, 每箱放鱼25尾。
1.4 饲养方法与水质
实验鱼饲养在容积为80L循环式水簇箱中。每只水簇箱各配一气石, 连续充气。每天9:00和15:00各投饲一次, 每次均用人工投喂至接近饱食, 日投饲料量约占鱼体重的3%。饲养实验持续8周。饲养期间, 水温(25±0.5)℃; 水质: pH 7.1—7.3、DO 4.19—5.68 mg/L、NH3-N 0.13—0.21 mg/L、NO2-N 0.06—0.08mg/L; NO3-N 0.13—0.25 mg/L。实验期间光照时间用日光灯进行控制, 黑夜∶白昼为12h∶12h。
1.5 取样与分析
饲养实验完成后饥饿1d, 每箱取5尾实验鱼为一混合样, 供营养组成测定。饲料和全鱼营养成分测定方法为: 105℃常压干燥法测定水分; 微量凯氏定氮法测定粗蛋白; 用无水乙醚为溶剂, 索氏抽提法测定粗脂肪; 箱式电阻炉550℃灼烧法测定粗灰分。上述测定步骤均参照AOCO的方法进行[9]。
取饲养实验结束后饥饿1d后的实验鱼, 置冰盘上解剖, 取出全部肝胰脏和消化道, 剔除脂肪和消化道内容物, 分别取肝胰脏和肠(每一水簇箱5尾实验鱼为一混合样), 用滤纸吸干水分后称重, 加入10倍的PBS溶液, 用玻璃匀浆器在冰浴中手工匀浆。随后在4℃、10000r/min离心10min, 获得的上清液即为粗酶液, 并置于4℃冰箱中待用。蛋白酶活性测定采用福林试剂法[10]。蛋白酶活性单位定义为: 在pH 7.5、37℃条件下, 每分钟酶解酪蛋白生成1 μg酪氨酸为1个活性单位(U)。蛋白酶活性以U/mg粗酶蛋白表示。淀粉酶活力测定采用Benfeld法[11]。淀粉酶活性单位定义为: 在pH 6.9、25℃条件下,每分钟酶解可溶性淀粉生成1 μmol麦芽糖为1个活性单位(U)。淀粉酶活性以U/mg粗酶蛋白表示。脂肪酶活性采用组织脂肪酶的测定试剂盒方法(南京建成)。脂肪酶活性单位定义: 在37℃条件下, 每分钟酶解1 μmol底物为1个活力单位(U)。脂肪酶活性以U/g粗酶蛋白表示。粗酶液中蛋白浓度用考马斯亮蓝法测定[12]。以牛血清白蛋白为基准物。
1.6 数理统计方法
试验数据以均值±标准误(Mean±SE)表示。用SPSS11.5软件进行单因子方差分析(One-way ANOVA), 以检验不同实验组间各指标平均值是否存在显著性差异。如有显著差异(P<0.05), 则作Duncan多重比较分析。
2 结果
2.1 鱼体生长情况
青鱼鱼种摄食不同饲料8周后的鱼体生长情况(表3)。从表3可见, 在饲料中添加2×106—5×108cfu/g的枯草芽孢杆菌, 青鱼的鱼体终重和鱼体增重比不添加的饲料组显著提高, 而饲料系数则显著降低(P<0.05), 而不同枯草芽孢杆菌添加量对青鱼的生长和饲料系数无显著影响(P>0.05)。在饲料中添加枯草芽孢杆菌对青鱼的成活率无显著影响(P>0.05)。
2.2 肠和肝胰脏消化酶活性
青鱼鱼种摄食不同饲料8周后的肠和肝胰脏消化酶活性测定结果(表4)。青鱼摄食添加枯草芽孢杆菌的试验饲料后其肠蛋白酶活性比不添加组显著升高(P<0.05), 并随着枯草芽孢杆菌添加量的增加而不断上升(P<0.05), 但添加量到2×107cfu/g后继续增加则不再显著变化(P>0.05)。青鱼摄食添加2×106—5×108cfu/g的枯草芽孢杆菌的实验饲料后,其肠淀粉酶活性均比不添加组显著升高(P<0.05),且随枯草芽孢杆菌添加量的增大呈不断升高的趋势。青鱼摄食添加2×107、2×108和5×108cfu/g枯草芽孢杆菌的饲料后, 其肝胰脏蛋白酶活性显著高于摄食不添加或添加2×106cfu/g枯草芽孢杆菌的实验组(P<0.05)。青鱼摄食添加枯草芽孢杆菌实验饲料后, 其肝胰脏淀粉酶、肠脂肪酶和肝胰脏脂肪酶的活性均与摄食不添加枯草芽孢杆菌实验组无显著差异(P>0.05)。

表3 青鱼鱼种摄食不同饲料8周后的鱼体生长情况Tab. 3 Growth performance of juvenile black carp fed test diets for 8 weeks
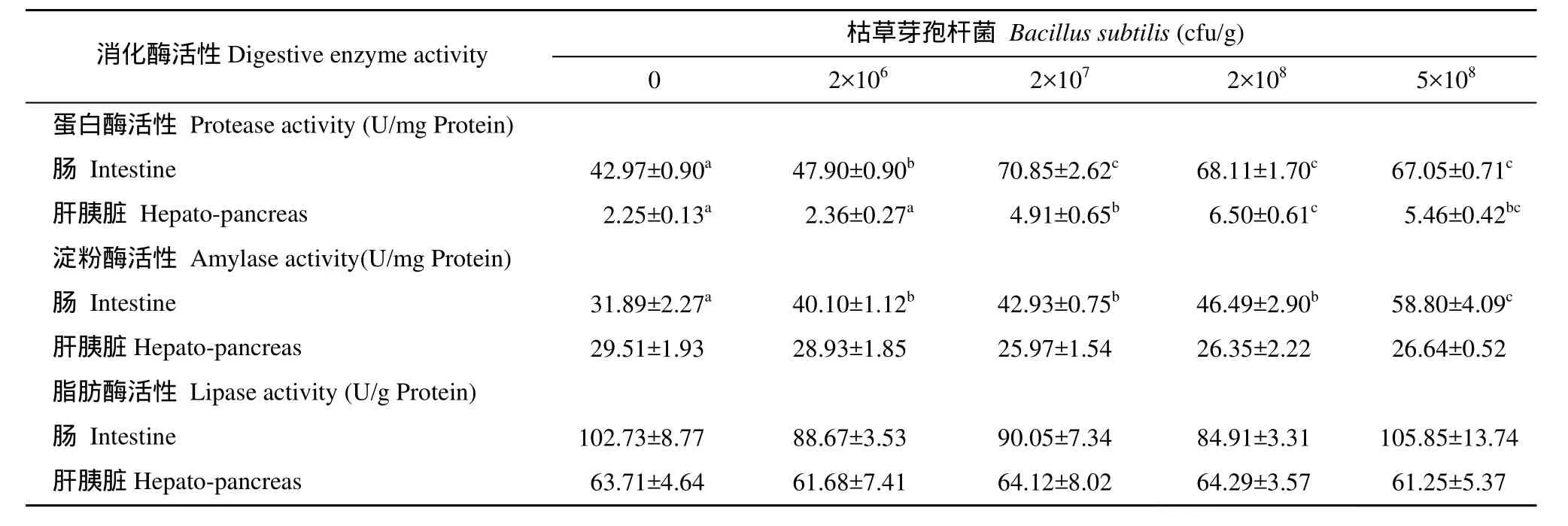
表4 青鱼鱼种摄食不同饲料8周后的肠和肝胰脏消化酶活性Tab. 4 Intestine and hepato-pancreas digestive enzyme activity of juvenile black carp fed test diets for 8 weeks
2.3 全鱼体组成
青鱼鱼种摄食不同饲料8周后的全鱼体组成分析结果(表5)。从表中可见, 青鱼鱼种摄食添加不同剂量的枯草芽孢杆菌的饲料与摄食不添加枯草芽孢杆菌的饲料相比, 其全鱼水分、粗蛋白、粗脂肪和粗灰分含量均无显著差异(P>0.05)。
3 讨论
在饲料中添加一定剂量的枯草芽孢杆菌后, 能促进幼鱼、虾生长已有一定的报道。15 g的印度鲤(Labeo rohita)摄食添加0.5×107—1.5×107cfu/g的枯草芽孢杆菌的实验饲料2周后鱼体增重明显高于对照组[3]。65 g的尼罗罗非鱼(Oreochriomis niloticus)摄食添加1×107cfu/g的枯草芽孢杆菌的实验饲料1个月和2个月后鱼体增重均高于对照组[4]。7.82 g的大黄鱼(Larimichthys crocea)摄食添加1.35×107cfu/g的枯草芽孢杆菌的实验饲料10周后特定生长率显著高于对照组[5]。2.11 g 的凡纳滨对虾(Litopenaeus vannamei) 摄食添加1×104—5×104cfu/g的枯草芽孢杆菌的实验饲料40d后生长加快[6]。0.67 g的凡纳滨对虾摄食添加6×106—6×107cfu/g的枯草芽孢杆菌的实验饲料58d后生长加快[7]。34.5 g的奥尼罗非鱼(O. niloticus×O. aureus)摄食添加3.0×108cfu/g的枯草芽孢杆菌的实验饲料56d后鱼体增重率显著高于对照组[8]。本实验结果也表明, 青鱼摄食添加2×106—5×108cfu/g枯草芽孢杆菌的饲料后生长加快, 与上述报道相同。从本实验结果来看, 在饲料中枯草芽孢杆菌添加最低剂量为2×106cfu/g时即表现出较好的促生长作用, 而且提高添加剂量并不能使鱼的生长进一步改善, 但更低的添加剂量是否也能促进青鱼生长仍有待实验验证。
研究表明, 在饲料中添加枯草芽孢杆菌可以提高鱼类消化酶的活性。翘嘴鲌、异育银鲫和日本沼虾摄食添加2×107cfu/g枯草芽孢杆菌的饲料后, 肠蛋白酶、脂肪酶和淀粉酶的活性均有所提高[2]。在本实验中, 青鱼摄食添加枯草芽孢杆菌的饲料后肠蛋白酶和淀粉酶的活性均显著提高, 与上述的结果类似, 但肠脂肪酶活性并未见提高, 与之略有不同。这种差异可能是因为实验条件不尽相同所致。在对芽孢杆菌属的其他菌株研究中, 不同研究者所报告饲用含不同菌株或用不同养殖品种作试验对象, 对不同消化酶活性的影响程度也不完全一致。刘波等[13]报道摄食添加4×107—6×107cfu/g的地衣芽孢杆菌的饲料后, 异育银鲫肠道组织蛋白酶活性显著提高。Wang & Xu报道[14], 在基础饲料中添加1×107cfu/g的芽孢杆菌(Bacillus spp.)饲养6.5 g的鲤鱼(Cyprinus carpio) 60d, 肠蛋白酶、淀粉酶和脂肪酶均显著提高。付天玺等[15]报道, 用添加1×108—6×108cfu/g的凝结芽孢杆菌(B. coagulans)的饲料, 饲养34.5 g的奥尼罗非鱼胃和肠蛋白酶均显著提高, 而对胃和肠的淀粉酶和脂肪酶无影响。江永明等[8]也报道摄食添加3.0×108cfu/g的枯草芽孢杆菌和凝结芽孢杆菌的实验饲料后, 奥尼罗非鱼肠道、肝胰脏和胃蛋白酶活性显著提高, 而对肠道、肝胰脏及胃的淀粉酶和脂肪酶没有影响。
在有关饲料中添加芽孢杆菌对鱼体成分的影响在不同的研究得到的结论并不一致。在本实验中青鱼的全鱼营养组成不受饲料中添加的枯草芽孢杆菌影响, 与Merrifield, et al.[16]报道69 g的虹鳟鱼在摄食添加107.75cfu/g的枯草芽孢杆菌和地衣芽孢杆菌混合菌的饲料10周后胴体成分不受影响的结果相一致。但其他的两项研究却有不同的观察。王彦波[17]认为在基础饲料中添加5×106—1×107cfu/g的凝结芽孢杆菌, 饲养34.1 g的罗非鱼(Oreochriomis spp.)与不添加组相比其肌肉中粗脂肪含量显著降低, 肌肉中粗蛋白、粗灰分和水分含量没有显著变化。Bagheri, et al.[18]报道虹鳟鱼苗摄添加1.8×106—6.1×109cfu/g的芽孢杆菌的饲料2个月后胴体脂肪随饲料中芽孢杆菌添加量的上升而不断下降, 胴体蛋白和水分含量也受到一定程度的影响。这可能是因芽孢杆菌的菌株和剂量不同、养殖对象不同或生长阶段不同而造成对鱼体成分影响程度存在差异。

表5 青鱼鱼种摄食不同饲料8周后的全鱼体组成Tab. 5 Whole fish body composition of juvenile black carp fed test diets for 8 weeks
综上所述, 在本实验条件下, 青鱼鱼种饲料添加2×106—5×108cfu/g枯草芽孢杆菌, 能使肠蛋白酶和淀粉酶活性提高, 促进鱼体生长, 降低饲料系数,但不影响全鱼组成。
[1] Merrifield D L, Dimutroglou A, Foey A, et al. The current status and future focus of probiotic and prebiotic application for salmonids [J]. Aquaculture, 2010, 302(1-2): 1—18
[2] Shen W Y, Fu L L, Li W F. Effect of Bacillus subtilis expressed the white spot syndrome virus envelope protein VP28 on immune response and disease resistance in Penaeus vannamei [J]. Acta Hydrobiologica Sinica, 2012, 36(2): 375—378 [沈文英, 傅玲琳, 李卫芬. 枯草芽孢杆菌表达的VP28 对南美白对虾免疫力和抗病毒感染的影响. 水生生物学报, 2012, 36(2): 375—378]
[3] Kummar R, Mukherjee S C, Prasad K P, et al. Evaluation of Bacillus subtilis as a probiotic to Indian major carp Labeo rohita [J]. Aquaculture Research, 2006, 37(12): 1215—1221
[4] Aly S M, Ahmed Y A G, Aharrrb A A A, et al. Studies on Bacillus subtilis and Lactobacillus acidophilus, as potential probiotics, on immune response and resistance of tilapia nilotica (Oreochriomis nilotics) to challenge infections [J]. Fish & Shellfish Immunology, 2008, 25(1—2): 128—136
[5] Ai Q, Xu H, Mai K, et al. Effect of dietary supplementation of Bacillus subtilis and fructooligosaccharide on growth performance, survival, non-specific immune response and disease resistance of juvenile yellow croaker, Larimichthys crocea [J]. Aquaculture, 2011, 317(1—4): 155—161
[6] Shen W Y, Fu L L, Li W F, et al. Effect of dietary supplementation with Bacillus subtilis on the growth, performance, immune response and antioxidant activities of the shrimps (Litopenaeus vannamei) [J]. Aquaculture Research, 2010, 41(11): 1691—1698
[7] Ding X, Li Z J, Chen Y Q, et al. Effect of probiotics on growth and activities of digestive enzymes of Penaeus vannamei [J]. Journal of Fisheries Science of China, 2004, 11(6): 580—584 [丁贤, 李卓佳, 陈永青, 等. 芽孢杆菌对凡纳对虾生长和消化酶活性的影响. 中国水产科学, 2004, 11(6): 580—584]
[8] Jiang Y M, Fu T X, Zhang L, et al. Effects of feeding microorganisms on growth performance and the activities digestive enzymes of Oreochromis niloticus×O. aureus [J]. Acta Hydrobiologica Sinica, 2011, 36(6): 998—1004 [江永明, 付天玺, 张丽, 等. 微生物制剂对奥尼罗非鱼生长及消化酶活性的影响. 水生生物学报, 2011, 36(6): 998—1004]
[9] AOAC (Association of Official Analytical Chemists). Official Methods of Analysis [M]. 14th edn, Washington. 1984, 152—163
[10] Guideline for Biochemistry Technology [M]. Edited by Laboratory of Biochemistry and Microbiology, Department of Biology, Sun Yat-sen University, People’s Education Press. 1979, 52—56 [中山大学生物系生化微生物教研室编.生化技术导论. 北京: 人民教育出版社. 1979, 52—56]
[11] Bernfeld, P. Amylases α and β: Colorimetric Assay Method [M]. Methods in Enzymology. In: Colowick S P, Kaplan N O (Eds.), New York Academy Press Inc. 1955, 149—158
[12] Bradford M M. A rapid and sensitive method for quantification of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72: 248—254
[13] Liu B, Liu W B, Wang T. Effects of Bacillus licheniformis on digestive performance and growth of allogynogenetic crucian [J]. Journal of Nanjing Agricultural University, 2005, 28(4): 80—84 [刘波, 刘文斌, 王恬. 地衣芽孢杆菌对异育银鲫消化机能和生长的影响. 南京农业大学学报, 2005, 28(4): 80—84]
[14] Wang Y, Xu Z. Effect of probiotics for common carp (Cyprinus carpio) based on growth performance and digestive enzyme activities [J]. Animal Feed Science and Technology, 2006, 127: 283—292
[15] Fu T X, Xu G H, Wu Y C, et al. Effects of Bacillus coagulans on digestive enzyme activities, digestibility and growth performance of hybird tilapia (Oreochromis niloticus×O. aureus) [J]. Freshwater Fisheries, 2008, 38(4): 30—35 [付天玺, 许国焕, 吴月嫦, 等. 凝结芽孢杆菌对奥尼罗非鱼消化酶活性、消化率及生长性能的影响. 淡水渔业, 2008, 38(4): 30—35]
[16] Merrifield D L, Dimutroglou A, Bradley G, et al. Probiotic applications for rainbow trout Ι. Effects on growth performance, feed utilization, intestinal microbiota and related health criteria [J]. Aquaculture, 2010, 16(5): 504—510
[17] Wang Y B. Effect of probiotic, B. coagulans on growth performance and muscle nutritional composition of Tilapia, Oreochromis niloticus [J]. Feed Industry, 2010, 1(suppl.): 74—77 [王彦波. 益生菌B. coagulans对罗非鱼生长性能和肌肉营养成分的影响研究. 饲料工业, 2010, 1(增刊): 74—77]
[18] Bagheri T, Hedayati S A, Yavari V, et al. Growth, survival and gut microbial load of rainbow trout fry given diet supplemented with probiotic during the two months of first feeding [J]. Turkish Journal of Fisheries and Aquatic Science, 2008, 8(1): 43—48
EFFECT OF ADDING BACILLUS SUBTILIS TO DIETS ON GROWTH PERFORMANCE, DIGESTIVE ENZYMES ACTIVITY AND BODY COMPOSITION OF FINGERLING BLACK CARP (MYLOPHARYNGODON PICEUS)
SHEN Bin-Qian1, CHEN Jian-Ming1, GUO Jian-Lin1, PAN Qian1, SUN Li-Hui1and YE Jin-Yun2
(1. Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, China; 2. Huzhou Teachers Collage, Huzhou 313001, China)
A basal diet without adding Bacillus subtilis and four test diets containing 2×106, 2×107, 2×108and 5×108cfu/g of the B. subtilis were prepared to feed five groups of fish in triplicate with an initial average body weight of (4.16±0.03) g respectively. The feeding experiment was conducted in 15 re-circulating tank systems (80 L each) at a controlled water temperature of (25±0.5)℃ for eight weeks. The results showed that the weight gain of fish fed diets with B. subtilis increased significantly compared to that of fish fed the basal diet (P<0.05), and the feed conversion ratio(FCR) reduced significantly (P<0.05). However, weight gains and FCR of fish fed diets containing different levels of B. subtilis showed no significant difference (P>0.05). Survival rates were not affected by adding B. subtilis to diets (P>0.05). Intestine protease activities of fish fed diets with B. subtilis were higher than that of fish fed the basal diet (P<0.05), and intestine protease activity increased with the increasing level of B. subtilis supplement up to 2×107cfu/g, but above this level, it appeared to keep stable. The intestine amylase activity of fish fed diets with B. subtilis increased significantly (P < 0.05), and higher level of B. subtilis supplementing appeared to have higher activity. Fish fed diets with 2×107, 2×108and 5×108cfu/g B. subtilis had higher hepato-pancreas protease activities than those of fish fed the basal diet and a diet with 2×106cfu/g of B. subtilis. While the hepato-pancreas amylase activity, hepato-pancreas and intestine lipase activity were not affected significantly by dietary adding of B. subtilis (P>0.05), the body composition was not affected either. In conclusion, under the condition of this experiment, adding 2×106—5×108cfu/g B. subtilis to fingerling black carp diet could improve fish growth and feed conversion without affecting the body composition.
Bacillus subtilis; Black carp (Mylopharyngodon piceus); Growth; Digestive enzyme activity; Body composition
S963.73
A
1000-3207(2013)01-0048-06
10.7541/2013.48
2011-11-14;
2012-10-19
现代农业产业体系专项(CARS-46-21); 湖州市水产养殖创新团队计划(2010KC02)资助
沈斌乾(1983—), 男, 浙江湖州人; 农学学士; 主要从事水产养殖与鱼类饲料营养研究。E-mail: alsbq7@163.com
陈建明(1965—), 男, 浙江湖州人; 农学学士; 主要从事水产养殖与鱼类饲料营养研究。E-mail: aqua_labjm@yahoo.com.cn

