Gja5基因表达对小鼠下肢新生动脉生成影响机制的研究
王海涛 严志焜 许林海 胡志斌 潘晓华
Gja5基因表达对小鼠下肢新生动脉生成影响机制的研究
王海涛 严志焜 许林海 胡志斌 潘晓华
目的 研究Gja5基因表达在小鼠下肢新生动脉生成中的保护作用。方法 将168只Gja5基因敲除小鼠分为CX40基因敲除实验组(Gja5-/-组),CX40杂合子组(Gja5+/-组)和对照组野生型小鼠(Gja5+/+组)3组,每组56只。另选择增强型绿色荧光蛋白(EGFP)标记的Gja5基因小鼠20只。在荧光显微镜下观察EGFP标记的Gja5基因在小鼠动脉的表达,建立小鼠下肢股动脉闭塞模型,应用激光多普勒血流仪(LDF)动态监测股动脉结扎术前,术后当天及术后1、3、7、14、21d下肢缺血区域的血流恢复情况,同时使用RT-PCR法检测Gja5基因在小鼠下肢腓肠肌的表达。结果 EGFP标记的Gja5基因(CX40基因)表达在小鼠的脑动脉和股动脉上。在股动脉结扎术后1、3、7、14、21d,Gja5-/-组小鼠的患肢血供较Gja5+/+组明显减少。在股动脉结扎术后3d时,Gja5基因在小鼠下肢腓肠肌的表达升高了约4倍,术后7d时逐渐回到基线水平。 结论 Gja5基因表达在小鼠下肢新生动脉生成中发挥了重要的保护作用。
Gja5 基因 小鼠 下肢 新生动脉生成
缺血性心血管疾病是目前发达国家及众多发展中国家中成人最常见的死因之一[1],所以新生动脉生成和修复机制的研究对于缺血性心血管疾病具有重大意义。促进代偿性血管重建是富有前景的治疗新策略[2]。缝隙连接(GJ)是含有多种细胞间通道的特殊膜结构,容许离子、小分子代谢产物、第二信使等通过,是调节血管功能的一种关键因子[3-4]。GJ参与细胞间物质交换的代谢偶联和电信号传递的电偶联,进行细胞间信息传递(GJIC),在细胞的生长、分化、生理功能的调节中发挥作用[5-6]。体内研究证实Gja5基因作为组成的跨物种和血管床的缝隙连接蛋白CX40,在血管壁细胞之间的耦合链接中发挥重要的作用,但Gja5基因缝隙连接蛋白CX40的具体调控机制尚不知晓[7]。本研究通过荧光显微镜下观察增强型绿色荧光蛋白(EGFP)标记的Gja5基因在小鼠动脉的表达,研究其在小鼠下肢新生动脉生成中的保护作用,现报道如下。
1 材料和方法
1.1 实验动物分组及模型建立
1.1.1 实验动物 所有实验小鼠均来自于德国MDC生物医学中心,清洁级。体重25~35(28.35±0.81)g,雌雄不拘;无人畜共患疾病,共188只。其中Gja5基因敲除小鼠(Gja5基因敲除组)168只,Gja5 EGFP小鼠(CX40 EGFP组)20只。将Gja5基因敲除组小鼠分为3个亚组:CX40基因敲除实验组(Gja5-/-组),CX40杂合子组(Gja5+/-组)和对照组野生型小鼠(Gja5+/+组),每组56只。1.1.2 建立小鼠下肢股动脉闭塞模型(血流驱动的新生动脉生成动物模型)(1)麻醉:采用氯胺酮100mg/kg(100mg/ml)和甲苯噻嗪10mg/kg(20mg/ml)行腹腔注射麻醉,麻醉完成后小鼠平卧在操作台上,局部温度保持37℃,双足采用胶布固定,双眼使用眼药膏保护。(2)手术:小鼠右腹股沟手术区使用脱毛霜脱毛,70%乙醇消毒。平行股动静脉方向行皮肤切口0.5cm,确定股神经,股动脉和股静脉血管神经束。暴露股动脉、股静脉和股神经,并小心分离。根据Hoefer[8]的方法双重结扎股动脉。多数情况下的近端旋股动脉和侧尾鳍股动脉紧密相连。于这两个分支的近端第1次结扎,两个分支远端第2次结扎。在第2次结扎点远端位置,股动脉分为隐动脉和腘动脉,最后缝合手术切口(图1)。

图1 小鼠手术示意图
1.2 方法
1.2.1 激光多普勒血流成像技术(LDF)评估血流灌注情况 采用英国Moor设备有限公司的MoorLDI2-HR高分辨率成像仪。股动脉被结扎后,采用非侵入性的LDF动态监测下肢缺血区域的血流恢复情况。其中多普勒信号与皮肤上直径为200~300μm的血管内血流灌注量成正比。比较对侧(非结扎侧)的肢体,研究区域组织灌注的量化,显示为彩色编码的图像。结合肢体灌注的其他测量措施,从足部获得相关的彩色编码的图像。小鼠被麻醉后,应用LDF动态监测并记录股动脉结扎术前、术后当天及术后1、3、7、14、21d下肢缺血区域的血流灌注量。血流灌注量的单位以PU表示。
1.2.2 Real-time RT-PCR检测 在股动脉结扎术后7d,以颈椎脱臼法处死Gja5+/+组和Gja5+/-组小鼠各8只,从股动脉结扎侧和非结扎侧的大腿和下肢剥离皮肤和筋膜,分离和切除腓肠肌,立即冷冻在液氮中并储存于-80℃冰箱。采用Trizol试剂提取腓肠肌的总RNA。基于德国BioTez有限责任公司生产的TaqMan探针,开始进行Real-time RT-PCR检测。并根据使用说明书,通过TaqMan基因表达MasterMix序列检测系统进行实时PCR扩增反应。PCR扩增反应被重复测试3次。甘油磷酸盐脱氢酶被正常化后,计算mRNA的相对值。采用Primer Express 2.0软件设计引物和探针序列。
1.2.3 Real-time RT-PCR检测 Gja5小鼠实时RTPCR法(5′to 3)正向引物:CAGCCTGGCTGAACTCTACCA。反向引物:CTGCCGTGACTTGCCAAAG。Taq-Man探针:CGCTGTCGGATCTTCTTCCAGCCCAG。Gja5基因敲除小鼠基因型引物(5′to 3)正向引物:TGGAGCCACAGTTGCAATGGT。反向引物(Gja5-/-组):TCTCTGACTCCGAAAGGCAG。反向引物(Gja5-/-组):GCACGAGACTAGTGAGACGTG。
1.3 统计学处理 采用SPSS13.0统计软件。正态分布的计量资料以表示。Gja5-/-组和Gja5+/+组的组间比较、Gja5+/-组和Gja5+/+组的组间比较采用t检验。
2 结果
2.1 Gja5基因的表达 Gja5基因在小鼠的脑动脉Willis环上(图2)和在小鼠的股动脉上(图3)的表达。
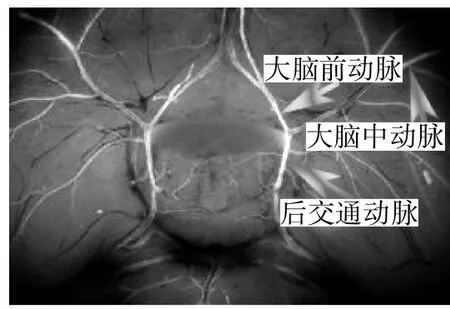
图2 Gja5基因在小鼠的脑动脉Willis环上的表达

图3 Gja5基因在小鼠的股动脉上的表达
2.3 Gja5+/+组、Gja5-/-组及Gja5+/-组 3组间通过LDF成像比较下肢缺血区域的血流灌注量,结果见表1。3组术后3d和7d下肢缺血区域的血流灌注图像,见图4、5。
由表1可见,在股动脉结扎术前,Gja5+/+,Gja5+/-及Gja5-/-3组之间的患肢血供差异无统计学意义(均P>0.05);在股动脉结扎术后1、3、7、14、21d,Gja5+/+组与Gja5-/-组比较,小鼠的患肢血供恢复差异均有统计学意义(均P<0.05),而Gja5+/+组和Gja5+/-组比较,小鼠的患肢血供恢复差异均无统计学意义(均P>0.05)。
2.4 Gja5基因在小鼠下肢腓肠肌的表达 Gja5基因在小鼠下肢腓肠肌的表达显示为结扎侧/非结扎侧的比值。在股动脉结扎术后3d,Gja5基因在Gja5+/+和Gja5+/-两组间腓肠肌的表达均升高了约4倍(4.015±0.036,4.241±0.125),股动脉结扎术后7d,其表达均逐渐回到基线水平(1.0)。Gja5+/+和Gja5+/-两组的Gja5基因在小鼠下肢腓肠肌的表达差异无统计学意义(P>0.05)。

表1 3组通过LDF成像比较下肢缺血区域的血流灌注量(PU)

图4 股动脉结扎术后3d各组LDF灌注图像
图5 股动脉结扎术后7d各组LDF灌注图像
3 讨论
当前冠心病的治疗仍依赖各类药物扩张血管,此种方法不能阻断病程的发展,最后往往不得不施行血管再通或旁路搭桥手术。由于再通后的冠状动脉及移植的旁路血管易再次阻塞且不适于病变广泛的病例,所以这类手术的应用受到一定的限制。外周血管栓塞性疾病如血栓闭塞性脉管炎由于缺乏有效的治疗方法,使很多患者付出了截肢的代价。血管重建包括血管发生、血管新生及动脉生成,是机体在血管闭塞状态下的病理生理性代偿反应。以改善缺血为目的,应用促血管因子、基因治疗和血管祖细胞补充治疗已成为当前缺血性血管疾病治疗的研究热点[9-10]。动脉生成是指由于动脉阻塞,血流再分配使侧支微动脉血流量增加、血管内剪切力增加,引起细胞增殖、血管重塑,从而形成大的有功能的侧支动脉的过程,所形成的动脉能够有效地恢复动脉阻塞所致缺血区的血液供应[11-15]。侧支动脉生成比血管新生更重要,促进侧支动脉生成,恢复缺血区的血液供应及改善组织细胞的氧和营养物质供给,能够全面的治疗缺血性血管疾病,它将成为缺血性血管疾病治疗的发展方向[16]。
GJ是含有多种细胞间通道的特殊膜结构,每个GJ由来自相邻细胞膜上的2个缝隙连接半通道,也称为连接子组成,每个连接子由6个连接蛋白分子构成6聚体蛋白质,中间包绕水相孔道,形成一个在相邻细胞浆可进行离子和小分子物质交换的孔道和低阻的电冲动通道[17]。GJ在血管发育和血管功能中发挥了多方面的作用,也参与了神经发生和血管生成[18]。
为了证实Gja5基因在新生动脉形成中的调节作用,我们使用Gja5基因突变小鼠,并建立血流驱动的新生动脉形成模型,股动脉闭塞模型[8]。在一个特定的位点结扎股动脉,从而触发了结扎点近端小的且预先存在的侧支动脉转化成有功能的新生动脉,以及远端的缺血性血管新生。下肢缺血后的血管反应,可以很容易地被LDF和新生动脉形成的组织学的指标来评估。本研究中,通过荧光显微镜观察EGFP标记的Gja5基因在小鼠动脉的表达。使用Gja5 EGFP小鼠,我们可以发现Gja5基因表达在小鼠的脑动脉Willis环和股动脉上。通过LDF检测,我们发现在股动脉结扎术后1~21d,Gja5+/+组和Gja5-/-组小鼠的患肢血供恢复的差异有统计学意义,而Gja5+/+组和Gja5+/-组小鼠的患肢血供恢复差异无统计学意义。从而认为Gja5基因在新生动脉生成中发挥了重要的调节功能,可作为动脉标记物。在股动脉结扎术后3d,Gja5基因在腓肠肌的表达升高了4倍,股动脉结扎术后7d,在缺血后肢,无论是在Gja5+/-小鼠和Gja5+/+小鼠,其表达水平均逐渐恢复到基线水平。有趣的是,Pipp等[19]在猪的缺血后肢新生动脉生成模型中发现非常高的流体切应力(FSS)水平和丰富的侧支循环,从而表明了FSS的重要性,通常情况下,在以后各阶段的动脉生成中,随着新生动脉的直径增大,FSS逐渐下降至正常水平,可防止新生动脉直径进一步增长,从而达到最佳适应。Pipp等[19]发现,在他们的动静脉分流模型中,进一步持续升高FSS,可显著增加新生动脉的直径大小,由此,我们可以发现,Gja5基因表达在股动脉闭塞模型上的变化趋势与FSS在动脉生成上的变化趋势是相同的,从而确立了FSS是新生动脉生成的激发因素。因此,我们认为,Gja5在新生动脉生成中发挥了重要的职能作用,但需要进一步的研究股动脉闭塞后Gja5表达和FSS变化之间的关系。另外Gja5表达在动脉内皮细胞介导的血管舒张反应可能影响到患肢灌注减少。因此,要研究这个功能的参与,我们也需要进一步研究在小鼠动脉内皮细胞特异性的基因敲除Gja5基因的表达。Gja5在新生动脉生成中发挥了重要的调节功能,可作为动脉标记物。
[1]Hamawy A H,Lee L Y,Crystal R G,et al.Cardiac angiogenesis and gene therapy:a strategy for myocardial revascularization[J].Curr Opin Cardio1,1999,14(6):515-522.
[2]Prior B M,Yang H T,Terjung R L,et al.What makes vessels grow with exercise training[J]?J Appl Physiol,2004,97(3):1119-1128.
[3]Haefliger J A,Nicod P,Meda P.Contribution of connexins to the function of the vascular wall[J].Cardiovasc Res,2004,62(2):345-356.
[4]Ross R.Cell biology of atherosclerosis[J].Annu Rev Physiol,1995, 57:791-804.
[5]Lodish H F,Rodriguez R K,Klionsky D J.Points of view:lectures: can't learn with them,can't learn without them[J].Cell Biol Educ, 2004,3(4):202-211.
[6]Sohl G K.Willecke.Gap junctions and the connexin protein family[J].Cardiovasc Res,2004,62(2):228-232.
[7]Miquerol L,Meysen S,Mangoni M,et al.Architectural and functional asymmetry of the His-Purkinje system of the murine heart [J].Cardiovasc Res,2004,63(1):77-86.
[8]Hoefer I E,van Royen N,Rectenwald J E,et al.Arteriogenesis proceedsvia ICAM-1/Mac-1-mediatedmechanisms[J].Circ Res, 2004,94(9):1179-1185.
[9]Carmeliet P.Mechanisms of angiogenesis and arteriogenesis[J].Nat Med,2000,6(4):389-395.
[10]Adams R H,Alitalo.Molecular regulation of angiogenesis and lymphangiogenesis[J].Nat Rev Mol Cell Biol,2007,8(6):464-478.
[11]Van Oostrom M C,van Oostrom O,Quax P H,et al.Insights into mechanisms behind arteriogenesis:what does the future hold [J]?J Leukoc Biol,2008,84(6):1379-1391.
[12]Buschmann I,Schaper W.The pathophysiology of the collareral circulation(arteriogenesis)[J].J Patho1,2000,190(3):338-342.
[13]Schaper W.Collateral circulation:past and present[J].Basic Res Cardiol,2009,104(1):5-21.
[14]Heil M,Schaper W.Influence of mechanical,cellular,and molecular factors on collateral artery growth(arteriogenesis)[J].Circ Res,2004,95(5):449-458.
[15]Heil M,Eitenmuller I,Schmitz-Rixen T,et al.Arteriogenesis versus angiogenesis:similarities and differences[J].J Cell Mol Med, 2006,10(1):45-55.
[16]Buschmann I,Schaper W.Arteriogenesis Versus Angiogenesis: Two Mechanisms of Vessel Growth[J].News Physiol Sci,1999,14: 121-125.
[17]Kwak B R,Pepper M S,Gros D B,et al.Inhibition of endothelial wound repair by dominant negative connexin inhibitors[J].Mol Biol Cell,2001,12(4):831-845.
[18]Carmeliet P,Tessier-Lavigne M.Common mechanisms of nerve and blood vessel wiring[J].Nature,2005,436(7048):193-200.
[19]Pipp F,Boehm S,Cai W J,et al.Elevated fluid shear stress enhances postocclusive collateral artery growth and gene expression in the pig hindlimb[J].Arterioscler Thromb Vasc Biol, 2004,24(9):1664-1668.
Relationship between Gja5 gene expression and arteriogenesis in mouse hindlimb
Objective To investigate the relationship between the gene expression of Gja5(connexin-40,CX-40)and arteriogenesis on the hindlimb in mice.Methods One hundred and sixty eight mice were used in the study,including 56 CX40 knockout mice(Gja5-/-group),56 CX40 heterozygous mice(Gja5+/-group)and 56 wild-type mice(Gja5+/+group).The hindlimb blood flow blockage was induced by femoral arteries occlusion(FAO).The scanning Laser Doppler Flow Imager was used to observe the expression of Gja5 in Gja5 EGFP reporter animals through fluorescent microscope.Gja5 gene expression was also detected in gastrocnemicus(GC)muscle by real-time RT-PCR before and 1,3,7,14,21d after FAO.Results The Gja5 gene was expressed in mouse arteries including cerebral artery and femoral artery.There were significant reductions for hindlimb perfusion in Gja5-/-mice compared to Gja5+/+mice at d1,3,7,14 and 21 after FAO.The expression levels of Gja5 in Gja5+/-mice and Gja5+/+mice in GC muscle were both increased 4-fold in the ischemic hindlimb at d3 after FAO.Then the expression levels of Gja5 returned to baseline values at d7 after FAO.Conclusion Arterial Gja5 expression may be involved in the arteriogenesis of ischemic hindlimb of mice.
Gja5 Gene Mice Hindlimb Arteriogenesis
2012-08-23)
(本文编辑:杨丽)
浙江省钱江人才计划D类项目(QJD1202017),浙江省医药卫生平台重点资助计划项目(2013ZDA003)
310014 杭州,浙江省人民医院心胸外科
王海涛,E-mail:wanght1974@hotmail.com

