直肠癌组织肿瘤转移消失蛋白的表达及其临床意义
张海峰 李金海 戴华卫 孙广正 翟华伟
直肠癌组织肿瘤转移消失蛋白的表达及其临床意义
张海峰 李金海 戴华卫 孙广正 翟华伟
目的 探讨肿瘤转移消失(MIM)蛋白在直肠癌组织中的表达及其结合临床分期对直肠癌预后的指导意义。 方法采用免疫组织化学方法检测MIM蛋白在直肠癌组织,直肠腺瘤组织,直肠正常组织中的表达,并用单因素分析其与临床病理参数的关系。用Spearman等级相关分析MIM蛋白表达水平与直肠癌患者TNM分期的关系。Kaplan-Meier生存曲线分析直肠癌患者5年生存率情况。 结果 直肠癌组织MIM蛋白表达阳性率(83.2%)较直肠正常组织的21.6%和直肠腺瘤组织的28.8%均明显增高(均P<0.05);MIM蛋白表达水平与直肠癌患者是否处于肿瘤早期、是否有3枚以上淋巴转移和肿瘤分化程度有关(均P<0.05),与直肠癌患者的性别、年龄、肿瘤直径、CEA水平、肿瘤位置高低均无关(均P>0.05)。MIM蛋白表达水平与临床TNM分期呈正相关,即临床TNM越晚期MIM蛋白表达水平越高(P<0.05)。MIM蛋白阳性患者5年生存率明显低于阴性及弱阳性患者(P<0.05)。 结论 MIM蛋白高表达可能与直肠癌的发生及生物学行为有关,并提示预后不良。
癌 直肠组织 肿瘤转移消失蛋白 临床研究
【 Abstract】 Objective To investigate the expression of MIM (missing in metastasis)protein in rectal carcinoma and its clinicopathological significance.Methods The expression of MIM protein was detected by immunohistochemistry in tissue samples of rectal carcinoma(n=143),rectal adenoma(n=14)and normal rectal mucosa(n=37).Correlation between MIM expression and clinicopathological parameters was analyzed with Spearman rank regression.Postoperative 5-year survival was evaluated using Kaplan-Meier survival curve. Results The expression of MIM in rectal carcinoma was higher than those in normal rectal tissue(U=179.000,P<0.05)and rectal adenoma(U=112.500,P<0.05).The expression of MIM protein was correlated with clinical stage,lymphatic metastasis and tumor differentiation (separately U=256.000,227.000,236.500,all P<0.05),but not correlated with gender,age,tumor diameter,CEA level and tumor location(P>0.05).MIM expression was also correlated with TNM stage of rectal cancer(r=0.369,P<0.05).The 5-year survival in patients with positive MIM expression was significantly poorer than those with negative or weakly positive expression (32.6%vs 67.8%,χ2=6.712,P<0.05). Conclusion High expression of MIM protein may be associated in progression of rectal carcinoma and poor prognosis.
【 Key words】 Carcinoma Rectal tissue Missing in metastasis protein Clinical research
提高直肠癌诊疗水平、改善患者预后的主要措施是早期诊断和早期治疗,因此研发早期分子标志物以提高对直肠癌诊断及预后判断的水平是目前研究的重点[1]。肿瘤转移消失(missing in metastasis,MIM)蛋白又称肿瘤转移抑制(metastasis suppressor 1,MTSS1)蛋白,是一种新发现的蛋白,参与多种肿瘤的生长转移过程并有着广阔的应用前景[2]。本研究通过免疫组化法观察MIM蛋白在不同病理类型直肠癌组织中的表达情况,分析其对直肠癌的临床意义。
1 材料和方法
1.1 病理标本 (1)直肠癌组:本院2004-01—2007-01手术切除的143例直肠癌患者的手术标本均行病理检查确诊为直肠癌,患者男81例,女62例,年龄36~82岁,平均57.7岁,术前均未行放疗或化疗。(2)直肠腺瘤组:同期经术后病理检查证实为直肠腺瘤的14例患者的手术标本,患者年龄41~78岁,平均58.1岁。(3)直肠正常组织:取自上述37例直肠癌患者距肿瘤边缘3cm以上的正常直肠组织,且病理检查证实无癌细胞。
1.2 免疫组化染色检测 MIM抗体 (兔多克隆抗体)及二抗购自美国eBioscience公司。使用LAB VISION 2D
1.3 结果判定 细胞膜及胞质有棕黄色染色为阳性反应,高倍镜下计数500个细胞。综合细胞染色强度和阳性细胞百分率作为判断标准:不着色0分,浅黄色1分,棕黄色2分,深棕色3分;无染色阳性细胞为0分,阳性细胞<25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分。染色强度和阳性百分率的乘积>3分为免疫反应阳性,按乘积分数将染色结果分为4个等级:阴性(-)0~2分,弱阳性(+)3~5分,中等阳性(++)6~8分,强阳性(+++)9~12分。
1.4 统计学处理 使用SPSS 13.0统计软件。组间等级相关资料的比较采用秩和检验。两因素相关性采用Spearman等级相关分析。绘制Kaplan-Meier生存曲线,采用Log-rank法检验生存率,检验水准α=0.05。
2 结果
2.1 MIM蛋白在直肠良恶性组织中的表达 MIM蛋白在绝大多数直肠癌组织中表达为阳性,有些甚至是强阳性,阳性表达位于胞质区域,部分胞质染色为棕黄色或棕褐色,细胞核内无表达(图1a);而在大多数直肠腺瘤和正常组织中表达为阴性,少部分为弱阳性(图1b、c)。MIM蛋白表达阳性率直肠正常组织为21.6%,直肠腺瘤组织为28.8%,两者之间的差异无统计学意义(U=89.000,P>0.05);而直肠癌组织阳性率为83.2%,远高于正常组织与直肠腺瘤组织,差异均有统计学意义(U=179.000、112.500,均P<0.05),详见表1。另外早期(TNM分期为Ⅰ、Ⅱ期)直肠癌组织阳性率78.8%,亦高于正常组织与直肠腺瘤组织,差异均有统计学意义(U=228.000、198.000,均P<0.05),详见表2。
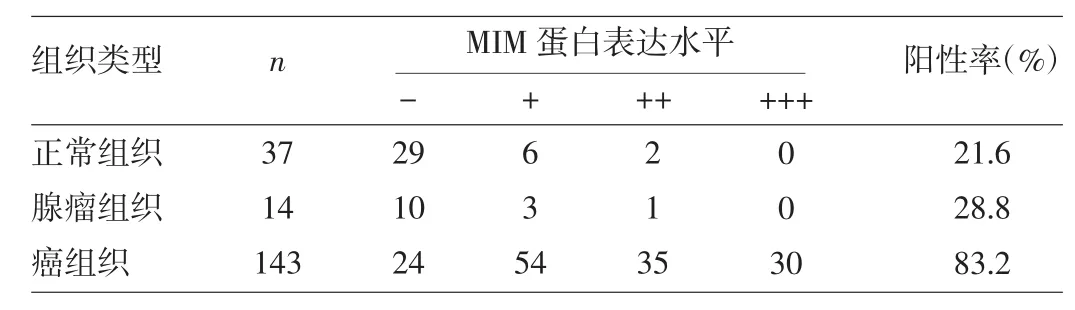
表1 不同直肠组织MIM蛋白表达水平的比较(例)
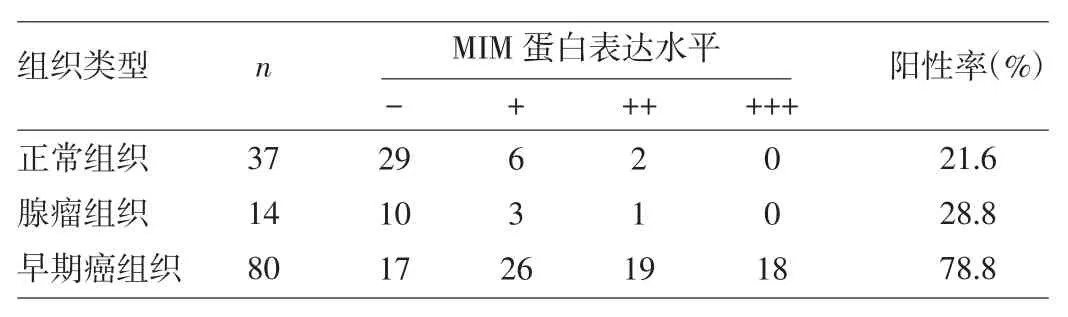
表2 直肠正常、腺瘤组织与早期直肠癌组织的MIM蛋白表达水平的比较(例)
2.2 直肠癌组织中MIM蛋白的表达与临床病理参数的关系 MIM蛋白在直肠癌组织中的表达与性别、年龄、肿瘤大小、CEA水平及肿瘤位置高低无关,而与肿瘤是否处于早期、是否有3枚以上区域性淋巴结转移以及分化程度有关,详见表3。MIM蛋白表达水平与临床TNM分期间呈正相关,即临床TNM分期越晚,所对应的MIM蛋白表达水平越高,详见表4。
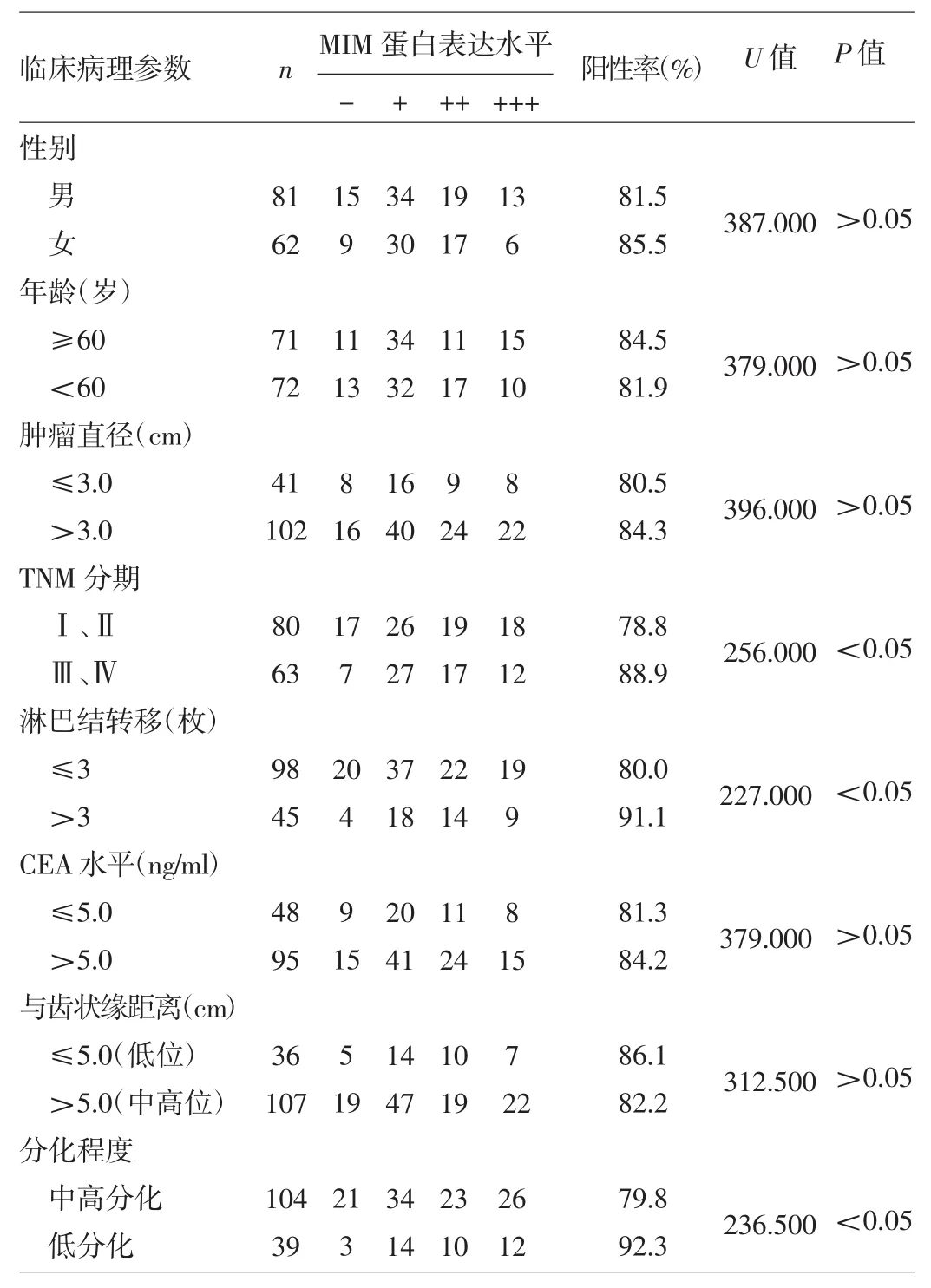
表3 临床病理参数与直肠癌组织中MIM蛋白表达的关系(例)
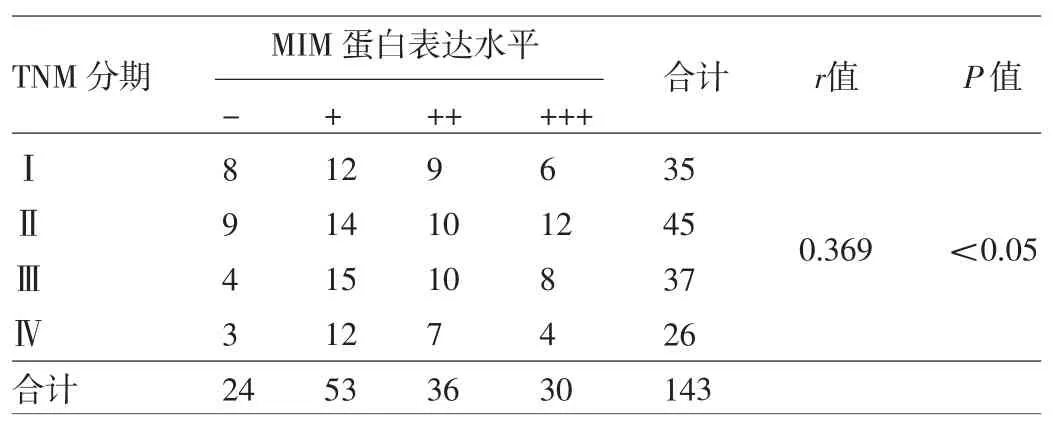
表4 TNM分期与直肠癌组织中MIM蛋白表达的关系(例)
2.3 MIM蛋白表达与直肠癌患者生存率的关系 143例直肠癌患者术后随访5年,其中10例失访,实际随访133例。MIM蛋白阴性及弱阳性者共随访到87例,死亡28例,5年生存率为67.8%;MIM蛋白中等阳性和强阳性者共随访到46例,死亡31例,5年生存率32.6%, MIM蛋白阴性及弱阳性者5年生存率明显高于MIM蛋白中等阳性和强阳性表达者,差异有统计学意义(χ2= 6.712,P<0.05),见图2。
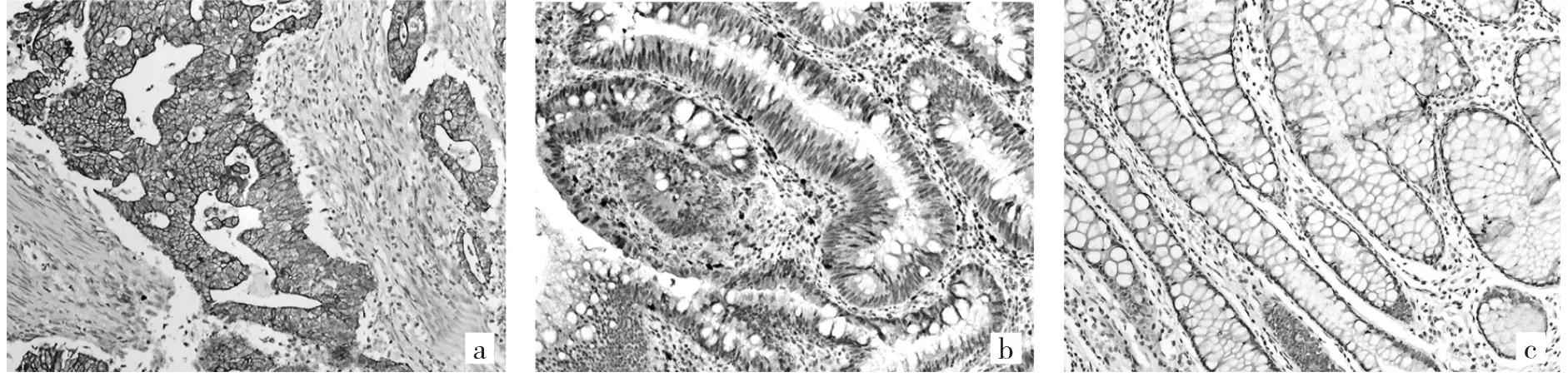
图1 MIM蛋白在不同病理类型直肠组织中的表达(a:直肠癌中MIM蛋白强阳性表达;b:直肠腺瘤中MIM蛋白弱阳性表达;c:直肠正常组织中阴性表达;免疫组织化学染色,×200)
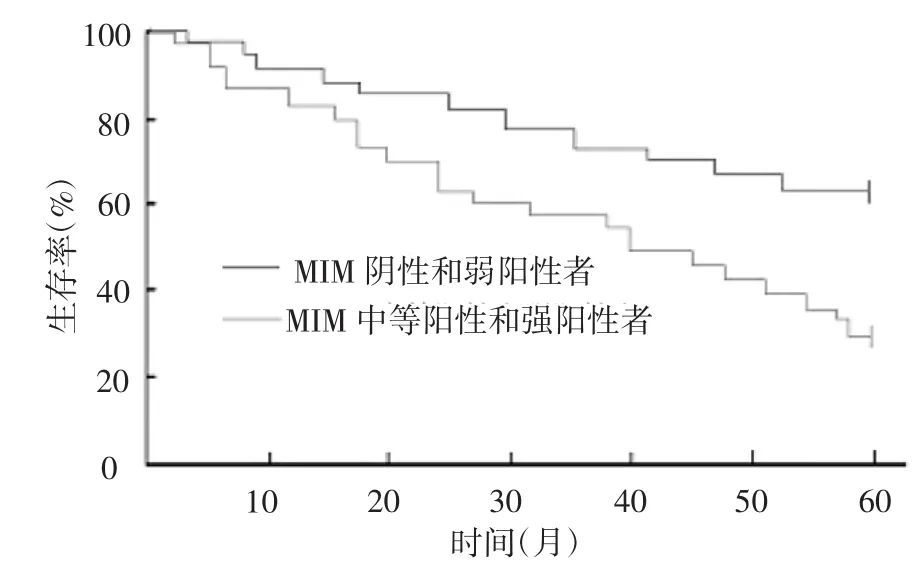
图2 MIM蛋白表达与直肠癌患者的生存率关系
3 讨论
MIM蛋白在肿瘤中的作用目前仍在探索之中。MIM基因最先由Lee等[3]于2002年在研究膀胱癌的转移机制时通过改良的mRNA差异显示技术发现,并认为该基因是肿瘤转移抑制基因。Parr等[4]发现MIM蛋白在乳腺癌细胞中扮演一个控制转移特性的角色,MIM蛋白低表达的乳腺癌患者,其生存率低,预后差。Dawson等[5]研究表明,MIM蛋白通过调控表皮生长因子信号通路从而抑制头颈部鳞癌的转移。以上研究都支持了MIM蛋白是一种新的肿瘤转移抑制因子的观点。但随着研究的深入,越来越多的研究发现MIM蛋白还有诸多其他作用。Ma等[6]首次报道了人肝细胞癌中MIM mRNA的过表达可导致MIM蛋白的过表达,可促进肝细胞癌的早期发展。Xie等[7]认为MIM蛋白是一种多功能蛋白,在促进肿瘤的侵袭和转移过程中发挥作用。这一观点与Lee等[3]所认为的MIM基因是肿瘤转移抑制基因的结论完全相反。Ma等[6]认为既往对MIM蛋白作用的研究结果不尽一致,甚至完全相反的原因可能与MIM蛋白表达具有组织类型特异性有关。此外,Mattila等[8]认为MIM基因不是肿瘤转移抑制基因,而是作为与Rac、actin以及actin伪足形成相关蛋白相作用的支架蛋白。Lin等[9]认为可直接作用于肌动蛋白,并通过细胞内信号转导途径影响细胞骨架,与cortactin一起参与血小板源生长因子信号转导途径,从而改变细胞与基质间的黏附状态。
MIM蛋白在肿瘤中所发挥的作用机制也是目前研究的热点。MIM蛋白是一种新的肌动蛋白结合蛋白,基因定位于8q24.1上,通过结合细胞内不同的分子改变肌动蛋白的动力学特点,参与细胞骨架的重塑、信号转导和转录活化等[10]。调节MIM蛋白表达的具体机制目前尚不清楚,可能与DNA甲基化相关,但MIM蛋白作为信号通路蛋白已得到证实。Callahan等[11]发现MIM基因是一个应答基因,它可能有Gli转录激活功能,MIM蛋白可与锌指转录因子Glil/Gli2及Sufu结合形成三元复合体促进Gli介导的转录,激活Hedgehog(Hh)-Glioblas-toms(Gli)信号通路,因此,编码MIM的基因被认为是SHh相关通路的基因,是SHh-Gli通路的新成员,在成瘤和瘤体生长过程中起促进作用,从而促进肿瘤细胞的增殖与侵袭。
在直肠癌的临床治疗中,有无淋巴结转移及转移淋巴结的数量是影响预后的重要因素之一[12]。Moran等[13]的研究表明,如果淋巴结转移数量大于3枚,其局部复发率显著升高,且5年生存率也明显降低。因此,本研究在淋巴结转移量上选用3枚作为分界点进行研究。本研究结果显示,在直肠癌组中MIM蛋白的表达率明显高于直肠正常组织组及直肠腺瘤组,提示其在肿瘤的形成中具有一定作用。此外,MIM蛋白的表达也与肿瘤的临床病理特点相关,在低分化肿瘤中,阳性表达率明显高于中、高分化肿瘤,这表明其可能参与肿瘤的分化调控。晚期直肠癌MIM蛋白的表达水平明显高于早期直肠癌,且MIM蛋白表达水平与直肠癌TNM分期呈正相关,并也与是否有3枚以上淋巴转移相关,这些结果提示MIM蛋白的表达与肿瘤的生物学行为相关,可能是肿瘤恶性程度的一种表现。以上研究结果提示MIM蛋白可能在直肠癌形成及进展中发挥重要作用,但具体机制仍需进一步研究。
总之,MIM蛋白在直肠癌早期就已经高表达且阳性表达者5年生存率下降,提示MIM蛋白可能成为早期发现及评估直肠癌等恶性肿瘤预后的重要指标之一,为临床治疗及预后评估提供新的靶点。
[1]吕有勇,于君.基因组医学与结直肠癌的早期防治[J].中国普通外科杂志,2011,5(6):361-362.
[2]黄修燕,黄自丽,汤钊猷,等.转移消失蛋白在肿瘤发生发展中的作用[J].肿瘤,2010,2(4):170-172.
[3]Lee Y G,Macoska S,Korenchuk S,et al.MIM,a potential metastasis suppressor gene in bladder cancer[J].Neoplasia,2002,4: 291-294.
[4]Parr C,Jiang W G.Metastasis suppressor 1(MTSS1)demonstrates prognostic value and anti-metastatic properties in breast cancer [J].Eur J Cancer,2009,45:1673-1683.
[5]Dawson J C,Timpson P,Kalna G,et al.Mtts1 regulates epidermal growth factor signaling in head and neck squamous carcinoma cells[J].Oncoqene,2011,19:1038-1047.
[6]Ma S,Guan X Y,Lee T K,et al.Clinicopathological significance of missing in metastasis B expression in hepatocellular carcinoma [J].Hum Pathol,2007,38:1201-1206.
[7]Xie F,Ye L,Ta M,et al.MTSS1:a multifunctional protein and its role in cancer invasion and metastasis[J].Front Biosci(Schol Ed), 2011,3:621-631.
[8]Mattila P K,Salminen M,Yamashiro T,et al.Mouse MIM,a tissue-specific regulator of cytoskeletal dynamics,interacts with ATP-actin monomers through its C-terminal WH2 domain[J].J Biol Chem,2003,278:8452-8459.
[9]Lin J,Liu J,Wang Y,et al.Differential regulation of cortactin and N-WASP-mediated actin polymerization bv missing in metaslasis(MIM)protein[J].Oncogenc,2005,24:2059-2066.
[10]Saarikangas J,Mattila P K,Varjosalo M,et al.Missinginmetastasis MIM/MTSS1 promotes actin assembly at intercellular junctions and is required for integrity of kidney epithelia [J].J Cell Sci,2011,15:1245-1255.
[11]Callahan C A,Ofstad T,Horng L,et al.MIM/BEG4 a soni Hedgehog-responsive gene that potentiates gli-dependent transcription[J].Genes Dev,2004,18:2724-2729.
[12]Mizukami Y,Ueda S,Mizumoto A,et al.Diffusion-weighted magnetic resonance imaging for detecting lymph node metastasis of rectal cancer[J].World J Surg,2011,35:895-899.
[13]Moran M R,James E C,Rothenberger D A,et al.Prognostic valve of positive lymph nodes in rectal cancer[J].Dis Colon Rectum,1992,35:978-984.
(本文编辑:沈叔洪)
Expression of MIM protein in rectal carcinoma and its clinicopathological significance
ZHANG Haifeng,LI Jinhai,DAI Huawei,et al.
Department of General Surgery,the Third Affiliated Hospital of Wenzhou Medical College,Rui’an 325200,China
325200 瑞安,温州医学院附属第三医院普通外科
张海峰,E-mail:zhanghaifeng1020@126.com全自动免疫组化染色仪,以Elivision二步法进行染色。并使用泰康全自动组织脱水机(TKY-TSF)、惠达组织包埋机(HD-310A)、惠达切片机(HD-325B)、惠达组织漂烘仪(HD-330)、OLYMPUS BS51显微镜及哈尔滨海慈病理图文分析系统。石蜡切片常规脱蜡、水化,其余操作按照Elivision试剂盒说明书进行。检测过程均在自动免疫组化染色仪中按照事先编好的程序完成。
2012-05-07)

