2型糖尿病合并肾病与PPAR基因相关性研究
应卫婵 霍晓静
2型糖尿病合并肾病与PPAR基因相关性研究
应卫婵 霍晓静
目的 探讨2型糖尿病(T2DM)及糖尿病肾病(DN)与过氧化物酶体增殖物受体γ(PPARγ)基因P12A位点多态性的关系。 方法 选择DM患者(无并发症者100例),DN患者95例;正常对照(CN)组100例。应用RFLPPCR技术检测PPARγP12A位点多态性,比较组间基因型、等位基因频率及临床变量间的差异。 结果 (1)DM组及DN组P12A12基因及A12等位基因频率均明显低于CN组(P<0.05);DM组与DN组比较,差异无统计学意义(P>0.05)。(2)携带PA基因型的糖尿病患者24h尿蛋白定量、血β2微球蛋白均低于P12P12基因携带者,差异均有统计学意义(均P<0.05)。 结论 PPARγ基因P12A位点多态性与DM及DN发病相关,A12等位基因可能是DN的保护因素。
2型糖尿病 糖尿病肾病 过氧化物酶体增殖物受体γ 多态性 限制性片段长度
近年来大量研究发现过氧化物酶体增殖物受体γ基因P12A位点(PPARγP12A)基因突变与糖脂代谢、2型糖尿病(T2DM)等疾病都有一定的相关性。糖尿病肾病(DN)是DM主要并发症及主要死因之一,其发病基础是胰岛素的抵抗。PPARγP12A基因携带者体内胰岛素敏感度升高,可能与DN的发病存在着一定联系。为此本研究选择PPARγP12A基因作为靶基因,旨在探讨PPARγP12A基因多态性与DM、DN是否相关。
1 对象和方法
1.1 对象 选取金华市人民医院2010-2012年就诊的T2DM患者,包括单纯DM组100例,年龄32~76岁,平均(57.50±10.90)岁;DN组95例,年龄26~79岁,平均(58.33±9.40)岁;健康对照(CN)组100例,年龄35~61岁,平均(52.13±9.46)岁。CN组为健康体检者,无T2DM、肾病病史、家族史。各组间年龄、性别相匹配(表1)。所有受试者均排除严重肝、肾疾病及自身免疫性疾病。所有受试对象均签署知情同意书,自愿参与本课题研究,本研究经金华市人民医院伦理委员会同意。
T2DM诊断符合1999年WHO诊断标准;DN诊断依据《内科学》第7版。DN患者入选标准为尿蛋白测定>300mg/24h。
1.2 方法
1.2.1 一般资料的收集 专人记录及测定研究对象的一般资料,包括年龄、性别、身高、体重、血压等指标。
1.2.2 临床生化指标检测 所有对象于空腹10~14h后于清晨7~8点,采取肘静脉血5ml,用EDTA抗凝。用于肝功能检查、FPG、TC、TG、HDL-C、LDL-C及HbA1c、Cr、UAC、β2-MG等化验指标。留取24h尿,化学比浊法测定24h蛋白定量等指标。
1.2.3 PPARγP12A基因多态性的测定 PCR检测:反应引物由上海生物工程技术有限公司合成,引物序列:上游5′5′-CAAGCCCAGTCCTTTCTGTG-3;下游5′-AGTGAAGGAATCGCTTTCCG-3′。PCR反应体系(25μl):10×PCR缓冲液2.5μl,MgCl22.5μl,dNTP(10mM)0.35μl,上下游引物(10μM)各1.25μl,TaqDNA聚合酶1U,模板DNA3μl,纯水16.4μl。PCR反应条件:预变性93°C 2min,变性94°C 30s,退火55°C 50s,延伸72°C 60s,终末延伸限72°C 5min。于1.5%的琼脂糖凝胶电泳检测。限制性片段长度多态性分析(restriction fragment length polymorphism,RFLP):PCR产物经限制性核酸内切酶HpaⅡ酶切37°C 4h。置于2%的琼脂糖凝胶电泳确定基因型。
1.3 统计学处理 采用SPSS 11.5统计软件,计量资料采用表示,两组间比较采用t检验,多组间比较采用方差分析,两两比较采用q检验;采用χ2检验分析各组间基因型、等位基因频率分布。
2 结果
2.1 3组间临床资料比较 见表1。
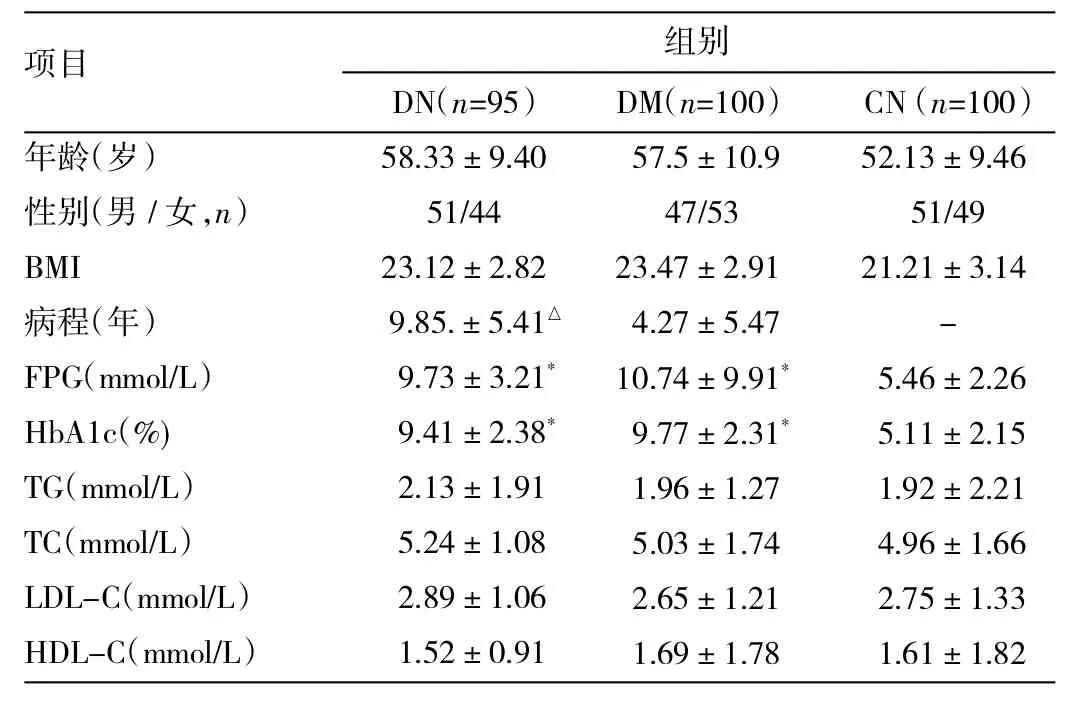
表1 3组临床指标的比较
由表1可见,DM组和DN组FPG、HbA1c均高于CN组(均P<0.05),而年龄、性别、BMI、TG、TC、LDL-C、HDL-C差异均无统计学意义(均P>0.05),DN组与DM组相比,两组间年龄、性别、BMI、FBG、HbA1c、TG、TC、LDL-C、HDL-C差异均无统计学意义(均P>0.05),但DN组的病程明显长于DM组,差异均有统计学意义(均P<0.05)。
2.2 PPAR基因频率分布 本研究在所有受试对象中共检出两种基因型PP型与PA型,未检出AA基因型。各组PPARγP12A基因频率分布符合Hardy-Weinberg平衡定律,证实本实验样本具有群体代表性。详见表2。
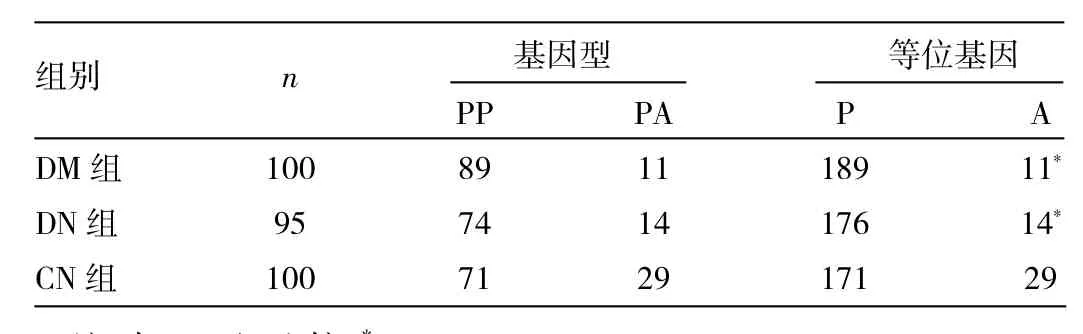
表2 PPARγP12A基因型、等位基因分布频率(例)
由表2可见,DM组的PA基因型(χ2=10.125,P=0.001,OR=0.303,95%CI:0.141~0.648)以及A12等位基因(χ2=9.0,P=0.003,OR=0.343,95%CI:0.166~0.708)频率明显低于CN组,差异存在统计学意义;DN组PA基因型(χ2=4.043,P=0.044,OR=0.483,95%CI:0.236~0.989)以及A12等位基因(χ2=5.052,P=0.025,OR=0.469,95%CI:0.24~0.918)频率明显低于CN组,差异存在统计学意义。DM组与DN组之间PA基因型(χ2=1.177,P=0.278)以及A12等位基因(χ2=0.567,P=0.451)频率均无统计学差异(均P>0.05)。
2.3 PM患者P12P12和P12A12基因型间临床资料比较 见表3。

表3 不同基因型间临床资料的比较
由表3可见,PP基因携带者24h尿蛋白定量、β2-MG均显著高于PA基因携带者,差异均有统计学意义(均P<0.05)。两者间BMI、FBG、血脂、UAC、HbA1c、Cr差异均无统计学意义(均P>0.05)。
3 讨论
PPARγ属于核激素受体超家族的一员,它与脂肪细胞分化、糖脂代谢、胰岛素敏感性均有密切的关系。因此近年来PPARγ与T2DM及其并发症是否相关成为人们研究的热点问题。PPARγ基因主要包含9个外显子,人类染色体编码3种PPARγ基因,分别对应3种PPAR-γmRNA,产生γ1、γ2、γ3三种蛋白产物。PPARγ2主要在脂肪组织中表达。其外显子B编码的28个氨基酸是决定PPARγ2功能活性的主要结构单位。在PPARγ2外显子B的第12位密码子中存在CCA-GCA多态性,造成脯氨酸-丙氨酸的替换。有研究显示此一替换(即X/A基因型)会通过直接影响PPARγ的活性而改变血糖的稳态以及脂质分化的通路[1]。由此有学者推测PPARγ2多态性可能与T2DM及其并发症的发生相关。
PPARγ2基因多态性有3种基因型,包括PA、AA、PP,但纯合子AA突变率很低,本实验未检出AA基因型。故仅对PA和PP基因型进行分析。近年大量研究认为,PA基因型可能与改善DN症状有关系。一些研究显示了PPARγ2基因Ala变异对于降低DM及DN的发病率有着显著的效果[2]。另有一些研究也发现,Ala变异对于DN并没有直接的相关性,但P12A基因的多态性与脂肪代谢和降低肥胖的发生率密切关系[3-4]。由上述研究可以发现,国内外学者对于P12A基因多态性对DN的影响结果不尽相同。由此可见,它与DN及DM病相关性存在着明显的种族和地区差异性。
我们的研究发现DM组P12A12基因型和A12等位基因频率明显低于CN组,推测A12基因变异在DM的发生中起到了保护作用,然而研究发现CN组与非肾病组间基因频率分布未显现出统计学差异,原因可能与与本研究样本量较少有关,有待进一步扩大样本量来证实。我们对不同基因型的DM患者进行分组比较发现,PA基因型患者的24h尿蛋白明显低于PP基因型,推测A12等位基因携带者尿蛋白排泌量减少,延缓了肾血管病变的过程,在DN的发展中可能起到了保护作用。作为胰岛素增敏剂的噻唑烷二酮类药物是通过作用于过氧化物酶体增殖物受体发挥对DM的治疗作用,因此我们认为该类药物对于预防DN的发生、发展也同样有着积极的作用,有待于我们进一步深入的研究。
[1] Jifeng Z,Mingui F,Taixing C,et al.Selective disruption of PPAR 2 impairs the development of adipose tissue and insulin sensitivity[J].PNAS,2004,101:10703-10708.
[2] Stefan M H,Jens R,Ji-Guang W,et al.Peroxisome Proliferator-Activated Receptor-γ2 Polymorphism Pro12Ala Is Associated With Nephropathy in Type 2 Diabetes:The Berlin Diabetes Mellitus(BeDiaM)Study[J].Diabetes,2002,51(8):2653-2657.
[3] Bouassida K Z,Chouchane L,Jellouli K,et al.The peroxisome proliferator activated receptorφ2 (PPARφ2)Pro12Ala variant: lack of association with type 2 diabetes in obese and non obese Tunisian patients[J].Diabetes Metabolism,2005,31(2):119-123.
[4] Badii R,Bener A,Zirie M,et al.Lack of association between the Pro12Ala polymorphism of the PPARγ2 gene and type 2 diabetes mellitus in the Qatari consanguineous population[J].Acta Diabetologica,2008,45(1):15-21.
PPAR gene polymorphism in diabetic nephropathy
Type 2 diabetes mellitus Diabetic nephropathy PPARγ Polymorphism Restriction fragment length
2012-03-20)
(本文编辑:沈昱平)
金华市科技卫生项目(2011-3-041)
321000 金华市人民医院内分泌科(应卫婵);兰溪市人民医院(霍晓静)
应卫婵,E-mail:jhywc@163.com
【 Abstract】Objective To investigate the relationship between the PPAR-γ2 Pro12Ala polymorphism and diabetic nephropathy. Methods The PPAR-γ2Pro12Ala polymorphism was determined by PCR-RFLP in 95 patients with diabetic nephropathy(DN),100 type 2 diabetic patients without complications(DM2)and 100 normal controls(CN).Results The frequency of Pro12Ala mutation was significantly higher in DM2 and DN groups than that in CN group(P<0.05).The 24h-urinary protein and serum β2 microglobulin levels in DM2 patients with PA genotype were lower than those with PP genotype (both P<0.05). Conclusion PPAR γ gene P12A polymorphism may be associated with type 2 diabetes and diabetic nephropathy,the A12 allele may be a protective factors for diabetic nephropathy.

