直肠癌术前与术后放化疗疗效对比分析
杨新妹 宋斌斌 江一鸣 李侠 朱远 蒋红钢
直肠癌术前与术后放化疗疗效对比分析
杨新妹 宋斌斌 江一鸣 李侠 朱远 蒋红钢
直肠癌是常见恶性肿瘤之一,近年来发病率呈逐年上升趋势,手术治疗是其主要治疗手段。但单一手术治疗复发率高,长期生存率低,目前多采用放化疗和手术相结合的综合治疗方案。2007年NCCN指南开始推荐直肠癌术前放化疗和术后放化疗均为直肠癌标准治疗方案,选取何种辅助治疗方案更佳临床上一直存在争议。近年来,嘉兴市第一医院及浙江省肿瘤医院采用术前和术后放化疗两种方案治疗局部晚期直肠癌,并对其疗效进行了比较分析,现将结果报道如下。
1 资料和方法
1.1 一般资料 选取2006-08—2011-08嘉兴市第一医院及浙江省肿瘤医院收治并经病理检查证实的局部晚期直肠癌患者66例,直肠指检肿块均为活动度差或固定。其中采取术前放化疗者30例(术前放化疗组),男23例,女7例,年龄34~73(54.5±12.9)岁。其中腺癌23例,黏液腺癌3例,印戒细胞癌4例。肿瘤下缘距肛缘2~12(4.6±2.2)cm;其中<7cm者26例,≥7cm者4例。依据美国癌症联合委员会的TNM标准(2002年),术前临床分期:T3期11例和T4期19例。采取术后放化疗者36例(术后放化疗组),男23例,女13例,年龄39~73(56.5±10.4)岁。其中腺癌32例,黏液腺癌2例,印戒细胞癌2例。肿瘤下缘距肛缘3~12(5.1±1.8)cm;其中<7cm者24例,≥7cm者12例。依据美国癌症联合委员会的TNM标准(2002年),术前临床分期:T3期16例和T4期20例。两组患者性别、年龄、肿瘤类型、肿瘤下缘距肛缘距离以及TNM分期的差异均无统计学意义(均P>0.05)。
1.2 治疗方法 术前放化疗组均完成了术前同步放化疗。放疗:靶区累积剂量45GY(5周共25次),盆腔大野,包括肿瘤及盆腔淋巴引流区,上界腰5下缘,下界闭孔下缘或根据肿瘤位置确定,双侧界真性骨盆,前界股骨头1/2或2/3,后界骶尾骨后缘。缩野至肿瘤区加量5.4GY(1.8GY/次),总剂量为50.4GY/28次。常规模拟机定位或CT定位。同步化疗方案:奥沙利铂针50mg/m2静滴,1次/周,放疗第1、2、3、4周,希罗达625mg/m2Bid 5d(与放疗同期服用,周一至周五)。手术:同步放化疗结束后4~6周进行手术。术后完成围手术期6个月的FOLFOX6方案全身化疗。术后放化疗组先行手术,术后均完成序贯放化疗。放疗方法同试验组,放疗后完成6个月的FOLFOX6方案或口服希罗达方案全身化疗。
1.3 随访 自患者确诊之日开始随访,内容包括查体、直肠镜、肝脏和盆腔B超、胸部X线片、检测癌胚抗原和血尿常规;必要时行CT(包括PET)、MRI和核素等检查。以问卷形式对20例行保肛手术患者(术前放化疗组8例,术后放化疗组12例)的肛门括约肌功能状况进行调查。不良反应按照CTC3.0毒副反应评价标准进行评价,分为0~4级。
1.4 统计学处理 采用SPSS13.0统计软件,率的比较采用χ2检验,生存率计算采用Kaplan-Meier法,生存率的比较采用log-rank检验。
2 结果
随访截至2012年5月,失访3例(其中术前放化疗组失访1例,术后放化疗组失访2例),随访率为95.5%;随访时间10~63个月,平均36.5个月。
2.1 两组患者术后控便功能比较 术前放化疗组术后便频6例,尿频、尿急3例,排便困难1例,肛门收缩无力5例。随访1年,上述症状发生率为41.3%,2年发生率23.8%,3年发生率9.6%。术后放化疗组术后便频5例,尿频、尿急2例,排便困难1例,肛门收缩无力2例。随访1年,上述症状发生率为39.1%,2年发生率20.7%,3年发生率7.3%。两组患者术后控便功能的差异无统计学意义(P>0.05)。
2.2 两组患者不良反应比较 见表1。
由表1可见,两组患者术后不良反应的差异无统计学意义(P>0.05)。
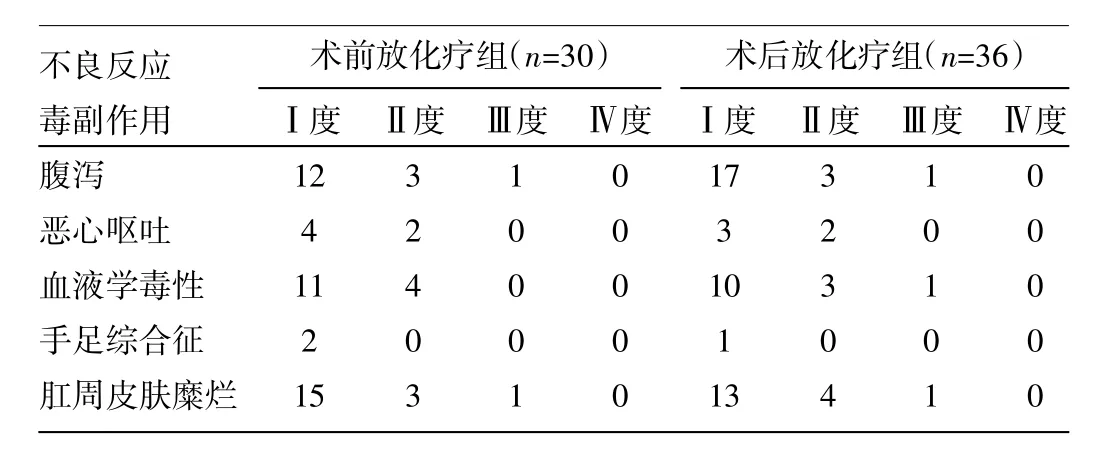
表1 两组患者不良反应比较
2.3 两组患者术后生存率比较 术前放化疗组和术后放化疗组3年生存率分别为61%、56%,3年无进展生存率分别为61%、48%,其比较见图1-2。由图1-2可见,两组患者3年生存率及3年无进展生存率的差异均无统计学意义(均P>0.05)。术前放化疗组和术后放化疗组局部复发率分别为3.3%、16.7%,远处转移率分别为6.7%、19.4%,差异均有统计学意义(均P<0.05)。

图1 两组患者3年生存率比较

图2 两组患者3年无进展生存率比较
3 讨论
直肠癌术后放化疗可减少局部复发,提高生存率,已成为Ⅱ~Ⅲ期直肠癌标准治疗手段,但术后不良反应及并发症发生率较高。术前放疗能明显改善局部控制率,可使局部复发相对危险降低50%~70%[1],增加保肛的概率,改善患者生活质量,而且联合化疗还有望提高生存率。
目前,关于直肠癌治疗方案的选择仍存在争议。德国在1994年发起了迄今为止最大样本量的比较术前放化疗和术后放化疗的随机对照研究,结果提示保肛率在术前放化疗组和术后放化疗组分别为39%和19%(P= O.001),5年局部复发率分别为6%和13%(P=0.006);急性毒性反应在两组分别是27%和40%(P=O.001),晚期毒性反应分别为14%和24%(P=0.01),总生存率分别为76%和74%(P=0.80)[2]。提示术前放化疗较术后放化疗,虽未显示有生存率的差异,却降低了局部复发,提高了肛门括约肌保留的机会,减少了治疗的毒性反应。由于该研究的质控高,基于上述研究结果,术前放化疗已成为现阶段局部晚期直肠癌的标准治疗。
Saner等[2]的报道未提示生存率上的差异,其后多项国内外研究均与该研究结果相仿,仅在保肛率、病理缓解率和局部控制方面术前放化疗显示出优势。而1993-1999年进行的NSABP/R-03研究[3]则是第一项得出术前放化疗在无瘤生存率上显示优势的研究(65%、53%;P=0.011)。对此,Rob等[4]认为,对比德国研究,两者放疗方法及剂量相同,同步化疗药物均为5-FU,但NSABP/R-03研究5-FU用量高于德国CAO/ARO/AIO94研究,可能是其中原因之一。本研究结果提示,术前放化疗组局部复发率和远处转移率均低于术后放化疗组,两组3年生存率和3年无进展生存率差异无统计学意义。但本研究术后放化疗采用的是序贯放化疗而未采用同步放化疗,可能对研究结果带来一定影响。
本研究结果显示,术前放化疗组保肛率26.7%,而术后放化疗组保肛率33.3%。前者低于后者究其原因考虑为术前放化疗组的低位直肠癌比例较高,距肛缘<7cm者26例(86.7%),而术后放化疗组为24例(66.7%)。尽管绝大多数经保肛的患者可以获得主观上可以接受的排便功能,但其中部分患者术后控便功能不满意(如出现便频、尿频尿急、排便困难、大便失禁等症状),但随时间延长和饮食调节,症状会逐步缓解。术前放化疗和术后放化疗控便功能比较,差异无统计学意义,且症状呈逐年递减趋势,与Ammann等[5]以及Lyon R96-02研究[6]结果相似。本研究中患者均采用俯卧位,可将小肠剂量进一步降低,但直肠癌术后患者盆腔空虚,部分小肠坠入盆腔,行术后放疗时肠道黏膜反应将增加。本研究发现术后放化疗组腹泻发生率较术前放化疗组增高,其余毒副反应无明显差异。德国的CAO/ARO/AIO94研究提示,急性毒性反应在术前放化疗组和术后放化疗组的差异有统计学意义,其中腹泻为主要毒副反应[2]。由此可见,直肠癌行术前放化疗在提高局控、降低远处转移率的基础上将进一步降低毒副反应,提高治疗耐受性。
近年的研究显示,直肠癌术前放化疗在保肛率、局控方面明显优于术后放化疗,且不良反应较轻,未增加手术死亡风险,但在总生存率方面仍有争议。目前的临床研究都在术前新辅助放化疗中尝试采用增加化疗强度,改用其他药物如奥沙利铂、伊立替康等,或联合热疗[7-8],或联合靶向治疗药物(如贝伐单抗)[9],以期望更多的生存获益。但多限于小样本的Ⅰ~Ⅱ期临床研究,仍需大样本的前瞻性Ⅲ期临床试验提供进一步证据。
[1] Camma C,Giunta M,Fioriea F,et al.Preoperative radiotherapy for resectable rectal cancer:a meta-analysis [J].JAMA,2000,284 (8):1008-1015.
[2] Saner R,Becker H,Hohenberger W,et al.Preoperative versHs postoperative chemoradiotherapy for rectal cancer[J].N Engl J Med,2004,351(17):1731-1740.
[3]Roh M S,Colangelo L H,O'Connell M J,et al.Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum:NSABP-R03.J Clin Oncol,2009,27: 5124-5130.
[4] Rob G J,Mark H,Robert H.Is the NSABP R-03 Study in Line With Other Chemoradiation Studies[J]?J Clin Oncol,2010,28(18): 305-306.
[5] Ammann K,Kirchmayr W,Klaus A,et al.Impact of neoadjuvant chemoradiation on anal sphincter function in patients with carcinoma of midrectum and low rectum[J].Arch Surg,2003,138:257-261.
[6]Gerard J P,Chapet O,Nemoz C,et al.Improved sphincter preservation in low rectal cancer wlth high-dose preoperative radiotherapy:the lyon R96-02 randomized trial[J].J Clin Oncol,2004, 22:2404-2409.
[7] Asao T,Sakurai H,Harashima K,et al.The synchronization of chemotherapy to circadian rhythms and irradiation in preoperative chemoradiation therapy with hyperthermia for local advanced metal cancer[J].Int J Hyperthermia,2006,22(5):399,406.
[8]De Haas-Kock D F,Buijsen J,Pijls-Johannesma M,et al.Concomitant hyperthermia and radiation therapy for treating locally advancedrectalcancer[J].CochraneDatabaseSyst Rev,2009,(3): CD006269.
[9] Crane C H,Eng C,Feig B W,et al.PhaseⅡtrial of neoadjuvant bevacizumab,capecitabine,and radiotherapy for locally advanced rectal cancer[J].Int J Radiat oncol Biol Phys,2010,76(3): 824-830.
2012-08-29)
(本文编辑:欧阳卿)
314001 嘉兴市第一医院(杨新妹、宋斌斌、江一鸣、李侠、蒋红钢);浙江省肿瘤医院(朱远)

