化痰行瘀汤对肝纤维化大鼠组织病理学及羟脯氨酸含量的影响
陈国中 徐珊 张永生 朱飞叶
化痰行瘀汤对肝纤维化大鼠组织病理学及羟脯氨酸含量的影响
陈国中 徐珊 张永生 朱飞叶
目的 观察化痰行瘀汤对肝纤维化的疗效,并进一步探讨其抗纤维化的作用机制。方法取清洁级健康成年Wistar大鼠60只,随机抽取10只作为正常对照组,其余50只采用经典模型复制后随机数字表法分为5组(造模过程中死亡11只),模型对照组(10只)、复方鳖甲软肝片组(7只)、和化痰行瘀汤低(7只)、中(7只)、高(6只)剂量组,分别以相应药物连续干预6周。采用样本碱水解法检测各组大鼠部分肝组织羟脯氨酸(Hyp)含量;并采用常规HE染色和苦味酸-天狼红染色观察肝纤维化程度。结果复方鳖甲软肝片组、化痰行瘀汤各剂量组能明显改善肝纤维化程度;化痰行瘀汤中剂量组的病理改变明显,明显降低肝组织Hyp含量(P<0.05)。结论化痰行瘀汤能降低肝组织Hyp含量,明显减轻病理改变,有效改善肝纤维化。
化痰行瘀汤 肝纤维化 大鼠 组织病理学 Hyp


【 Abstract】 ObjectiveTo assess the therapeutic effects of Huatan Xingyu (HTXY)decoction on experimental hepatic fibrosis in rats.MethodsSixty adult Wistar rats were included into 6 groups(n=10 in each):normal control group,model control group,Fufang Biejia Ruangan group,low-dose HTXY group,middle-dose HTXY group and high-dose HTXY group.The corresponding drugs were given for 6 weeks.After treatment,the hydroxyproline(Hyp)levels in hepatic tissues were detected by alkali hydrolysis method and the pathological changes of hepatic fibrosis were observed by HE staining and picric acid-sirius red staining.ResultsCompared to normal control and model control groups,the degree of hepatic fibrosis were significantly attenuated in Fufang biejia ruangan group and HTXY decoction groups(P<0.05),and more markedly in middle-dose group.The Hyp levels in hepatic tissues were also significantly decreased in middle-dose HTXY group(P<0.05).ConclusionHTXY decoction can improve hepatic fibrosis and reduce hepatic tissue Hyp levels in rats with experimental hepatic fibrosis.
肝纤维化(hepatic-fibrosis,HF)是慢性肝病向肝硬化转变的必经途径,研究HF对预防肝硬化有深远意义。本课题组挖掘国家名老中医徐珊教授临床数十年治疗HF的经验,结合有关HF文献,提出化痰行瘀法抗HF,并采用其经验方“化痰行瘀汤”进行抗HF疗效实验研究。本文主要阐述化痰行瘀汤对HF大鼠组织病理学及羟脯氨酸(hydroxyproline,Hyp)的影响。
1 材料和方法
1.1 主要药物及试剂的制备 取国家名老中医徐珊临床经验方化痰行瘀汤方(桃仁10g、丹参10g、赤芍10g、郁金10g、浙贝15g、泽泻30g)适量帖数,加水提取2次,第一次加3倍量水,浸泡0.5h,提取1.5h,第二次加1.5倍量水,提取1h,合并煎液,滤过,滤液减压浓缩至1.785g/ml的煎剂,临用前配成0.4464g/ml,0.8925g/ml,1.785g/ml的灌胃液,备用。复方鳖甲软肝片(内蒙古福瑞中蒙药科技股份有限公司产品,批号:20100411)临用前研细用蒸馏水调成0.1mg/l0ml混悬液。40%CCl4橄榄油溶液:取40ml CCl4溶液,加入60ml橄榄油,混匀。5× TBE电泳缓冲液:称取54g Tris,27.5g硼酸,加入20ml 0.5mol/L EDTA(pH 8.0)补充双蒸水至1 000ml,此缓冲液稀释10倍后即为0.5×TBE。
1.2 方法
1.2.1 动物造模 取清洁级健康成年Wistar大鼠60只,雄性,体重(200±20)g,适应性喂养1周后,随机抽取10只作为正常对照组,其余50只采用经典模型复制法[1]按3ml/kg体重每周2次(首次加倍)皮下注射以橄榄油配制的40%CCl4,连续6周。正常对照组每周2次以等容量的橄榄油皮下注射。造模期间对实验动物的进食、饮水不予限制。
1.2.2 模型评价 第6周末,从造模动物中随机处死2只大鼠作HF病理学检查,镜下见中等度HF形成(纤维隔形成并互相连接,深入小叶内,小叶结构保留或紊乱,但无肝硬化),即确定HF模型复制成功[2]。造模结束后大鼠死亡11只,剩余37只大鼠按随机数字表法分为5组:模型对照组10只、复方鳖甲软肝片组7只、化痰行瘀汤低剂量组7只、化痰行瘀汤中剂量组7只、化痰行瘀汤高剂量组6只。
1.3 药物干预 于分组当天开始灌胃给药,复方鳖甲软肝片组以1g/(kg·d)灌胃,化痰行瘀汤低、中、高剂量组分别以50、100、200mg/kg每天灌胃,正常对照组和模型对照组用0.9%氯化钠溶液灌胃,2ml/d,连续给药6周。给药期间正常进食及饮水。
1.4 标本的采集及制备 治疗6周结束后,大鼠禁食不禁水24h,用10%水合氯醛溶液(按4ml/kg体重)腹腔注射麻醉后剖腹,腹主动脉取血,5ml/只,静置2h以上,3 500r/min,离心15min,吸取上清液,移至EP管中,封口,置-80℃冰箱中保存待测。
1.5 观察指标
1.5.1 常规病理学检查 (1)常规苏木素-伊红染色(HE染色);(2)天狼红染色。胶原增生的判断按实验动物HF组织学Ⅳ级标准[3](以下简称“Ⅳ级标准”)光镜下观察肝组织胶原纤维、网状纤维分布。
1.5.2 肝脏组织中羟脯氨酸(Hyp)含量检测 采用样本碱水解法测定Hyp含量,操作步骤如下:(1)准确称取肝组织放入试管中,准确加水解液1.0ml,混匀。加盖后沸水浴水解20min(水解10min混匀一次,目的是使水解更充分);(2)将各试管流水冷却后各管加指示剂1滴,混匀;(3)各管准确加入调pH甲液1.0ml至溶液变红,混匀;(4)各管逐滴小心加入调pH乙液,混匀,至颜色变成黄绿色,pH值在6.0左右;(5)加蒸馏水至 10ml,混匀;(6)取稀释后的检测液3ml加适量活性炭,混匀,3 500r/min,离心10min,取上清液1.0ml直接按表1方法检测。
1.6 统计学处理 采用SPSS13.0统计软件。组间计量资料比较采用t检验,计数资料比较采用χ2检验。
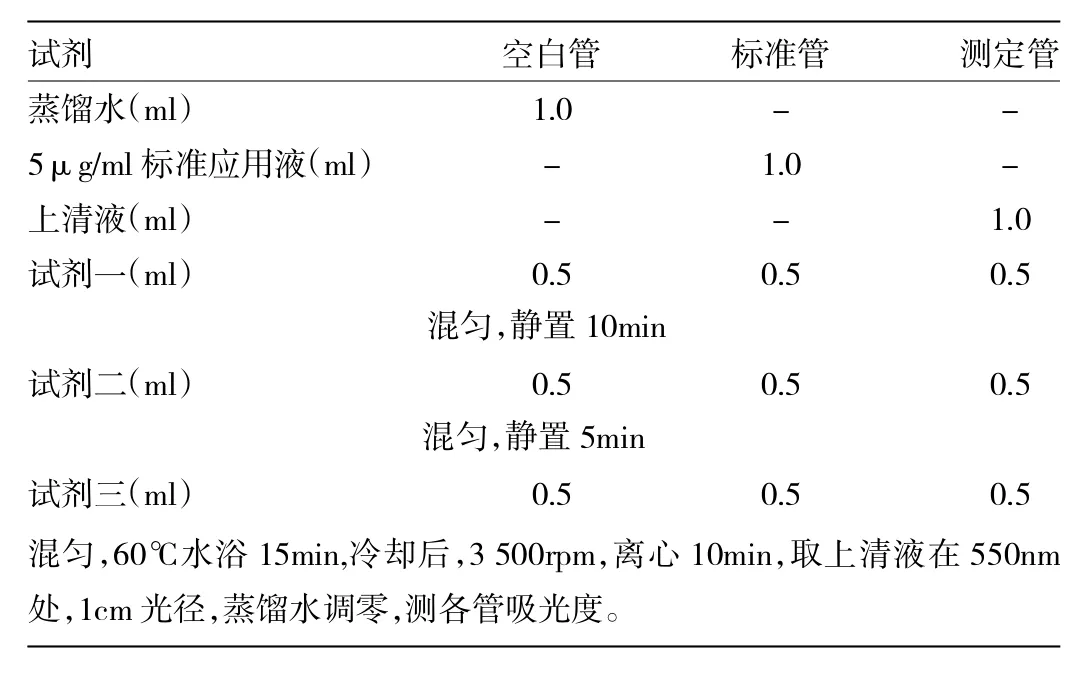
表1 Hyp含量测定操作表
2 结果
2.1 化痰行瘀汤对HF大鼠组织病理学的影响
2.1.1 肝组织HE染色光镜观察 HE染色光镜下观察(图1):正常对照组大鼠肝小叶结构正常,肝细胞围绕中央静脉呈放射状排列,肝窦与汇管区成纤维细胞少(图1A);模型组大鼠肝小叶结构紊乱,肝细胞空泡变性,部分汇管区和小叶内有碎屑坏死,少量炎性细胞浸润,间质细胞大量弥漫增生,纤维组织增生明显,部分出现纤维间隔互相包绕整个肝小叶,假小叶形成(图1B);复方鳖甲软肝片组大鼠肝小叶结构保持相对完整,炎性细胞浸润减少,肝细胞坏死和纤维组织增生明显减轻(图1C);化痰行瘀汤低剂量组大鼠肝小叶结构明显改善,肝细胞变性以脂肪变为主,少量炎性细胞浸润,肝细胞坏死减轻,纤维组织增生减轻(图1D);化痰行瘀汤中剂量组大鼠肝小叶结构保持相对完整,肝细胞坏死和纤维组织增生明显减轻(图1E);化痰行瘀汤高剂量组大鼠肝小叶结构保持相对完整,肝细胞空泡变性减少,炎性反应及坏死减轻,纤维组织增生不明显,接近正常肝组织(图1F)。
2.1.2 肝组织苦味酸-天狼红染色光镜观察 苦味酸-天狼红染色光镜下观察(图2):正常对照组大鼠肝小叶结构清晰,仅在中央静脉及肝窦内有少量胶原纤维分布(图2A);模型组大鼠肝组织汇管区和小叶间可见大量粗大增生的胶原纤维,相邻汇管区之间纤维间隔连接并包绕形成以大方形和小圆形为主的假小叶(图2B);复方鳖甲软肝片组大鼠肝组织汇管区纤维组织延伸明显,部分纤维互相连接包绕整个肝小叶(图2C);化痰行瘀汤低剂量组大鼠肝组织汇管区纤维组织延伸明显,部分纤维间隔形成,包绕整个肝小叶(图2D);化痰行瘀汤中剂量组大鼠肝组织汇管区纤维延伸明显,但未包绕整个肝小叶(图2E);化痰行瘀汤高剂量组大鼠肝组织可见少量胶原纤维自汇管区或中央静脉向外延伸(图2F)。2.1.3 各组肝组织胶原增生程度 见表2。
由表2可见,正常对照组未出现HF表现。各治疗组与模型组比较HF程度差异明显。化痰行瘀汤各剂量组与复方鳖甲软肝片组比较HF程度相近。化痰行瘀汤各剂量组间HF程度相近。

图1 化痰行瘀汤对HF大鼠肝脏组织病理变化的影响(A:正常对照组;B:模型组;C:复方鳖甲软肝片组;D:化痰行瘀汤低剂量组;E:化痰行瘀汤中剂量组;F:化痰行瘀汤高剂量组;HE染色,×200)
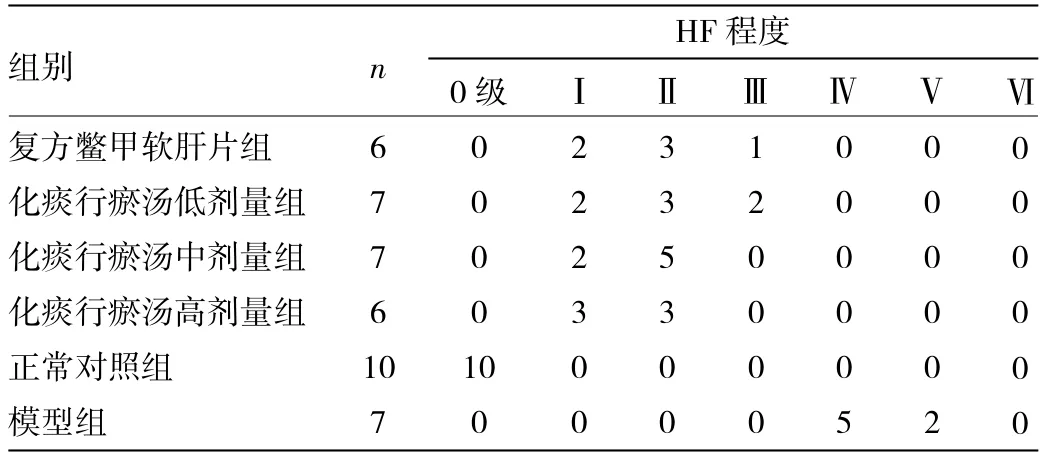
表2 各组大鼠肝脏组织HF分级比较(例)
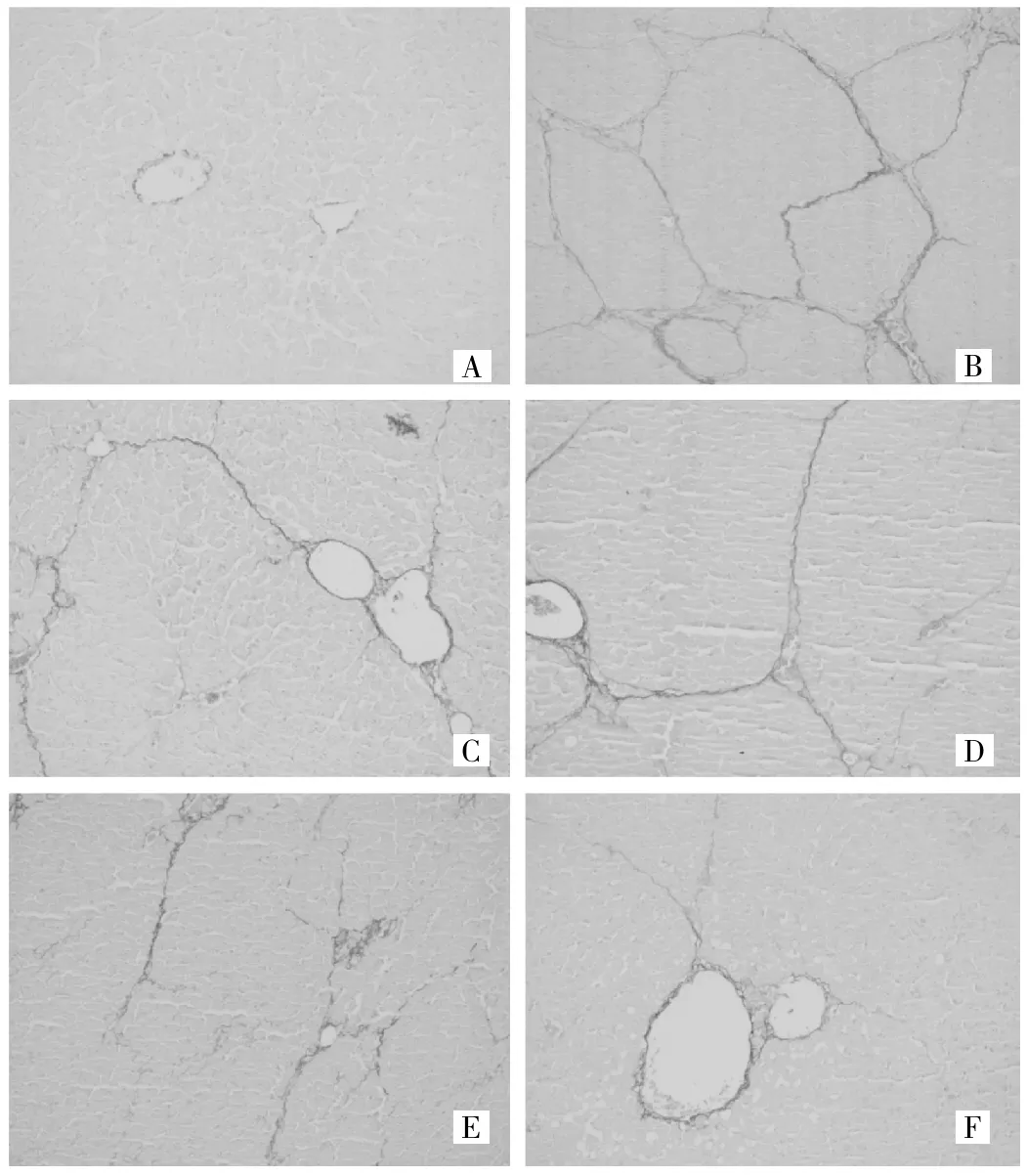
图2 化痰行瘀汤对HF大鼠肝脏组织纤维化程度的影响(A:正常对照组;B:模型组;C:复方鳖甲软肝片组;D:化痰行瘀汤低剂量组;E:化痰行瘀汤中剂量组;F:化痰行瘀汤高剂量组;天狼红染色×200倍)
2.2 化痰行瘀汤对HF大鼠肝脏组织Hyp的影响 见表3。
由表3和图1可见,模型组Hyp较正常对照组显著升高(P<0.05)。各治疗组Hyp都有不同程度的下降,化痰行瘀汤中剂量组下降最为明显(P<0.05)。化痰行瘀汤各剂量组与复方鳖甲软肝片组比较,差异无统计学意义(P>0.05)。化痰行瘀汤各剂量组间比较,Hyp差异无统计学意义(P>0.05)。

表3 化痰行瘀汤对HF大鼠Hyp含量影响比较
3 讨论
HF是指肝组织内细胞外基质(extracellu-larmatrix, ECM)成分过度增生与异常沉积,导致肝脏结构或功能异常的病理变化,是各种慢性肝病共有的病理特征,是发展到肝硬化的必经阶段。而以肝星状细胞(hepatic satellitecel,HSC)为中心环节,由枯否细胞、自然杀伤(naturalkiller,NK)细胞以及其他各种细胞和细胞间相互作用的信号因子共同构成,以综合调控的方式影响HF的进程[4-5]。HSC在HF的形成过程中发挥关键性作用[6-8]。慢性肝损伤通过某些途径激活静止态HSC,活化的HSC产生大量ECM,ECM在Diss间隙内过度沉积,最终导致HF产生[9-10]。HSC与肝NK细胞、枯否细胞、肝细胞以及聚集于肝脏的其他炎症细胞以相应的信号分子为介质,发生复杂交叉感应,打破细胞外基质的生成与降解平衡,触发HF。大量的研究结果证实:HSC激活并转化为肌成纤维样细胞(MFBs)和成纤维细胞(FC)及大量合成、分泌ECM是HF发生发展的核心环节和共同通路[9]。调节HSC活化和ECM代谢是抗HF的关键。
化痰行瘀汤是国家名老中医徐珊教授多年临床治疗HF行之有效的经验方,课题组研究认为HF中医病机是酒食、情志、湿热疫毒、蛊毒等多病因侵犯肝脏,肝的疏泄失职,藏血失调,气滞血瘀,肝脾不和,脾失健运,湿停痰聚,瘀责之肝,痰责之脾,瘀痰互结,故用化痰行瘀法来改善肝组织病理学,达到抗HF效果。
3.1 化痰行瘀汤对HF大鼠组织病理学的影响 HF是肝脏对各种原因所致肝损伤的创伤愈合反应,以肝内ECM过度沉积为特征。胶原纤维为ECM的主要成分之一,观察胶原纤维沉积程度是研究HF的主要方法之一。本实验中通过HE、苦味酸-天狼红染色,观察了化痰行瘀汤对HF大鼠肝组织病理学的影响。光学显微镜下观察显示:模型组肝脏组织脂肪变性、炎性细胞浸润、胶原纤维沉积、肝小叶破坏、假小叶形成,均提示本次实验模型复制成功。化痰行瘀汤各剂量组明显改善HF程度,尤其是高剂量组镜下显示肝小叶结构保持相对完整,仅少量炎性细胞浸润及胶原纤维沉积,提示其具有抗HF作用。HF的病理表现与中医癥瘕积聚关系密切,可以作为癥瘕积聚的微观表现,化痰行瘀汤明显改善了HF程度,这可能与祛湿化痰、活血祛瘀药物软坚散结的作用有关,减少胶原纤维的沉积,从而起到了抗HF的作用。
3.2 化痰行瘀汤对HF大鼠肝脏组织Hyp的影响 Hyp在胶原组织中含量丰富[9],系胶原肽链合成后,在脯氨酸羟化酶作用下,将肽链上的脯氨酸羟化形成,同时已形成的胶原又在胶原酶作用下分解,释放Hyp,而胶原降解后,Hyp不再重复利用,从而使血中Hyp含量增加。肝组织Hyp代表了肝实质内的胶原纤维的增生,较血清Hyp更可以直接反映HF的程度和演变过程。本实验中不同剂量化痰行瘀汤治疗后,肝脏组织Hyp含量都有不同程度下降,表明本方能改善肝脏HF程度。
[1]孟爱红.银杏叶提取物对肝纤维化大鼠肝脏COX-2表达的影响[D].浙江中医药大学,2010.
[2]中华医学会肝病学分会肝纤维化学组.肝纤维化诊断及疗效评估共识[J].中华肝脏病杂志,2002,10:327-328.
[3]Gao B,Jeong W,Tian Z G.Liver:an organ with Predominant innate immunity[J].HePatology,2008,47(2):729-736.
[4] Racanelli V,Rehermann B.The liver as an immunological organ [J].HePatology,2006,43(Suppl1):S54-S62.
[5] Kisseleva T,Brenner D A.Hepatic stellate cells and the reversal of fibrosis[J].J Gastroenterol Hepatol,2006,21(S3):S84-S87.
[6]Henderson N C,Forbes S J.Hepatic fibrogenesis:from within and outwith[J].Toxicology,2008,254(3):130-135.
[7] Atzori L,Poli G,Perra A.Hepatic stellate cell:a star cell in the liver [J].Int J Biochem Cell Biol,2009,41(8-9):1639-1642.
[8] Bataller R,Brenner D A.Liver fibrosis[J].J Clin Invest,2005,115: 209-218.
[9]Friedman S L,Rockey D C,Bissell D M.HePatic fibrosis 2006:Re-Port of the Third AASLD single to Pic conference[J].HePatology, 2007,45(1):242-249.
[10]王宝恩,王惠吉,朱家璇,等.中药复方丹参不同剂型治疗肝纤维化的实验研究与临床观察[J].肝脏病杂志,1993,1(2):69-72.
[11]徐珊,周敏,包剑锋,等.肝纤维化不同证型与肝功能和肝组织羟脯氨酸关系的实验研究[J].中华中医药学刊,2008,26(9):1855-1857.
(本文编辑:田云鹏)
《浙江医学》对计量单位的要求
本刊执行GB 3100~3102-1993《量和单位》中有关量、单位和符号的规定及其书写规则,具体执行可参照中华医学会杂志社编写的《法定计量单位在医学上的应用》。注意单位名称与单位符号不可混用。组合单位符号中表示相除的斜线多于1条时应采用负数幂的形式表示,组合单位中斜线和负数幂亦不可混用,如ng/kg/min应采用ng·kg-1·min-1的形式,不宜采用ng/kg-1·min-1的形式。在叙述中应先列出法定计量单位数值,括号内写旧制单位数值;如果同一计量单位反复出现,可在首次出现时注出法定与旧制单位换算系数,然后只列法定计量单位数值。量的符号一律用斜体字,如吸光度(旧称光密度)的符号“”。血压仍以mmHg表示。
本刊编辑部
Efficacy of Huatan Xingyu Decoction in treatment of hepatic fibrosis in rats
Hua tan xing yu decoction Hepatic fibrosis Rats Histopathology Hydroxyproline
2012-11-21)
310012 杭州,浙江省立同德医院中医内科(陈国中);浙江中医药大学基础医学院(徐珊、张永生、朱飞叶)

