利用磁珠分离联合MALDITOFMS技术判定早期IgA肾病的病理表现
邵丽娜 何强 余捷凯 王慧萍 陈江华
●论 著
利用磁珠分离联合MALDITOFMS技术判定早期IgA肾病的病理表现
邵丽娜 何强 余捷凯 王慧萍 陈江华
目的 利用尿蛋白质组学的新方法,寻找无创性尿液标记物,用以判断临床早期IgA肾病的病理表现。方法 对55例早期IgA肾病患者[其中23例病理表现较重(重病理损伤组),32例病理表现较轻(轻病理损伤组)]及14例病理检查完全正常者(正常对照组)的尿液,利用阳离子磁珠分离技术联合基质辅助激光解吸/电离飞行时间质谱法(MALDI-TOF-MS)分析尿液蛋白质质谱。结果 建立了3个尿蛋白质/多肽模型。发现潜在的生物标志物及其诊断模型可以区分重病理损伤组和轻病理损伤组,其敏感性和特异性分别为90.48%和96.77%。区分轻病理损伤组和正常对照组的诊断模型,其敏感性和特异性分别为93.55%和85.71%。区分重病理损伤组和正常对照组的诊断模型,其敏感性和特异性分别为100%和92.86%。 结论 利用磁珠分离结合MALDI-TOF-MS的尿蛋白质组技术在判定早期IgA肾病的病理表现显示出较大潜力。
IgA肾病 磁珠 基质辅助激光解吸/电离飞行时间质谱法
IgA肾病是最常见的慢性肾小球肾炎类型[1],其典型表现为上呼吸道感染后出现发作性血尿,包括镜下血尿。IgA肾病可缓慢发生肾功能损伤,最终发展为终末期肾病。据报道,约25%~30%的初诊IgA肾病患者20~ 25年后需要肾脏替代治疗[2]。高血压、肾功能损伤和尿蛋白>1g/d是IgA肾病预后不佳的独立预测因素[3]。临床早期IgA肾病具有以下特点:患者年轻,肾小球滤过率在正常范围[eGFR≥60ml/(min·1.73m2)],轻度蛋白尿(24h蛋白尿<1g),血压正常。然而,近来一些研究发现上述临床早期IgA肾病的病理表现往往不轻,有些甚至较重[4-5]。肾穿刺活检可以诊断早期IgA肾病,但该技术有创、风险较大而且费用较高。基于上述原因,笔者希望寻找一种体液生物标记物,用无创的方法来诊断临床早期IgA肾病不同的病理类型。1999年由Williams[6]首次提出的尿蛋白质组学方法是检测尿液生物标记物的重要方法。已有研究利用尿蛋白质组学方法,发现了许多肾脏疾病包括移植肾排斥、肾脏肿瘤、狼疮肾等的生物标记物[7-12]。笔者利用磁珠分离联合基质辅助激光解吸/电离飞行时间质谱法(MALDI-TOF-MS)的新技术,分析了55例早期IgA肾病患者和14例供肾者的尿液,以期发现部分尿液生物标记物,以期判别出病理表现严重的临床早期IgA肾病。
1 对象和方法
1.1 对象 选择2008-01—12浙江大学医学院附属第一医院收治的55例早期IgA肾病患者,其中23例为病理表现较重的患者(重病理损伤组),32例为病理表现较轻的患者(轻病理损伤组)。另择14例病理检查完全正常、拟为亲属活体供肾者作为正常对照组。早期IgA肾病定义:(1)血压<140/90mmHg,未作降压治疗;(2)eGFR≥60ml/(min·1.73m2);(3)24h尿蛋白≤1.0g;(4)排除继发性IgA肾病,如SLE、糖尿病肾病、乙肝相关肾和过敏性紫癜性肾炎。由2位病理专家分别进行肾脏病变的评估和Lee的标准[13]分级。病理诊断定义:(1)轻微病理表现:低于LeeⅢ级;(2)严重病理表现:高于LeeⅣ级,伴或不伴活动性病理改变如细胞性或混合性新月体。所有参与检验的患者均签署知情同意书,并获得浙江大学医学院附属第一医院的伦理委员会通过。评估各项临床指标如血清肌酐、尿酸、胱抑素C、尿蛋白与肌酐比值(ACR)。轻病理损伤组和重病理损伤组间一般资料的差异均无统计学意义(均P>0.05),详见表1。

表1 两组IgA肾病患者一般资料的比较
1.2 试剂和仪器 德国Bruker Daltonics提供的在线MALDI-TOF-MS(microflex)和AnchorChipTM600-μm MALDI靶标和弱阳离子交换磁珠。BD真空采血管SST(Becton Dickinson cat),聚丙烯微量离心管(德国Eppendorf公司),PCR管(荷兰Biozym公司),FEP(Teflon)瓶(美国Nalgene公司),PP(奥地利Greiner公司),0.1% TFA(HPLC级)、100%丙酮、100%乙醇(HPLC级)、100%氰化甲烷(HPLC级)、10mM醋酸铵、α-氰基-4-羟基肉桂酸(HCCA)(美国Sigma公司),肽校准标准(德国Bruker Daltonics公司),蛋白校准标准Ⅰ(德国Bruker Daltonics公司),准备MALDI-TOF-MS的磁珠分离样品(德国Bruker Daltonics公司)。
1.3 方法 患者在经皮肾穿刺活检前、供肾者在取肾前留取10ml尿液,2h内室温下以10 000g/min离心10min,冻存于-70℃。检测前尿样室温冻融30min。将WCX磁珠摇匀。加入10μl缓冲液至200μl的检测管中,再加入10μl的磁珠,混匀,避免气泡。加入5μl的尿样,混匀,避免气泡。经过彻底搅拌,室温下孵育5min,将试管置于磁珠分离装置1min,使得磁珠和液体彻底分离。小心移去上清液,加入100μl磁珠清洁缓冲液。将试管在分离器中重复移除至少10次,静置3 min,再小心移除上清液,重复2次。加入5μl的磁珠洗脱缓冲液,彻底摇匀后置入分离装置2min,然后将上清液转移至干净的0.5ml试管内,加入5μl的磁珠稳定缓冲液。从0.5ml的干净试管中吸取1μl液体到AnchorChipTM600-μm MALDI靶标上,室温下自然干燥。最后,采用MALDITOF-MS分析AnchorChipTM600-μm MALDI靶标上的蛋白质和多肽。
1.4 数据分析 所有的实验数据由俞捷凯设计的浙江大学蛋白芯片数据分析系统进行预处理和建立模型。第一步:用非抽样离散小波转换方法对原始数据并进行信号降噪处理。第二步:根据标记好的出现在所有选定光谱中的3个峰值,调整了信号的强度标记。通过对齐单调的最小曲线和质量校正的方法对光谱进行基线校正。利用一种特殊方法进行蛋白峰值的检测和定量,该方法可以顾及每个降噪、基线校正和校准质谱。第三步:过滤掉信噪比(S/N)>3的峰值。第四步:将各个样本中m/z差异<0.3%的峰值聚为一类。将聚类后只出现在<10%样本中的峰值去掉。对找出的峰值在各个样本中的强度作均一化处理。集内最大高度作为峰值,代表其表达强度。
1.5 数据建立模型 使用非线性支持向量机(support vector machine,SVM)分类器来区分不同的组。支持向量机采用径向基核函数,Gamma值设为0.6,罚分函数(C)设为19。通过留一交叉验证的方法评估和验证诊断模型。特征向量的选取采用统计过滤结合模型依赖性筛选的方法。对每个质荷比峰值行Wilconxon秩和检验,选出P值最小的10个峰值进一步分析。将10个峰值的任意组合用于支持向量机模型的输入,用留一交叉验证法评估模型的预测效果,选出建立支持向量机模型预测的约登指数最高的组合作为最终的候选标志物,建立的模型和留一法交叉验证的结果作为最终的结果。采用SPSS15.0统计软件,计量资料以表示,组间比较采用t检验。
2 结果
2.1 轻病理损伤组和重病理损伤组诊断模型的比较 共检测到21个有意义的蛋白峰值,其中10个作为诊断模型的生物标记物,其敏感性90.48%,特异性96.77%,潜在的蛋白生物标记的质荷比为2 740、3 086、2 747、3 032、2 095、3 328、6 174和2 754,这些潜在的蛋白生物标记在重病理损伤组中表达上调,而其余两个质荷比为3 235和6 189的蛋白生物标记在轻病理损伤组表达上调,详见图1、表2。

图1 诊断模型1 SVM结果散点图
2.2 轻病理损伤组和正常对照组的诊断模型的比较 共检测到50个蛋白峰值,其中选取10个作为诊断模型的生物标记物,其敏感性93.55%,特异性85.71%。3个质荷比为6 190、3 437和3 211的蛋白生物标记在轻病理损伤组表达上调。而其余质荷比为2 088、3 972、2 176、2 386、1 434、5 218和3 876的蛋白生物标记在正常对照组上调,详见图2、表3。
2.3 重病理损伤组和正常对照组的诊断模型的比较 共检测到50个蛋白峰值,其中选取20个作为诊断模型的生物标记物,其敏感性100%,特异性92.86%。质荷比为2 712的蛋白生物标记在重病理损伤组表达上调,其余蛋白生物标记在正常对照组表达上调,详见图3、表4。

表2 作为诊断模型的10个尿液生物标记在各组的表达强度
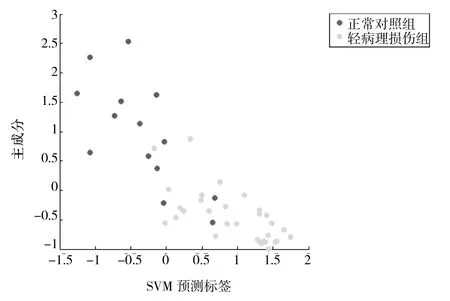
图2 诊断模型2 SVM结果散点图
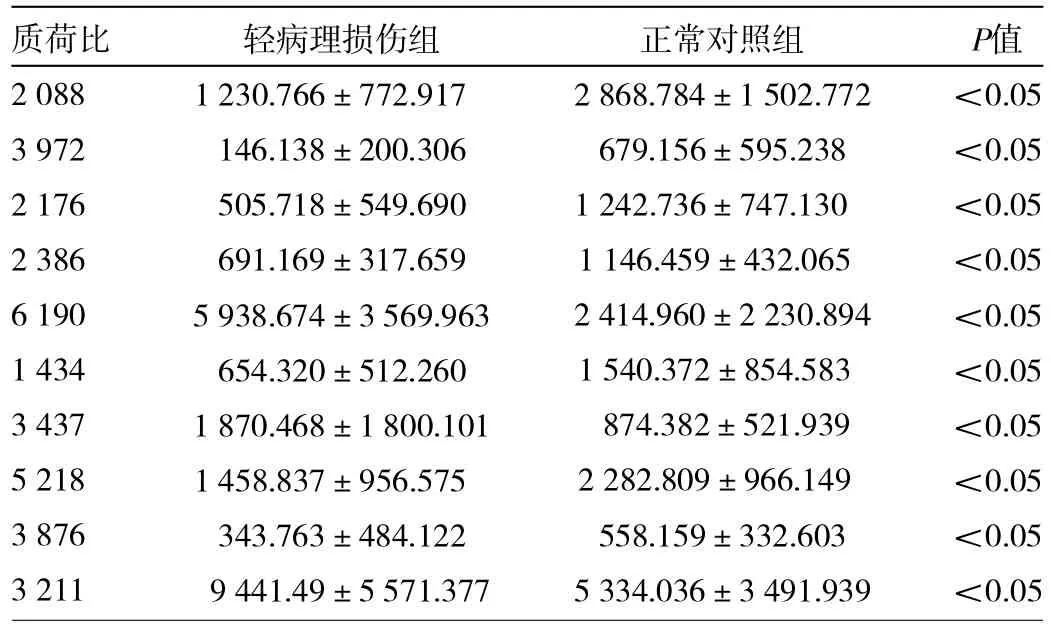
表3 作为诊断模型的10个尿液生物标记在各组的表达强度
3 讨论
临床早期的IgA肾病并不意味着预后良好。Szeto等[14]发现早期IgA肾病有时会进一步发展。中期患者随访7年后,44%的患者出现了严重事件。另外,一些早期IgA肾病往往伴随严重的病理改变,如LeeⅣ级以及出现细胞性新月体。肾穿刺由于风险较高,在许多基层医院无法常规开展。因此,寻找无创的方法来鉴别临床早期IgA肾病的病理表现成为研究热点。异常的尿液往往可以反映肾脏的病变,因此检测尿液的生物标记物成为各个研究的关注点[15-19]。然而,尿液中的成分多种多样,组多数生物标记物往往是小分子蛋白甚至多肽,常规的检测方法如蛋白电泳均无法检测和鉴定。先进的蛋白质组学技术可以进行大量的蛋白质组学研究[15]。MALDI-TOF-MS联合磁珠是其中一种重要的技术方法。通过标准化的多肽组剖析,该方法可以在许多领域对体液进行高效分析[20-21]。本研究采用此方法来鉴定临床早期IgA肾病尿液的生物标记物以及诊断模型。在尿液蛋白多肽谱中,检测出许多有意义的蛋白峰值,通过浙江大学蛋白芯片数据分析系统的处理,利用这些鉴定出来的蛋白峰值建立诊断模型,并显示有较高的敏感性和特异性。
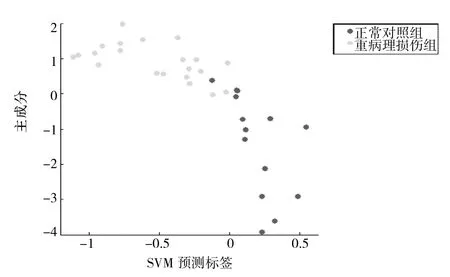
图3 诊断模型3 SVM结果散点图
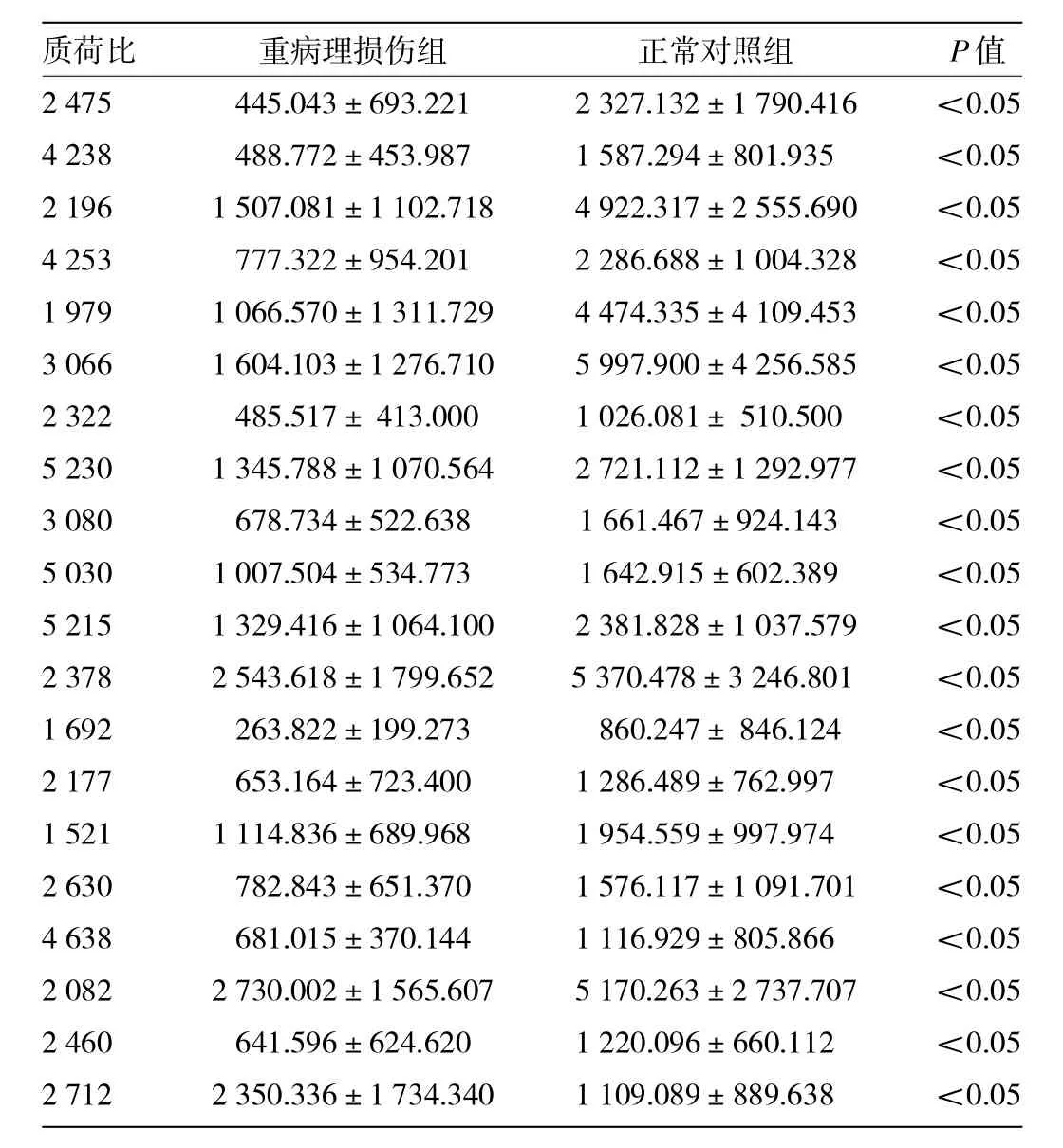
表4 作为诊断模型的20个尿液生物标记在各组的表达强度
MALDI-TOF-MS联合磁珠已经成为一种重要的蛋白质组学技术,在许多领域得到广泛应用。Cheng等[7]鉴定纤维蛋白α链片段是口腔癌的血浆肿瘤标记,其敏感性为100%,特异性为97%。Huang等[20]报道称,该方法作为一种潜在有效的方法可以描绘血清蛋白质组,再结合模式分析,可以建立一个包含4个生物标记的诊断模型用于快速准确地区分SLE、RA、SS和健康对照者。因此,MALDI-TOF-MS联合磁珠方法可以区分患者和健康者。
目前已有一些利用尿蛋白质组学研究IgA肾病的研究。Park等[19]利用2-DE和MALDI-TOF-MS首次对IgA肾病进行尿液蛋白质图谱的描绘。Haubitz[22]报道:利用CE-MS可以鉴别IgA肾病和健康人群、膜性肾病患者,并且具有较高的敏感性和特异性。Yokota等[23]利用2D-DIGE-MS发现α1-微球蛋白可以作为IgA肾病的生物标记物。尽管各自的研究成果都有显著的意义,但是上述各种蛋白质组学方法均不能发现低分子蛋白和多肽,而这些往往有可能就是遗漏的生物标记物。本研究选择弱阳离子交换磁珠作为蛋白质组学的分馏工具。该类磁珠具有强大的阴离子交换能力、疏水正相以及反相、固定的捕获金属的亲和力。WCX磁珠可以在尿液中捕获更多的蛋白,尤其是低分子量的蛋白。
笔者利用磁珠结合蛋白联合MALDI-TOF-MS检测出很多低分子蛋白以及多肽,并建立了早期IgA肾病病理表现重的诊断模型。在模型1中,从轻病理损伤组中鉴定出重病理损伤组的敏感性为90.48%,特异性为96.77%。在模型2中,从正常对照组中鉴定出轻病理损伤组的敏感性为93.55%,特异性为85.71%。在模型3中,从正常对照组中鉴定出轻病理损伤组的敏感性为100%,特异性为92.86%。因此,笔者认为确定这些蛋白质或肽的生物标志物在IgA肾病的诊断和鉴别诊断中显得尤为重要。
本研究首次使用经过病理检测正常,拟为活体供肾者的尿液标本作为对照组,意味着在尿液蛋白组学的研究中是真正的健康对照组,结果更可靠。但样本量少,未来需要更多早期IgA肾病患者进一步验证本研究的模型。
综上所述,利用MALDI-TOF-MS联合磁珠技术,可以寻找到潜在的分子标志物,通过模式分析,建立了早期IgA肾病不同病理类型的3个诊断模型,可以准确地鉴别病理表现较重和较轻的患者。进一步的研究将着眼于这些潜在的蛋白在早期IgA肾病的发病机制的参与。MALDI-TOF-MS联合磁珠技术作为一种高效的蛋白质组学的方法可以在尿蛋白质组研究领域得到更广的应用。
4 参考文献
[1]Donadio JV,Grande JP.IgA nephropathy[J].NEnglJ Med,2002, 347(10):738-748.
[2]Barratt J,Feehally J.IgAnephropathy[J].JAmSoc Nephrol,2005, 16(7):2088-2097.
[3]Li P K,Ho K K,Szeto C C,et al.Prognostic indicators of IgA nephropathy in the Chinese-clinical and pathological perspectives[J].Nephrol Dial Transplant,2002,17(1):64-69.
[4]Lai F M,Szeto C C,Choi P C,et al.Characterization of early IgA nephropathy[J].Am J Kidney Dis,2000,36(4):703-708.
[5]Julian B A,Cannon V R,Waldo F B,et al.Macroscopic hematuria and proteinuria preceding renal IgA deposition in patients with I-gA nephropathy[J].Am J Kidney Dis,1991,17(4):472-479.
[6]Williams K L.Genomes and proteomes:towards a multidimensional view of biology[J].Electrophoresis,1999,20(4-5):678-688.
[7]Cheng A J,Chen L C,Chien K Y,et al.Oral cancer plasma tumor marker identified with bead-based affinity-fractionated proteomic technology[J].Clin Chem,2005,51(12):2236-2244.
[8]Zimmerli L U,Schiffer E,Zürbig P,et al.Urinary proteomic biomarkersincoronaryarterydisease[J].MolCellProteomics,2008, 7(2):290-298.
[9]Rao P V,Lu X,Standley M,et al.Proteomic identification of urinary biomarkers of diabetic nephropathy[J].Diabetes Care,2007, 30(3):629-637.
[10]Zhang X,Jin M,Wu H,et al.Biomarkers of lupus nephritis determined by serial urine proteomics[J].Kidney Int,2008,74(6): 799-807.
[11]Von Zur Muhlen C,Schiffer E,Zuerbig P,et al.Evaluation of urine proteome pattern analysis for its potential to reflect coronaryarteryatherosclerosisinsymptomaticpatients[J].JProteome Res,2009,8(1):335-345.
[12]Schaub S,Rush D,Wilkins J,et al.Proteomic-based detection of urine proteins associated with acute renal allograft rejection [J].J Am Soc Nephrol,2004,15(1):219-227.
[13]Lee S M,Rao V M,Franklin W A,et al.IgA nephropathy:morphologic predictors of progressive renal disease[J].HumPathol, 1982,13(4):314-322.
[14]Szeto C C,Lai F M,To K F,et al.The natural history of immunoglobulin a nephropathy among patients with hematuria and minimal proteinuria[J].Am J Med,2001,110(6):434-437.
[15]Varghese S A,Powell T B,Budisavljevic M N,et al.Urine biomarkers predict the cause of glomerular disease[J].J Am Soc Nephrol,2007,18(3):913-922.
[16]Jahnukainen T,Malehorn D,Sun M,et al.Proteomic analysis of urine in kidney transplant patients with BK virus nephropathy [J].J Am Soc Nephrol,2006,17(11):3248-3256.
[17]Dihazi H,Müller G A,Lindner S,et al.Characterization of diabetic nephropathy by urinary proteomic analysis:identification of a processed ubiquitin form as a differentially excreted protein in diabetic nephropathy patients[J].Clin Chem,2007,53(9): 1636-1645.
[18]Julian B A,Wittke S,Novak J,et al.Electrophoretic methods for analysis of urinary polypeptides in IgA-associated renal diseases[J].Electrophoresis,2007,28(23):4469-4483.
[19]Park M R,Wang E H,Jin D C,et al.Establishment of a 2-D human urinary proteomic map in IgA nephropathy[J].Proteomics, 2006,6(3):1066-1076.
[20]Huang Z,Shi Y,Cai B,et al.MALDI-TOF MS combined with magnetic beads for detecting serum protein biomarkers and establishment of boosting decision tree model for diagnosis of systemic lupus erythematosus[J].Rheumatology(Oxford),2009, 48(6):626-631.
[21]Fiedler G M,Baumann S,Leichtle A,et al.Standardized peptidome profiling of human urine by magnetic bead separation and matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J].Clin Chem,2007,53(3):421-428.
[22]Haubitz M,Wittke S,Weissinger E M,et al.Urine protein patterns can serve as diagnostic tools in patients with IgA nephropathy[J].Kidney Int,2005,67(6):2313-2320.
[23]Yokota H,Hiramoto M,Okada H,et al.Absence of increased alpha1-microglobulin in IgA nephropathy proteinuria[J].Mol Cell Proteomics,2007,6(4):738-744.
Identification of the pathologic presentation of clinical early IgA nephropathy by MALDI-TOF-MS with magnetic beads
Objective To search noninvasive methods to identify the pathologic presentation of early IgA nephropathy through urinary proteomic analysis.Methods Total 55 patients with IgA nephropathy were included in this study,with 23 patients having severe pathologic presentation,and the other 32 having mild ones.The control group included 14 normal subjects.The urinary proteomic spectra from those three groups were generated by Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF MS)with weak cationic exchange magnetic beads. Results Three Urine protein/peptide spectra patterns were established.In pattern one,the potential protein biomarkers could identify the severe group and the mild group,the sensitivity was 90.48%and the specificity was 96.77%.In pattern two,the potential protein biomarkers could identify the mild group and the normal group,the sensitivity was 93.55%and the specificity was 85.71%.In pattern three,The potential protein biomarker could identify the severe group and the normal group,the sensitivity was 100%and the specificity was 92.86%. Conclusion Using MALDI-TOF-MS with magnetic beads to detect urine proteomic patterns shows great potential in identifying early IgA nephropathy with different pathological manifestations.
IgA nephropathy Magnetic beads Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry


2013-08-30)
(本文编辑:严玮雯)
310003 杭州,浙江大学医学院附属第一医院肾脏病中心(邵丽娜、何强、王慧萍、陈江华);浙江大学医学院附属第二医院肿瘤研究中心(余捷凯)
陈江华,E-mail:chenjianghua@zju.edu.cn

