活动性肺结核患者外周血TSPOT.TB测定与细菌学及影像学的关系
陶学芳 王华钧 王建华 李永兴
活动性肺结核患者外周血TSPOT.TB测定与细菌学及影像学的关系
陶学芳 王华钧 王建华 李永兴
目的 探讨活动性肺结核患者外周血γ-干扰素释放分析T-SPOT.TB测定与不同痰结核菌分级及肺部病变程度的关系。 方法 采用T-SPOT.TB技术、根据斑点形成细胞数(SFCs)检测77例初治活动性肺结核患者、14例肺部非结核病变者和12例健康对照者外周血结核抗原特异性的IFN-γ分泌细胞数,结合痰细菌学和影像学检查进行分析。 结果 肺结核组T-SPOT. TB的6KD早期分泌抗原靶点抗原孔(A孔)SFCs为55.00(21.00~102.50),10KD培养滤过蛋白抗原孔(B孔)SFCs为65.00(20.50~152.50),显著高于非肺结核组和健康对照组(P<0.05)。肺结核痰菌分级4+组A孔SFCs为17.00(4.00~31.50),显著低于痰菌阴性组的 82.50(36.25~103.75)、1~9条组的 65.00(28.50~102.50)、1+组的 80.00(32.75~126.25)、2+组 的 90.00(27.50~145.00)和3+组的45.00(18.00~150.00),(U=41.5,17.0,22.5,26.5,30.5;Z=-2.745,-2.980,-3.325,-2.975,-2.377;均P<0.05);痰菌分级4+组B孔SFCs为21.00(2.50~42.50),显著低于痰菌阴性组的85.00(9.00~195.00)、1~9条组的102.50(71.25~193.75)、1+组的92.50(33.25~165.00)、2+组的70.00(34.00~162.50)和3+组的60.00(20.00~140.00),(U=55. 0,10.0,28.5,28.5,36.5;Z=-2.150,-3.413,-3.304,-2.874,-2.031;均P<0.05)。A孔和B孔SFCs在不同病变范围的肺结核患者之间比较差异有统计学意义(F=7.463,3.205;P<0.05),病变范围重度组A孔SFCs为(31.95±51.09),低于轻度组的(99.22±69.09)和中度组(72.43±49.31),(t=3.520,2.845;均P<0.05);病变范围重度组B孔SFCs为(49.42±87.73),低于轻度组(112.39±75.20)和中度组(104.00±94.30),(t=2.505,2.080;均P<0.05)。肺结核空洞组和无空洞组比较,A孔和B孔SFCs均差异无统计学意义(P>0.05)。 结论 过高的痰结核菌负荷抑制肺结核患者外周血特异性T细胞的IFN-γ释放反应,抑制肺结核患者的保护性免疫;肺结核患者外周血IFN-γ分泌细胞数越少,肺部病变程度的越重,但与肺结核空洞形成无关系。
肺结核 γ-干扰素 T-SPOT.TB细菌学 影像学
细菌学和影像学检查是目前肺结核诊断和病情判定的主要依据,痰中结核分枝杆菌的检出是肺结核临床确诊的重要依据,但敏感性低,影像学检查是发现肺结核和了解病情变化必不可少的手段,但特异性远远低于细菌学检查。近年来研究发现以6KD早期分泌抗原靶点(ESAT-6)和10KD培养滤过蛋白(CFP-10)为结核特异性刺激抗原的T细胞酶联免疫斑点试验(TSPOT.TB)对结核病诊断具有灵敏、特异、快速等特点[1],可弥补肺结核诊断细菌学和影像学检查的不足,本研究通过痰细菌学和影像学检查以确定肺结核严重程度,采用T-SPOT.TB技术、根据斑点形成细胞数(SFCs)来检测活动性肺结核患者外周血结核抗原特异性的IFN-γ分泌细胞数,探讨活动性肺结核患者IFN-γ释放反应与疾病严重程度之间的关系,从而为评估肺结核病情提供帮助。
1 对象和方法
1.1 研究对象 收集2011年1至12月在我院呼吸内科新诊断或初治<2周的菌阳和菌阴活动性肺结核患者77例,其中男42例,女35例,年龄18~81岁,平均(43.95±17.52)岁。痰抗酸杆菌涂片阳性61例,阴性16例,经培养证实所有阳性者为结核分枝杆菌感染,所有阴性肺结核诊断符合2001年中华医学会结核病学分会制订的《肺结核诊断和治疗指南》[2]。应用齐一尼抗酸染色法进行痰抗酸杆菌涂片痰菌分级:阴性者16例,1~9条者10例,1+者14例,2+者13例,3+者11例,4+者13例。肺部X线检查确定病变范围[3]:轻度25例,中度33例,重度19例,肺部有空洞病变35例,无空洞者42例。排除标准:(1)复治肺结核或初治≥2周者;(2)急性病毒感染者;(3)孕妇;(4)合并矽肺、糖尿病、肿瘤等患者;(5)人免疫缺陷病毒检测抗体阳性。另外选取14例有肺部疾病(非肺结核)患者和12例健康体检者作为对照,14例非结核肺部疾病者包括支气管扩张8例,肺部慢性炎症4例,中间支气管狭窄1例,肺炎性假瘤1例。
1.2 方法
1.2.1 标本采集 采集研究者外周静脉血8ml,加人含枸橼酸钠的CPT血管内,18℃,1 600g离心28min,将单个核细胞层从CPT管中转移到新的干无菌15ml尖底离心管中,加入10ml AIM-V培养液,18℃600g离心7min,离心后小心去除上清液,加入1ml AIM-V,轻缓重旋细胞沉淀,加入AIM-V培养液至10ml,18℃350g离心7min。离心后小心弃去上清液,加入0.7ml AIM-V培养液重悬细胞。将混匀的细胞悬液稀释后进行计数,根据计数结果调整细胞悬液浓度为2.5×106/ml。
1.2.2 酶联免疫斑点试验 T-SPOT.TB试剂盒(英国Oxford Immunotec公司生产)由上海复兴长征医学科学有限公司提供。在已包被抗IFN-γ抗体微量板的4个孔中,分别加人50μl AIM-V细胞培养液作为阴性对照,50μl植物血凝素作为阳性对照,50μl结核杆菌特异混合多肽A即ESAT-6抗原作为测试孔A,50μl结核杆菌特异混合多肽B即CFP-10抗原作为测试孔B,然后在每个孔中加人含250 000个细胞的上述悬液。把微量板放入37℃,5%CO2培养箱培养16~20h,用PBS洗板4次,加入50μl新鲜配制的碱性磷酸酶标记的小鼠抗IFN-γ单克隆抗体,将培养板在2~8℃孵育1h。孵育后用PBS液洗板4次。最后每孔加入底物工作液50μl,室温反应7min。以蒸馏水冲洗终止反应,在37℃2~3h或室温过夜干燥培养板,计数SFCs。
1.2.3 结果判断 根据抗原A或/和抗原B孔的反应判断结果:(1)如果阴性对照孔SFCs为0~5,(抗原A或/和抗原B孔SFCs)-(阴性对照孔SFCs)≥6视为阳性;当阴性对照孔SFCs≥6,(抗原A或/和抗原B孔SFCs)≥2×(阴性对照孔孔SFCs)视为阳性[4]。
1.3 统计学处理 采用SPSS12.0软件分析,正态分布的计量资料以表示,偏态分布的计量资料以中位数(p25~p75)表示,多个样本均数比较采用单因素方差分析,两样本均数的比较采用t检验,偏态分布的计量资料多组间的比较采用多个独立样本Kruskal-Wallis H检验,组间两两比较采用Mann-Whitney U检验。
2 结果
2.1 各组全血T-SPOT.TB的测定 肺结核组T-SPOT. TB的A孔、B孔SFCs显著高于非肺结核组和健康对照组,对其进行多个独立样本Kruskal-Wallis H检验,A孔χ2=40.55,B孔χ2=36.66,均P<0.05,结果见表1。采用Mann-Whitney U检验分别对3组进行两两比较,A孔SFCs肺结核组显著高于肺部病变非肺结核组(U= 86,Z=-4.985,P<0.05),肺结核组显著高于健康对照(U=77,Z=-4.627,P<0.05);B孔SFCs肺结核组显著高于肺部病变非肺结核组(U=110.5,Z=-4.715,P<0.05),肺结核组显著高于健康对照组(U=93.5,Z=-4.428,P<0.05)。

表1 3组人群SFCs结果比较
2.2 肺结核患者不同痰菌分级的T-SPOT.TB SFCs比较 见表2。
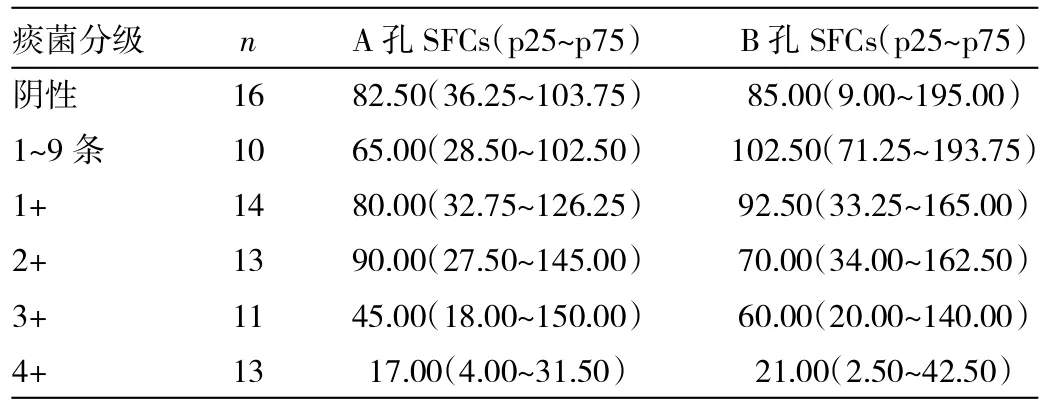
表2 肺结核患者不同痰菌分级的T-SPOT.TB SFCs比较
由表2可见,肺结核痰菌分级4+者A孔SFCs显著低于痰菌阴性(U=41.5,Z=-2.745,P=0.006)、1~9条(U= 17.0,Z=-2.980,P=0.003)、1+(U=22.5,Z=-3.325,P= 0.001)、2+(U=26.5,Z=-2.975,P=0.003)及3+(U=30.5,Z=-2.377,P=0.017)者;B孔SFCs显著低于痰菌阴性(U=55;Z=-2.15,P=0.032)、1~9条(U=10.0,Z=-3.413,P=0.001)、1+(U=28.5,Z=-3.034,P=0.002、2+(U=28.5, Z=-2.874,P=0.004)及3+(U=36.5,Z=-2.031,P=0.042)者,差异均有统计学意义,肺结核痰菌分级阴性、1~9条、1+、2+、3+者A孔SFCs和B孔SFCs的组间两两比较差异均无统计学意义(均P>0.05)。
2.3 肺结核患者不同病变范围的T-SPOT.TB SFCs比较 见表3。
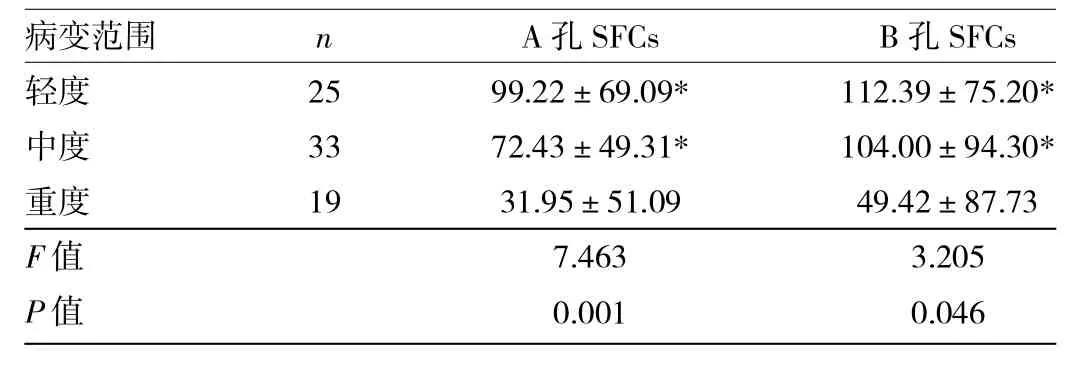
表3 肺结核患者不同病变范围的T-SPOT.TB SFCs比较
由表3可见,A孔和B孔SFCs不同病变范围的肺结核患者之间比较差异有统计学意义(P<0.05);病变范围重度者A孔SFCs低于轻、中度者(t=3.520、2.845,均P<0.05),病变范围重度者B孔SFCs低于轻、中度者(t=2.505、2.080,均P<0.05),病变范围轻、中度者比较A孔和B孔SFCs差异均无统计学意义(均P>0.05)。2.4 肺结核空洞组和无空洞组T-SPOT.TB SFCs比较 见表4。
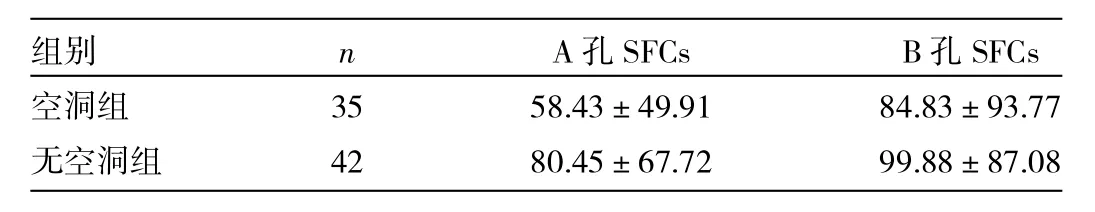
表4 肺结核空洞组和无空洞组T-SPOT.TB SFCs比较
由表4可见,肺结核空洞组与无空洞组比较,A孔和B孔SFCs差异均无统计学意义(均P>0.05)。
3 讨论
宿主感染结核分枝杆菌受T细胞与单核巨噬细胞及其细胞因子网络介导的免疫反应控制,IFN-γ在这个过程中起主要作用,IFN-γ受体缺陷的患者可发生严重的结核分枝杆菌病。感染结核分枝杆菌的机体存在特异性记忆性T淋巴细胞,当再次遇到结核特异性抗原刺激时,转化为效应T淋巴细胞,释放IFN-γ,ESAT-6和CFP-10是结核分枝杆菌复合群基因RD1区域rv3875和rv3874编码的结核特异性蛋白抗原,可从MTB感染者的T细胞中诱导出较强的IFN-γ释放反应[4],根据以上原理而设计的T-SPOT.TB在诊断结核感染方面具有良好的敏感性和特异性,在国内外被广泛用于结核感染的诊断,但与肺结核的严重程度及临床特征的相关性研究国内尚未见报道。
本研究显示肺结核患者的外周血IFN-γ分泌细胞数显著高于对照组,与文献报道一致[5],是由于结核患者外周血的大多数CD4+T细胞在试管内对结核分枝杆菌产生Th1型的细胞免疫反应,CD4+T细胞是活化巨噬细胞的IFN-γ主要来源,IFN-γ为Th1辅助T细胞的特征性细胞因子。目前痰结核菌培养阳性是确诊肺结核的标志物,而且根据痰涂片细菌分级而确定的细菌负荷是用来评估肺结核严重程度的标志物。Tsao等[6]发现高细菌负荷肺结核患者的BALF中IFN-γ水平最高,因此认为IFN-γ是局部炎性部位的细菌负荷标志物;本文为研究肺结核患者外周血IFN-γ分泌细胞数是否可作为替代或补充痰细菌学检查的可靠生物学标志物,进行TSPOT.TB检测,分析肺结核患者不同痰菌分级与外周血SFCs的关系,结果发现肺结核患者痰菌分级3+以下者痰菌分级与T-SPOT.TB的检测结果无相关性,而痰菌分级4+者SFCs显著减少,这表明高菌负荷的肺结核患者的外周血T细胞在受到特异性结核抗原刺激后存在产生IFN-γ缺陷。Wang等[7]认为高浓度的ESAT-6可抑制T细胞增殖,可通过减少与IFN-γ近端启动子相结合的转录因子ATF-2、c-Jun、CREB的表达,从而抑制mRNA的表达和IFN-γ的产生;结核病局部炎性部位抗原反应细胞的隔室化作用,外周血中循环的结核特异性T细胞减少,使得高菌负荷的肺结核患者外周血IFN-γ分泌细胞数减少。Tsao等[6]的研究结果与此结论具有一致性;结核病免疫反应包括Th1介导的结核病保护性免疫和Th2介导的以组织坏死为特征的病原性变态免疫反应,高菌负荷导致以组织坏死为特征的延缓型变态反应占优势,保护性免疫受抑制,故高菌负荷肺结核患者外周血IFN-γ分泌细胞数减少。过高的细菌负荷抑制肺结核患者外周血特异性T细胞的IFN-γ释放反应,抑制肺结核患者的保护性免疫,但因为肺结核存在免疫反应隔室化作用,为评估疾病严重程度与T细胞IFN-γ释放反应关系,不仅是在外周血而且在感染局部需要进一步研究,肺结核患者外周血和BALF中的TSPOT.TB联合检测对于评估肺结核严重程度将有更大的临床意义。
以灭菌为核心的保护性免疫反应和以组织坏死为特征的病原性的变态反应两个分离的免疫学反应构成了结核病免疫学的主要内容,两者的平衡在肺结核的发生、发展、转归中起重要作用,与疾病的严重程度密切相关。CD4+T介导、IFN-γ为效应细胞因子的保护性免疫反应可通过活化巨噬细胞,抑制结核病进展,这类反应占优势的患者病变较轻,受损范围较小,而组织坏死的变态反应以变态反应T细胞(TDTH)为效应细胞、TNF-α作为主要效应细胞因子,损害宿主组织,这类变态反应占优势的患者肺组织受损严重。Dlugovitzky等[8]比较肺结核不同程度病变范围与IFN-γ水平的关系,发现重度肺结核患者的IFN-γ水平显著低于中度肺结核患者,本研究也发现肺结核患者外周血IFN-γ分泌细胞数越少,肺部病变程度越重,肺结核患者外周血IFN-γ释放反应与肺组织损伤程度密切相关,但是空洞肺结核患者的IFN-γ释放水平与无空洞肺结核患者比较无显著差异,是由于空洞是否出现是感染细菌的数量、毒力及机体免疫功能共同作用的结果,结核菌的毒力或许对空洞形成的影响更大。
结核病是T介导的保护性免疫反应和病原性的变态反应调控失衡的免疫性疾病,更高的痰菌负荷者外周血IFN-γ释放反应低下,保护性免疫反应好的肺结核患者肺部病变较轻,因此细菌不是结核病发生、发展的全部病因,肺结核患者建立肺结核的影像学-病原学-免疫学诊断系统对于判断肺结核病情及疗效观察上有重要意义,T-SPOT.TB可作为肺结核严重程度及临床预后评估的免疫学检测手段,对于指导结核病的免疫治疗也有重要意义,有利于改善肺结核患者的预后,但是检测步骤繁琐,费用昂贵限制了该检测在临床的应用,因此发展结核病的免疫学诊断需要我们从结核病免疫应答的模式去探索更简便、价廉而且敏感、特异的检测方法,便于临床推广,以更有效地控制结核病。
[1] 邹盛华,张丽水,黄明翔,等.结核感染T细胞斑点实验临床检测研究[J].中国防痨杂志,2009,31(9):539-542.
[2] 中华医学会结核病分会.肺结核诊断和治疗指南[J].中华结核和呼吸杂志,2001,24(2):70-74.
[3] 谢惠安,阳国太,林善梓,等.现代结核病学[M].北京:人民卫生出版社, 2000:235.
[4]刘菲,张宗德,操敏,等.酶联免疫斑点检测和结核菌素试验在初治肺结核中的辅助诊断价值[J].中国医学科学院学报,2009,31(4):443-448.
[5] 陈心春,廖明凤,朱秀云,等.结核菌特异性I F N-γ Elispot检测在活动性结核病和结核感染诊断中的应用[J].中国防痨杂志,2010,32(11): 747-751.
[6]Tsao T C,Huang C C,Chiou W K,et al.Levels of interferon-gamma and interleukin-2 receptor-alpha for bronchoalveolar lavage fluid and serum were correlated with clinical grade and treatment of pulmonary tuberculosis[J].Int J Tuberc Lung Dis,2002,6(8): 720-727.
[7]Wang X,Barnes P F,Dobos-Elder K M,et al.ESAT-6 inhibits production of IFN-gamma by Mycobacterium tuberculosis-re-sponsive hummam T cells[J].J Immunol,2009,182(6):3668-3677.
[8]Dlugovitzky D,Bay M L,Rateni L,et al.Influence of disease severity on nitrite and cytokine production by peripheral blood mononuclear cells(PBMC)from patients with pulmonary tuberculosis(TB)[J].Clin Exp Immunol,2000,122(3):343-349.
Bacterial and radiographic correlates of the detection about peripheral-blood T-SPOT.TB in patients with active pulmonary tuberculo-sis
Objective To determine the relationship between the interferon-γ release assays measured by T-SPOT.TB in peripheral blood and mycobacterium tuberculosis smear grading and radiographic extent of disease in patients with active pulmonary tuberculosis.Methods T-SPOT.TB assay was used to determine spot-forming cells(SFCs)formed by T-cell which release interferon-γ when stimulated by Mycobacterium tuberculosis-specific antigens in 77 patients with active tuberculosis,14 case controls with non-tuberculosis lung diseases and 12 healthy controls,then the SFCs were compaired with bacteriological and radiographic presentations in new cases of pulmonary tuberculosis. Results The SFCs of A hole in response to ESAT-6 and B hole in response to CFP-10 in pulmonary tuberculosis group were 55.00(21.00-102.50)and 65.00(20.50-152.50),respectively,which were all significantly higher than those in controls(P<0.05).The SFCs of A hole and B hole in pulmonary tuberculosis patients with mycobacterium tuberculosis grade of 4+were 17.00(4.00-31.50)and 21.00(2.50-42.50),respectively.The SFCs of A hole in pulmonary tuberculosis patients with mycobacterium tuberculosis grade of negative,1-9institias,1+,2+and 3+were 82.50(36.25-103.75),65.00(28.50-102.50)、80(32.75-126.25),90.00(27.50-145.00)and 45.00(18.00-150.00),and the SFCs of B hole were 85.00 (9.00-195.00),102.50 (71.25-193.75),92.50(33.25-165.00),70.00(34.00-162.50)and 60.00(20.00-140.00),respectively.The SFCs of A hole in pulmonary tuberculosis patients with mycobacterium tuberculosis grade of4+ were significantly higherthan thoses in patients with grade ofnegative,1-9 institias,1+,2+ and 3+(U=41. 5,17.0,22.5,26.5,30.5;Z=-2.745,-2.980,-3.325,-2.975,-2.377;P<0.05),so as the SFCs of B hole(U=55.0,10.0,28.5,28.5,36.5;Z=-2.150,-3.413,-3.304,-2.874,-2.031;P<0.05).There were statistical significance about the SFCs of A hole and B hole compared with different extent of disease(F=7.463,3.205;P<0.05).The SFCs of A hole in patients with advance disease,minimal disease and moderate disease were(31.95±51.09),(99.22±69.09)and(72.43±49.31),and the SFCs of B hole were(49.42± 87.73),(112.39±75.20)and(104.00±94.30),respectively.The SFCs of A hole in patients with advance disease were significantly lower than minimal disease and moderate disease (t=3.520,2.845;P<0.05),so as the SFCs of B hole(t=2.505,2.080;P<0.05). There were no statistical significance about the SFCs of A hole and B hole compared with cavity and no cavity. Conclusion Exorbitant bacterial burden of mycobacterium tuberculosis depressed the interferon-γ release assays formed by tuberculosis-specific T-cell in patient,s peripheral blood,so that may inhibit protective immunity in patients with pulmonary tuberculosis. SFCs formed by T-cell which release interferon-γin patient,s peripheral blood were decreased with the severity of the extent of disease and found to be lower in advance disease,but had no relationship with cavity of pulmonary tuberculosis.
Pulmonary tuberculosis Interferon-γ T-SPOT.TB,bacteriology radiology
)
(本文编辑:田云鹏)
绍兴市科技计划项目(2011A33007)
312000 绍兴市第六人民医院呼吸内科
陶学芳,E-mail:txf218@sina.com

