马铃薯花色苷生物合成与调控研究进展
陈敏,杨清
(南京农业大学生命科学院,江苏南京210095)
综述
马铃薯花色苷生物合成与调控研究进展
陈敏,杨清*
(南京农业大学生命科学院,江苏南京210095)
花色苷是植物中一类由花青素与单糖结合形成糖苷类物质,因其抗氧化功能而具有较高的营养保健价值。马铃薯花色苷在薯皮、薯肉、匍匐茎、花、根、茎、叶中均有分布,主要存在于细胞的液泡中。研究表明,不同品种马铃薯块茎中花青素种类和含量存在差异,主要有6种:天竺葵素、矢车菊素、芍药色素、飞燕草素、锦葵色素和矮牵牛素。目前,花色苷合成途径已经清楚,其中涉及两类基因:一类是结构基因,其编码生物合成途径中所需的酶;另一类是调节基因,其编码的转录因子调控结构基因表达的强度和程度,影响花色苷的时空积累。该综述对马铃薯花色苷生物合成、相关基因克隆、功能及其应用研究进行详细介绍,并对彩色薯的育种研究提出了可行性建议。
马铃薯;花色苷;基因;功能;应用
马铃薯是世界四大粮食作物之一,栽培广泛,几乎遍布世界各地[1,2]。马铃薯块茎营养丰富,除含有淀粉、糖类、蛋白质外,还含多种抗氧化剂,如多酚、维生素C、类胡萝卜素、硒等。花青素(Anthocyanidin)又名花色素,属多酚类化合物,是一种水溶性天然色素。在植物体内,花青素常与各种单糖结合形成糖苷,称为花色苷(Anthocyanin),花色苷是一种天然的抗氧化剂,具有抗氧化活性、抗衰老、防止血管硬化的功能,是一种潜在的抗癌化合物,在彩色马铃薯中含量丰富[3-12]。花色苷作为马铃薯重要的次生代谢物质,已成为当前功能性食品开发的热点之一,正受到越来越多国家科学家的关注和研究,但是我国在马铃薯花色苷研究领域相对滞后,还属于起步阶段[13-16]。本文就马铃薯花色素苷种类结构及分布,合成途径中的结构基因和调节基因及其应用研究现状进行综述,为马铃薯天然色素资源的开发利用与彩色马铃薯育种提供参考。
1 马铃薯花色苷的种类、结构和分布
1.1 花色苷的种类和结构
花色素基本结构是2-苯基苯并呋喃即花色基元,大多数花色素在花色基元的3-、5-、7-碳位上有取代羟基,由于A环和B环各碳位上的取代基不同,形成了各种各样的花色素,花色素及苷元常与一个或多个葡萄糖、鼠李糖、半乳糖、阿拉伯糖等通过糖苷键形成花色苷[17-19]。对于马铃薯花色苷的研究主要集中在块茎组织。彩色马铃薯块茎中主要有6种花色素,分别是:天竺葵素、矢车菊素、芍药色素、飞燕草素、锦葵色素和矮牵牛素(图1)。马铃薯块茎组织中各种花色素一般在C3位经过氧-糖苷键实现1个芸香糖基取代,在苷元的C5位或者以氧-糖苷键实现单葡萄糖基取代或者不发生取代,形成花色苷,花色苷常在C3位二糖取代基上或在C5位的单糖取代基上进一步发生反式单酰基取代,实现酰基取代的酚酸多为对香豆酸,其次为阿魏酸和咖啡酸[20-22]。研究发现,紫色薯中主要含锦葵素,红色薯中则为天竺葵素,不同品种彩色薯花色素种类和含量存在差异,同一颜色块茎所含花色素种类也可能不同,另外,花色素的含量还受养分、低温、贮存时间等因素影响[21]。花色苷也会影响马铃薯地上组织的成色,花中的花色苷与块茎中的花色苷种类也不尽相同,在马铃薯紫花中出现矮牵牛素苷和飞燕草素苷及杨梅黄酮,红花中有矢车菊素苷及栎皮酮,马铃薯紫芽中含有矮牵牛素和芍药色素,黄酮醇的糖苷广泛存在于花中,所带糖常为葡萄糖和鼠李糖。Harborne[23]在马铃薯栽培种的花中共发现了10种花色素,包含堪非醇、杨梅酮和栎皮酮。挪威的一个马铃薯品种的芽中也检测出芍药色素和矮牵牛素[20]。

图1 马铃薯块茎花色素结构与种类Figure 1 Structure and types of anthocyanins in potato tuber
1.2 马铃薯花色苷的分布
马铃薯花色苷在薯皮、薯肉、匍匐茎、花、根、茎、叶中均有分布[24]。花色苷分布存在组织和品种差异。一般在块茎中的含量高于其他组织。马铃薯块茎的皮色有白色、黄色、粉红色、红色、蓝色和紫色。块茎的肉色一般为白色、浅黄色、黄色、红色、蓝色和紫色。皮和/或肉是紫、浅红或红色的称为彩色薯,彩色薯中花色苷含量又相对高于其他品种(图2)[25]。在细胞水平,Kosieradzka等[26]的研究发现,花色苷主要集中在细胞的液泡中。
2 马铃薯花色苷生物合成途径
花色苷的生物合成途径在茄科模式植物矮牵牛(Petunia hybrida)中已经研究得较为清楚,可分为以下四个阶段[27-30]。

图2 彩色马铃薯块茎Figure 2 Tubers of colorful potatoes
第一阶段生成4-香豆酰CoA,由苯丙氨酸逐步生成4-香豆酰CoA,这是许多次生代谢共有的,该步骤受苯丙氨酸解氨酶(Phenylalanine ammonialyase,PAL)活性调控。苯丙氨酸由苯丙氨酸解氨酶催化生成肉桂酸,肉桂酸在肉桂酸-4-羟化酶(Cinnamate 4-hydroxylase,C4H)作用下生成4-香豆酸,4-香豆酸在4-香豆酸CoA连接酶(4-coumarate:CoA ligase,4CL)的催化下生成4-香豆酸CoA。
第二阶段生成二氢黄酮醇,是类黄酮代谢的关键反应,4-香豆酸CoA与另一前体丙二酰CoA由查尔酮合酶(Chalcone synthase,CHS)催化,二者缩合成黄色的柚皮素查尔酮,柚皮素查尔酮在查尔酮异构酶(Chalcone isomerase,CHI)作用下生成无色的柚皮素黄烷酮,该步也可自发完成,柚皮素黄烷酮进一步在黄烷酮3-羟基化酶(F3H,flavanone 3-hydroxylase)催化下形成无色的二氢黄酮醇。
第三阶段生成花色素,二氢黄酮醇可以直接进一步在二氢黄酮醇还原酶(Dihydroflavonol 4-reductase,DFR)作用下还原成无色花色素,也可以先在类黄酮3'-羟基化酶(Flavonoid 3'-hydroxylase, F3'H)或类黄酮3'5'-羟基化酶(Flavonoid 3'5'-hydroxylase,F3'5'H)作用下分别生成二氢槲皮素或二氢杨梅黄酮,再由二氢黄酮醇还原酶(DFR)催化还原成无色花色素,二氢槲皮素也可以在F3'5'H作用下生成二氢杨梅黄酮,在由DFR还原成无色花色素,这主要取决于不同的品种,无色花色素转变成有色花色素由花色素合酶(Anthocyanidin synthase, ANS)催化完成。
第四阶段生成花色苷,有色花色素在类黄酮3-O-葡萄糖基转移酶(UDP-glucose:flavonoid-3-oglucosyltransferase,3GT)催化生成花色苷(Anthocyanin),它还可以在其它酶的作用下进一步糖基和酰基化,转运到液泡贮存,从而提高其稳定性。
3 马铃薯花色苷生物合成基因
花色苷形合成涉及多种基因。它们可分为两大类:一类是结构基因,其编码生物合成途径中所需的酶;另一类是调节基因,其编码的转录因子调控结构基因表达的强度和程度,影响色素的时空积累[31]。
3.1 结构基因
目前马铃薯花色苷生物合成途径中主要结构基因已经被克隆出来。Jung等[32]以矮牵牛F3'5'H为探针,通过扫描由马铃薯的花和茎构建的cDNA文库,获得了马铃薯F3'5'H全长cDNA及其基因序列。De Jong等[33]以番茄DFR为探针,通过扫描由马铃薯的花和茎构建的cDNA文库,获得了马铃薯DFR全长cDNA及其基因序列。通过序列比较发现它编码的382个氨基酸残基中有10个与另二个等位基因的氨基酸残基不同,这可能与其底物特异性有关。同时在分离到的二个DFR全长cDNA中存在BamHI酶切位点的多态性,内含子中存在DraI酶切位点的多态性。后来,研究人员已先后从马铃薯野生种与栽培种中克隆到一些马铃薯花色苷生物合成途径中的结构基因(表1),如CHS、CHI、F3H、F3'5'H、DFR、ANS及3GT。比较两种不同来源的CHI发现,野生种与栽培种的结构基因同源性较高,达到90%以上,说明马铃薯的花色苷结构基因在遗传选择中变异系数低,高度保守。在基因结构方面,如图3所示,3GT和CHI基因不含内含子,而CHS、F3H、DFR与ANS基因则含有一至数个内含子[36,38],提示基因在转录翻译水平上存在识别修饰。
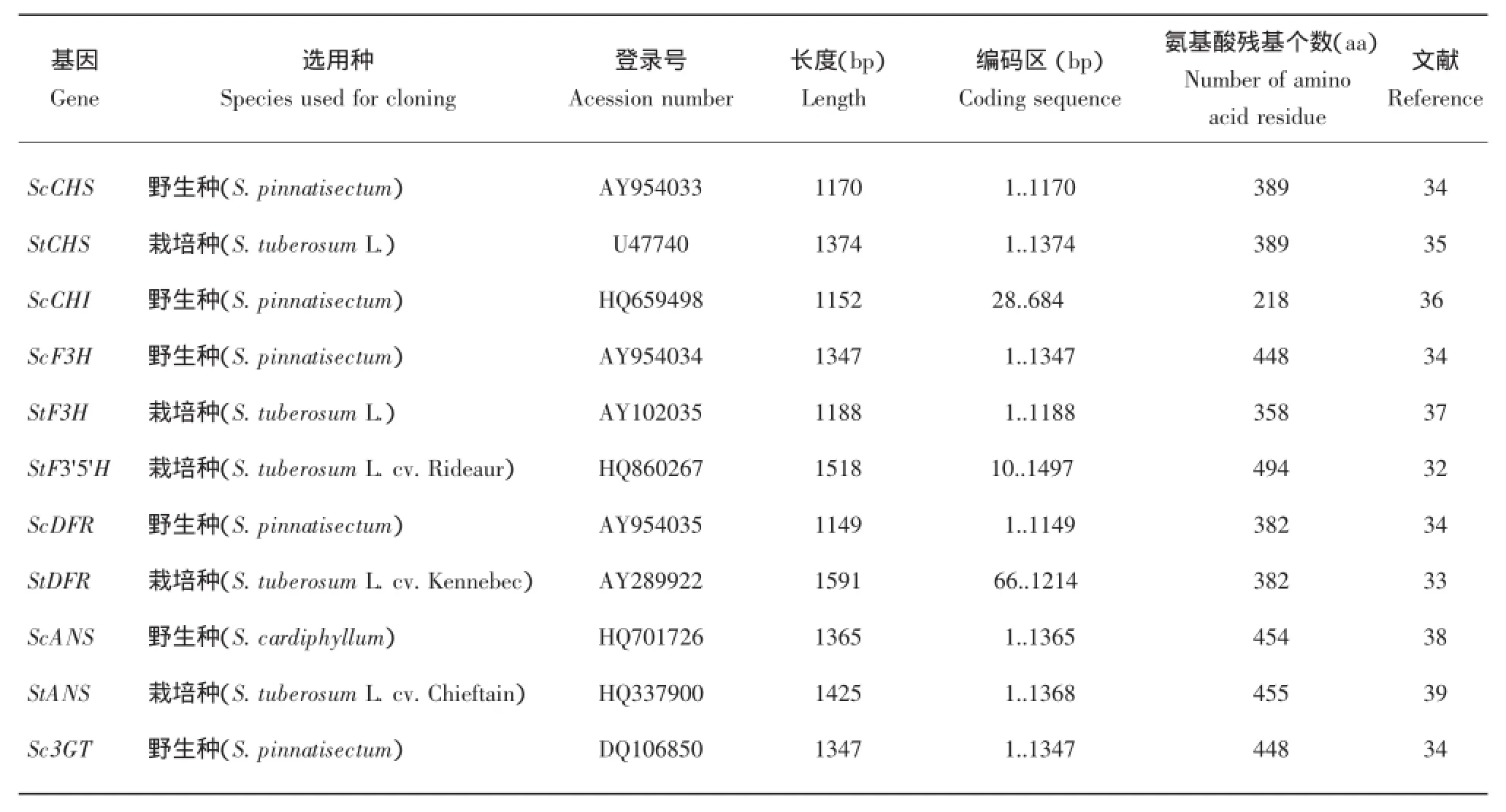
表1 马铃薯中克隆的结构基因Table 1 structural genes cloned in potato
3.2 调节基因
研究表明,马铃薯花色苷合成调控基因编码产物为转录因子,是一类通过与DNA序列特异结合、激活或抑制靶基因的转录表达的蛋白。转录因子通过单独或协作作用与结构基因启动子中含有的能被其识别的顺式作用元件结合,从而激活花色苷生物合成途径中多个基因的表达,有效启动花色素苷生物合成途径。花色苷生物合成的每一步均为调节因子的靶位,这些调控基因多数具多效性,不仅控制花色苷合成,还调节其他生理过程。
在植物中花色苷生物合成调控基因有三种类型:MYB、bHLH和WDR。根据茄属的矮牵牛中克隆到调节基因[40],采用同源克隆方法,研究人员从马铃薯栽培种中克隆到an2、an3[41]。王冰[39]分别从马铃薯栽培种‘Chieftain’和野生种(S. cardiphyllum)中克隆到an11,得到大小1 029 bp的片段,氨基酸残基为342 aa。
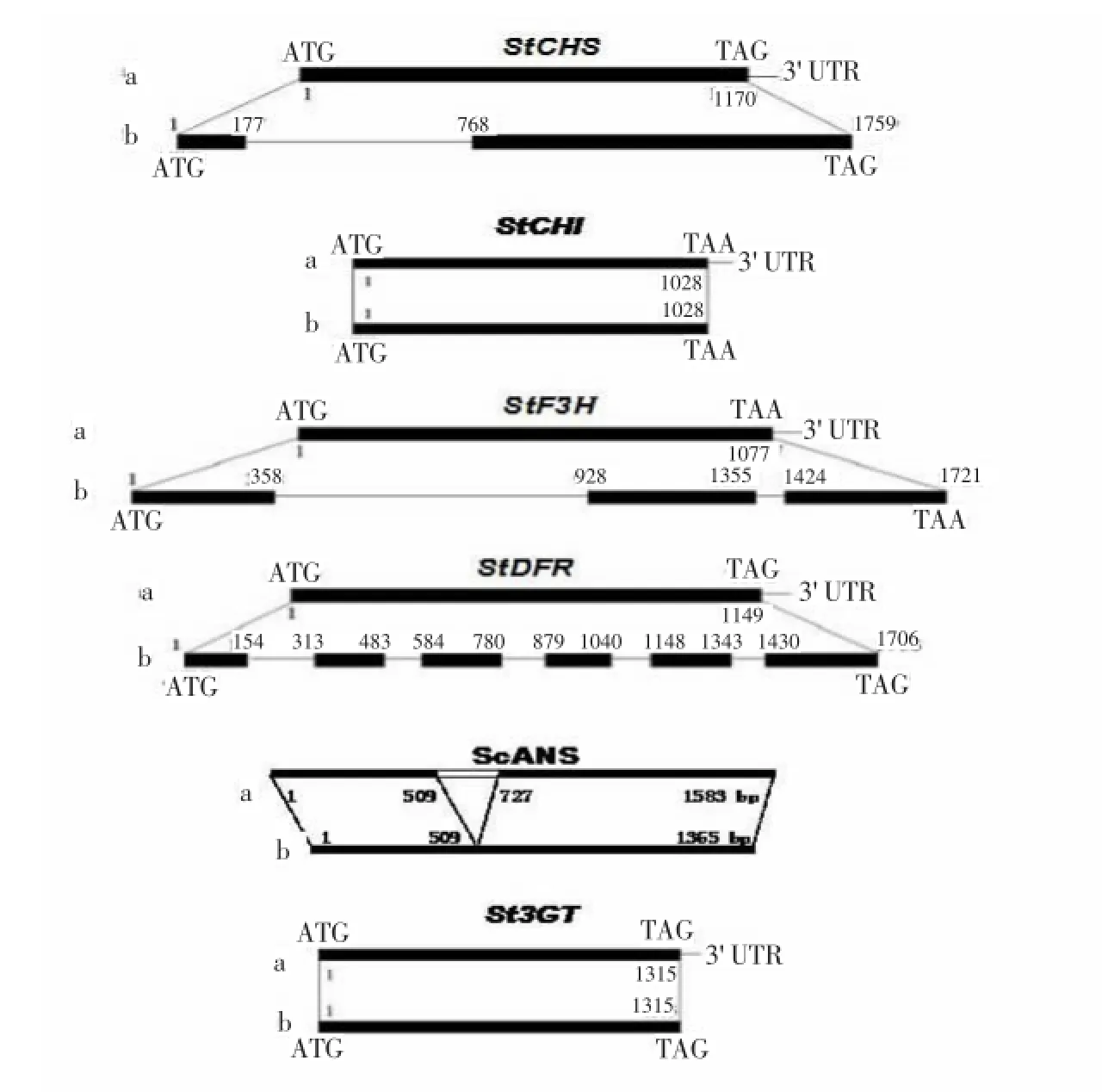
图3 马铃薯花色苷合成关键酶基因结构示意图Figure 3 Schematic representation of potato anthocyanin biosynthesis gene structure
4 马铃薯花色苷生物合成基因在彩色薯改良中的应用
4.1 结构基因的应用
马铃薯薯色的遗传研究始于上世纪初,Salaman[42]在研究中发现了表现型为紫色、红色和白色块茎的薯色遗传现象,并认为这三个相对性状分别由三个独立的基因位点控制,这三个独立的基因位点分别是D、R和P,红色薯皮由显性位点D和R控制,P控制紫色皮色。这一遗传模式被称为四倍体遗传模式[43,44]。近20年来,随着花色苷生物合成途径的深入研究,马铃薯花色苷生物合成结构基因在马铃薯品种改良中的应用研究已取得了一定的进展。
Jung等[32]用马铃薯F3'5'H cDNA和pPSl构建以CaMV为启动子的植物表达载体,转入农杆菌LBA4404,侵染马铃薯栽培种‘Desirée’,获得转化植株;转化植株的茎变成紫色,薯皮也由原来的红色转变为紫色,薯肉出现红色。通过对其色素进行薄层析(TLC)发现与原红色薯对照存在差异,而与紫色对照基本一致,从而证实了其控制紫色花色苷合成的功能。Kosieradzka等[26]将大麦CHS cDNA克隆以及矮牵牛F3H cDNA和DFR cDNA克隆并分别转化马铃薯,对获得的转基因植株的块茎横切面进行荧光显微观察,结果发现,花色苷在周皮细胞中含量丰富,且集中在液泡中。在三种转基因中,过表达CHS的块茎中花色苷含量最多,有3~4层周皮细胞均含有花色苷。Stobiecki等[45]在对转入CHS、CHI和DFR基因的马铃薯植株的薯块花色素含量分析时发现,转基因薯块中矮牵牛素和天竺葵素的含量显著增加,其中CHS的效应最大。卢其能等[46]将携带3GT基因的表达载体转入转入农杆菌GV3101,采用菌液浸泡花序法对拟南芥进行遗传转化,经PCR筛选出的转基因植株叶片和茎杆变成紫红色,花色素含量比对照高出7倍;Wei等[47]把含有3GT基因和块茎特异性启动子GBSSI的表达载体转入马铃薯栽培种‘Désirée’,转基因块茎颜色加深,花色素含量达到对照的3.3倍,获得花色素含量高的马铃薯品种。
4.2 调节基因的应用
在马铃薯花色苷结构基因研究的基础上,近年来,有关调节基因的应用研究也有一些报道。Jung等[41]将an2转入栽培种粉红皮色‘Désirée’,白皮品种‘Bintje’,和2个杂交白皮后代‘W5281.2’和‘07506-01’,转基因植株叶片、薯皮、薯肉都出现不同程度的紫色。Zhang等[48]对矮牵牛anl类似基因Stan1进行CAPS的标记,标记显示Stan1在检测的73个品种里,彩色马铃薯中均含有约为980 bp的Stan1片段,推测Stanl可能参与调控马铃薯的薯肉花色苷生物合成。在我们近期的研究中,将StAN11基因转入栽培品种‘Désirée’,StAN11的过表达使转基因块茎中花色苷的含量大幅增加,最高是对照的5倍,块茎的颜色由浅红变成紫色(结果尚未发表)。
5 彩色马铃薯生物技术育种策略
马铃薯块茎的颜色有白色、黄色、浅红色、红色和紫色。在我们过去对不同颜色马铃薯中花色苷生物合成通路基因的检测发现,在基因组水平,这些基因在几种被检测的马铃薯中均存在,但在转录水平它们中的大部分在白色和黄色薯中没有表达。这些结果为我们有针对性地进行遗传改良提供理论依据。就目前的技术水平,实现在非彩色马铃薯中花色苷的合成,有两个可行的策略:一是有针对性的使用调控基因启动花色苷的生物合成;二是根据受体的遗传背景,选用适当启动子,进行多基因转化。
6 展望
总的说来,目前马铃薯花色苷的合成途径已经基本清楚,但在调控方面的研究还很不够,比如:一些调控基因克隆与功能验证,调节因子如何与启动子特定区域结合调控结构基因活性,各种环境因子对花色素代谢的影响,下游基因如何修饰合成后的花色素。花色苷是一种天然色素,有抗氧化功能,能抵抗UVB辐射、低温等逆境,已受到越来越多的研究者与消费者的关注。在我国,通过传统方法已培育几个彩色薯品种,但相对于普通马铃薯育种落后了许多。中国是世界人口第一大国,也是马铃薯生产与消费大国。随着经济发展和人们对健康的认识不断提高,我国彩色马铃薯的发展将会有广阔的前景。这对于马铃薯研究者来说,是机遇,应该走在社会发展的前沿,将更多的精力投入到马铃薯花色苷的基础与应用研究当中,推动彩色马铃薯产业的发展。
[1]吕世安.中国马铃薯产业发展现状及趋势[J].湖北民族学院学报:自然科学版,2002,20(4):29-35.
[2]刘福翠,谭学林,郭华春,等.云南省马铃薯品种资源的RAPD分析[J].西南农业学报,2004,17(2):200-204.
[3]胡隆基.使用天然色素概述[J].全国食品添加剂通讯,1993(1): 4-11.
[4]施明.类黄酮抗肿瘤作用的研究进展[J].国外医学卫生学分册,2001,28(2):96-99.
[5]Ross J A,Kasum C M.Dietary flavonoids:bioavailability,metabolic effects and safety[J].Annual Review of Nutrition,2002,22:19-34.
[6]孙明霞,王宝增,范海,等.叶片的花色素苷及其对植物适应环境的意义[J].植物生理学通讯,2003,39(6):688-694.
[7]Springob K,Nakajima J I,Yamazaki M,et al.Recent advances in the biosynthesis and accumulation of anthocyanis[J].Nat Prod Rep,2003,20:288-303.
[8]Brown C R,Wrolstad R,Durst R,et al.Breedingstudiesin potatoes containing high concentrations of anthocyanins[J].American Journal of Potato Research,2003,80:241-250.
[9]谢庆华,李月秀,李智,等.特色马铃薯色素抗肿瘤活性[J].中国马铃薯,2004,18(4):213-214.
[10]Brown C R,Culley D,Yang C P,et al.Variation of anthocyanin and carotenoid contents and associated antioxidant values in potato breeding lines[J].Journal of the American Society for Horticulture Science,2005,130:174-180.
[11]Brown C R,Culley D,Bonierbale M,et al.Anthocyanin carotenoid content,and antioxidantvaluesin native south American potato cultivars[J].Hortscience,2007,42:1733-1736.
[12]张俊莲,王蒂.我国马铃薯育种方式的变迁及其转基因育种研究进展[J].中国马铃薯,2005,19(3):163-167.
[13]李灿辉,龙维彪,杨仕忠,等.马铃薯育种研究与云南马铃薯产业发展[J].云南农业科技,2003(增刊):95-101.
[14]郭华春.云南薯类作物生产现状与产业化前景分析[J].西南农业学报,2004,17(增刊):384-387.
[15]盛万民,王立春,李风云,等.马铃薯品质性状分子育种研究进展[J].中国农学通报,2005,2l(6):179-182.
[16]Tanaka Y,Tsuda S,Kusumi T.Metabolic engineering to modify flowercolor[J].PlantCelland Physiology,1998,39(11):1l19-1126.
[17]刘邻渭.食品化学[M].北京:中国农业出版社,1998.
[18]杜建明,张艳芬.乌饭树色素的提取技术及其稳定性研究[J].食品科学,1992(4):14-16.
[19]郭凤丹,王效忠,刘学英,等.植物花青素生物代谢调控[J].生命科学,2011(10):938-944.
[20]Fossen T,VstedalDO,Slimestad R,etal.Anthocyaninsfroma Norwegian potatocultivar[J].Food Chemistry,2003,81(3):433-437.
[21]Lachman J,Hamouz K,Orsák M,et al.Impact of selected factorscultivar,storage,cooking and baking on thecontentofanthocyaninsin coloured-fleshpotatoes[J].Food Chemistry,2012,133(4):1107-1116.
[22]Ieri F,Innocenti M,Andrenelli L,et al.Rapid HPL/CDA/DMS method to determine phenolic acids,glycoalkaloidsand anthocyanins in pigmented potatoes(Solanum tuberosum L.)and correlations with variety and geographical origin[J].Food Chemistry,2011(125):750-759.
[23]Harborne J B.Plant polyphenols.1.Anthocyanin production in the cultivated potato[J].Biochemical J,1960,74:262-269.
[24]Burton WG.The potato[M].New York:Wiley,1989.
[25]André C M,Schafleitner R,Legay S,et al.Gene expression changes related to the production of phenolic compounds in potato tubers grown under drought stress[J].Phytochemistry,2009,70(9): 1107-1116.
[26]Kosieradzka I,Borucki W,Matysiak-Kata I,et al.Transgenic potato tubers as a source of phenolic compounds.Localization of anthocyanins in the peridermis[J].Journal of Animal and Feed Sciences, 2004,2(13):87-92.
[27]Holton T A,Cornish E C.Genetics and biochemistry of anthocyanin biosynthesis[J].PlantCell,1995,7:1071-1083.
[28]赵昶灵,郭华春.植物花色苷生物合成酶类的亚细胞组织研究进展[J].西北植物学报,2007,27(8):1695-1701.
[29]Dancs G,Kondrak M,Banfalvi Z.The effects of enhanced methionine synthesis on amino acid and anthocyanin content of potato tubers[J].BMC Plant Biol,2008,8:65.
[30]Springob K,Nakajima J,Yamazaki M,et al.Recent advances in the biosynthesis and accumulation of anthocyanins[J].Nat Prod Rep,2003,20(3):288-303.
[31]彭镇华,汪政科.观赏植物基因工程研究进展[M].北京:中国农业出版社,2001.
[32]Jung C S,Griffiths H M,De Jong D M,et al.The potato P locus codes for flavonoid 3',5'-hydroxylase[J].Theor Appl Genet, 2005,110:269-275.
[33]De Jong W S,De Jong D M,De Jong H.An allele of dihydroflavonol 4-reductase associated with the ability to produce red anthocyanin pigments in potato(Solanum tuberosum L.)[J].Theor Appl Genet,2003,107:1375-1383.
[34]Lu Q,Yang Q.cDNAcloning and expression ofanthocyanin biosynthetic genes in wild potato(Solanum pinnatisectum)[J].African JournalofBiotechnology,2006,5(10):811-818.
[35]Jeon J H,Joung H,Byun S M.Characterization of two members of the Chalcone Synthase gene family from Solanum tuberosum L.[J]. Plant Physiol,1996,111:348.
[36]王全逸.马铃薯多酚类化合物对结肠癌和肝癌细胞增殖的影响及花色苷生物合成关键酶基因的研究[D].南京:南京农业大学, 2010.
[37]卢其能.马铃薯花色苷及其生物合成的主要关键酶基因的克隆与表达分析[D].南京:南京农业大学,2006.
[38]王冰,王全逸,印敬明,等.野生马铃薯ANS同源基因的克隆与表达分析[J].植物生理学报,2011(11):1103-1108.
[39]王冰.反义PHYB转基因马铃薯的评价及马铃薯花色苷合成相关基因ANS和AN11的克隆[D].南京:南京农业大学, 2011.
[40]Ramsay N A,Glover B J.MYB-bHLH-WD40 protein complex and the evolution of cellular diversity[J].Trends in Plant Sci,2005,10 (2):63-70.
[41]Jung C S,Griffiths H M,De Jong D M,et al.The potato developer (D)locus encodes an R2R3 MYB transcription factor that regulates expression of multiple anthocyanin structural genes in tuber skin[J].Theor Appl Genet,2009,120(1):45-57.
[42]Salaman R N.The inheritance of colour and other characters in the potao[J].J Genet,1910,1:7-46.
[43]Salaman R N.Potato varieties[M].London:Cambridge University Pres,1926.
[44]Lunden AP.Arvelighetsundersokelser Ipotet(Inheritance studiesin potato),Solanun tuberosum[M].Soertrykk av Meldinger fra Norges Landbrukshoiskole,Norges Landbrukshoiskoles Akervekstforsok., 1937.
[45]Stobiecki M,Matysiak-Kata I,Frański R,et al.Monitoring changes in anthocyanin and steroid alkaloid glycoside content in lines of transgenic potato plants using liquid chromatography/mass spectrometry[J].Phytochemistry,2003,62:959-969.
[46]卢其能,杨清,沈春修.马铃薯类黄酮-3-O-葡萄糖基化酶基因的克隆与表达分析[J].华北农学报,2009(4):11-16.
[47]WeiQ,Feng Z H,Wang QY,etal.Increased accumulation ofanthocyanins in transgenic potato tubers by overexpressing the 3GT gene [J].PlantBiotechnolRep,2012,6:69-75.
[48]Zhang Y,Jung C S,De Jong W S.Genetic analysis of pigmented tuber flesh in potato[J].Theor Appl Genet,2009,119:143-150.
Research Advance on Potato Anthocyanins
CHEN Min,YANG Qing*
(College of Life Sciences,Nanjing Agricultural University,Nanjing,Jiangsu 210095,China)
Anthocyanins,a kind of glycoside,which are synthesized by anthocyanidin and monosaccharide,are known as the value of nutrition and health care for high antioxidant activity.Potato anthocyanins are widely distributed in its skin,flesh, stolons,flowers,roots,stems and leaves and mainly present in the vacuole of cells.Extensive study revealed that there were difference about types and contents of anthocyanidins and there were six kinds of anthocyanidins in potato tuber,namely pelargonidin,cyanidin,peonidin,delphinidin,malvidin and petunidin.The genes which regulate the anthocyanin biosynthesis generally fell into two groups:the first group is the structural genes coding for the enzymes in the anthocyanin biosynthetic pathway;the second group is the regulatory genes encoding transcription factors which control the expression of structural genes and affect the temporal and spatial accumulation of pigment.In this review,anthocyanin biosynthesis,cDNA cloning, functions expression and application of the related genes were particularly summarized,and then feasibility suggestions about the breeding ofcolorfulpotato were offered.
potato;anthocyanin;gene;function;application
S532
B
1672-3635(2013)04-0232-07
2013-07-06
江苏省农业科技创新基金(no.cx(11)1020)。
陈敏(1980-)女,博士研究生,从事马铃薯分子生物学研究。
杨清,教授,主要从事马铃薯分子生物学研究,E-mail:qyang19@njau.edu.cn。
——矮牵牛

