榉树无菌播种技术
张日清,刘海龙,2,汪灵丹,金晓玲
(1.中南林业科技大学a.林学院;b.风景园林学院,湖南 长沙 410004;2.广西壮族自治区林业科学研究院,广西 南宁 530002)
榉树Zelkova schneideriana属于榆科榉属,落叶大乔木,国家二级保护植物,分布于我国淮河流域、秦岭以南的长江中下游地区。榉树木材致密坚硬,材色鲜艳,纹理美观,耐腐性强,是生产各类高档家具和工艺品的上等木材。同时由于其树形优美,树冠冠幅大,叶色季相变化丰富,也是深受人们喜爱的传统色叶园林风景树种[1-3]。
榉树的繁殖分为有性繁殖和无性繁殖。目前生产上常用的有性繁殖是种子繁殖。无性繁殖主要有嫁接、扦插和组织培养[4]。通过种子无菌播种可以快速获取无菌活体,作为室内快繁的一条途径,已在众多植物上得到成功应用[5-6]。
虽然前人已在榉树组培技术上做了较多的研究,但是目前尚未见榉树无菌播种技术的相关研究报道。笔者研究不同的处理方法和不同的播种基质对榉树种子萌发生长的影响,以期找到较适宜的榉树无菌播种方法。
1 材料与方法
1.1 试验材料
用于播种的第1批榉树种子采集于2011年11月中旬,采集地点为湖南怀化,千粒质量约为15.4 g,冰箱4 ℃贮藏至2012年3月中旬进行无菌播种,播种时种子呈咖啡色。
用于播种的第2批榉树种子采集于2012年10月下旬,采集地点为广西百色,千粒质量约为16.5 g,冰箱4 ℃贮藏至2012年11月上旬进行无菌播种,播种时种子呈绿色。
1.2 试验方法
种子分剥壳和不剥壳2种处理,剥壳处理的种子播种到培养基上,不剥壳的种子播种到沙子中。培养过程中仔细观察,记录出现萌动的初始时间,播种后60 d时统计萌发率。
1.2.1 剥壳种子处理方法
将种子在纯净水中浸泡24 h后用纯净水冲洗3~4次,将种子放置在干净的培养皿上,用手小心剥除种壳。在超净工作台内用0.1%的升汞处理剥壳后的种子5 min,用无菌水冲洗干净后接种到培养基上。培养基装在试管中,每颗种子单独接1根试管,每种处理的培养基播100管,重复2次。
培养基配方如下:
①改良MS+0.5 mg/L 6-BA+0.2 mg/L NAA+位琼脂4.0 g/L+蔗糖30 g/L+抗坏血酸0.01 g/L;
②改良MS+2.0 mg/L 6-BA+2.0 mg/L NAA+琼脂4.0 g/L+蔗糖30 g/L+抗坏血酸0.01 g/L;
③改良MS+2.0 mg/L 6-BA+1.0 mg/L 2,4-D+琼脂4.0 g/L+蔗糖30 g/L+抗坏血酸0.01 g/L;
④改良MS+2.0 mg/L 6-BA+琼脂4.0 g/L+蔗糖30 g/L+抗坏血酸0.01 g/L。
培养基pH值均调整为5.8。
1.2.2 不剥壳种子处理方法
将种子在纯净水中浸泡24 h后用纯净水冲洗3~4次。在超净工作台内用75%的酒精浸泡30 s,再用0.1%的升汞处理15 min,用无菌水冲洗干净后接种到沙子中。沙子为筛过的干沙,在玻璃瓶中经高温高压(121 ℃,0.11 MPa)灭菌约50 min。种子播种到沙子后,在超净工作台内向瓶中倒入无菌水,将沙子淋透,再深埋种子。每瓶播入种子20颗,1次播种5瓶,重复2次。培养条件为:温度25 ℃,光照2 000 lx,光照时间为每天12 h。
2 结果与分析
2.1 第1批种子不同处理萌发状况
第1批种子不剥壳播种到沙子中,60 d后观察未发现萌发。剥壳处理后分别播种到①、②、③3种培养基中约10 d发现部分种子开始愈伤化,30 d后统计,愈伤组织的诱导率约为5%。种子在3种培养基上的愈伤诱导率无显著差异,但在培养基②、③上产生愈伤组织比培养基①上早。每间隔30 d将愈伤组织周转1次,进行增殖。在培养基①上增殖的愈伤组织不易褐化,愈伤组织呈深黄色(见图1a)。愈伤组织继代增殖数代后可转入分化培养,在培养基④上可取得较好的分化效果,愈伤组织上先出现多个白色小芽点,后转为绿色(见图1b),最后从芽点分化出芽,部分芽能抽高到1.0 cm以上(见图1c),便可剪切出来诱导生根。
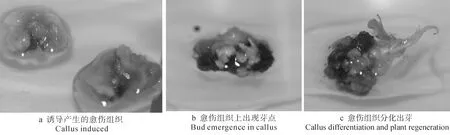
图1 第1批种子的处理效果Fig.1 Effect of lab treatment on the first batch of seeds
2.2 第2批种子不同处理萌发状况
第2批种子不剥壳播种到沙子中,7 d后发现有芽萌发(见图2a),60 d后统计,发芽率为14%。芽抽高至3~4 cm后转接到培养基①上培养,芽能继续抽高并展叶(见图2b)。培养基上培养约1周后发现约46.4%的芽带菌污染,其它不带菌芽可转入继代增殖。第2批种子剥壳处理后分别播种到①、②、③3种培养基上,10 d后发现种子萌动,胚乳(子叶)变绿膨大并展开(见图2c)。培养基①上的芽可抽高展叶(见图2d),培养基②、③上萌动的种子仅有胚乳(子叶)膨大变绿,但不能抽高生长,约15 d左右发现胚乳(子叶)愈伤化(图2e),30 d后种子已完全变成愈伤团(见图2f)。60 d后统计在培养基上出现萌动的种子所占比率为12.7%。

图2 第2批种子的处理效果Fig.2 Effect of lab treatment on the second batch of seeds
3 结论与讨论
前人已成功利用榉树的胚、顶芽、子叶、下胚轴、茎段等外植体获得榉树无菌活体,并最终形成再生植株[7-8]。金晓玲等发现了榉树组织诱导、继代和生根培养的最适培养基[4]。但利用榉树种子作为外植体,通过无菌播种的方法来获得无菌活体尚未见报告。种子无菌播种有自身的优势,一是可实现全年全天候的播种,二是其消毒效果不受季节和天气的影响。结合课题组前期对榉树优良种源选择的研究,采用优良种源的种子进行无菌播种,则获得的组培苗可直接应用于生产。
本研究中所采用的种子发芽率仅有14%,远低于李铁华等报道的80%以上,而冰箱4℃贮藏4个月的第1批种子甚至未发现发芽,究其原因,可能是种子本身的质量问题或与消毒处理对种子的伤害有关。前人的研究结果表明:冰箱3 ℃贮藏能较好地保持榉树种子活力,贮藏18个月,仍能保持77.5%的发芽率[9]。而用质量浓度为150 g/L的PEG处理已常温贮藏12个月的榉树种子36 h,还可大幅恢复和提高种子活力[10]。这些研究结果对于指导如何储存和处理榉树种子有重要意义,笔者将继续优化种子处理、储存、消毒等各个环节,以获得更高的无菌播种发芽率。
第1批种子与第2批种子在相同的处理条件下,发芽率存在较大差异,表明2批种子的质量存在较大差异。第2批为新采集的种子,种子活力强,及时播种能获得较高的发芽率,放置过一段时间的第1批种子活力明显下降。
第1批种子剥壳后播种到3种不同培养基上,愈伤组织的诱导率并无显著差异。表明愈伤组织的产生不仅受培养基的影响,还与种子本身的状态有较大关系。种子活力的下降或者种胚的发育不全或许是导致种子不萌发而直接产生愈伤组织的原因。培养基①上的愈伤组织不易褐化,表明含有较低浓度激素的培养基有利于愈伤组织的增殖。
第2批种子在沙子中和在培养基中可以获得相似的发芽率,但是播种在沙子中的种子萌发时间要早2~3 d。同时还发现沙子中萌发出的芽,其真叶在种子萌发后15 d就能迅速展开,而在培养基中萌发的芽,其真叶在种子萌发后40 d后仍然较小,未能展开生长。表明沙子比培养基也许能提供更为合适的温湿等条件,有利于种子的萌发和芽的生长。
第2批种子剥壳后播种到3种不同培养基上均出现芽的萌动。在培养基①上,萌动出的芽能抽高展叶。而在培养基②、③上种子出现先萌动后愈伤化的现象。表明含有高浓度激素的培养基易诱导愈伤的产生,但作用发生在种子萌动以后,种子在前期仍受自身内源激素调节。
参考文献:
[1]张日清,杨 婕,金 晓 玲. Dynamic activity of endogenous plant hormones inZelkova schneiderianaduring the growth of seedlings[J]. 经济林研究,2011,29(4):1-5.
[2]汪灵丹,张日清. 大叶榉组培苗生根诱导和移栽试验[J]. 经济林研究,2008,26(3):59-63.
[3]汪灵丹,张日清,金晓玲. 外植体的选择和消毒对大叶榉组织培养的影响[J]. 湖南林业科技,2008,35(2):21-23.
[4]钟飞霞,金晓玲,康 睿. 榉树无性繁殖技术研究进展[J]. 现代农业科技,2012,(7):217,220.
[5]钟雨薇. 春兰无菌播种技术研究[J]. 安徽农学通报,2007,13(20): 87-88.
[6]梁称福. 4种野菜种子的发芽特性及无菌播种培养研究[J].广东农业科学,2008,(3):15-17.
[7]汪灵丹,张日清,金晓玲. 大叶榉顶芽诱导与增殖培养[J]. 中南林业科技大学学报,2010,30(6):75-79.
[8]金晓玲,何 平. 大叶榉愈伤组织诱导与继代培养的影响因素[J]. 中南林学院学报,2003,23(1):32-36.
[9]李铁华,文仕知,喻勋林,等. 榉树种子贮藏过程中的活力变化研究[J]. 林业科技,2008,33(2):4-7.
[10]李铁华,文仕知,喻勋林,等. 聚乙二醇(PEG)渗调处理恢复和提高榉树种子活力的研究[J].安徽农业科学,2008,36(3):887-888.

