榉树组培芽继代增殖的影响因素
张日清,刘海龙,2,汪灵丹,金晓玲
(1.中南林业科技大学a.林学院;b.风景园林学院,湖南 长沙 410004;2.广西壮族自治区林业科学研究院,广西 南宁 530002)
榉树Zelkova schneideriana属于榆科榉属,落叶大乔木,国家二级保护植物,分布于我国淮河流域、秦岭以南的长江中下游地区。榉树材质优良,是生产各类高档家具和工艺品的上等木材,同时榉树也是深受人们喜爱的传统色叶园林风景树种[1-3]。
由于榉树用途广泛,现阶段已被过度采伐,因此目前榉树资源非常紧缺。植物组培技术是对植物进行繁育与保育的一种重要技术手段。特别是利用芽器官的以芽繁芽技术是当前组培工厂化育苗的常用技术手段,被广泛应用于桉树、香蕉等苗木的大规模繁育[4-5]。
榉树的芽器官繁殖技术,前人已经有了大量的研究报告。金晓玲[6-7]经研究发现,榉树组织诱导和继代培养中,生根的最适培养基为WPM培养基。实生苗幼嫩茎段在WPM+BA1.0 mg/L培养基上直接形成丛生芽。汪灵丹等[8]研究发现,榉树最佳增殖培养基是WPM+4.0 BA mg/L,最大增殖系数为15。
榉树组培继代增殖技术是榉树芽器官繁殖技术的关键,得到大量健康的丛生芽是实现榉树组培工厂化育苗的前提。笔者在前人研究的基础上,研究影响榉树组培继代芽增殖效果及生长状况的几种因子,以期获得更多更健壮的组培继代增殖芽进入生根培养阶段。
1 材料与方法
1.1 试验材料
转入继代增殖培养的材料共有4种来源。第1种:以榉树幼嫩茎段为外植体,经过初代诱导腋芽培养后,取试管腋芽丛生芽中的单个芽为试验材料(见图1)。第2种:榉树幼嫩的顶芽经过消毒后存活,从初代培养基转入继代增殖培养阶段(见图2)。第3种:榉树幼嫩茎段,经过初代诱导腋芽培养后,取试管腋芽单芽为试验材料(见图3)。第4种:对榉树种子进行无菌播种,发芽后直接剪取萌发芽转入继代增殖培养阶段[9](见图4)。

图1 试管腋芽丛生芽Fig.1 In vitro clustered shoots from axillary bud

图2 幼嫩的顶芽Fig.2 A tender terminal bud

图3 试管腋芽单芽Fig.3 A shoot in vitro from axillary bud

图4 无菌播种的萌发芽Fig.4 A bud obtained through aseptic seeding
1.2 继代增殖培养的试验方案
1.2.1 基本培养基及植物激素对继代增殖效果的影响
为了更准确详细地研究榉树继代培养的增殖问题,采用4因素3水平L9(34)正交设计方案进行试验设计(见表1)。取大小一致的无菌芽苗,苗高约1.0 cm,每组接种10瓶,每瓶接种1株,每个处理重复2次。基本培养基设置3个水平:A1(MS)、A2(WPM)、A3(改良MS)。NAA设置3个水平:B1(0 mg/L)、B2(0.5 mg/L)、B3(1.0 mg/L)。KT设置3个水平:C1(0 mg/L)、C2(1.0 mg/L)、C3(2.0 mg/L)。BA设置3个水平:D1(0 mg/L)、D2(1.0 mg/L)、D3(4.0 mg/L)。
1.2.2 抗氧化剂和吸附剂抑制褐化的效果
对比活性炭(AC)、聚乙烯吡咯烷酮(PVP)、抗坏血酸(Vc)三者在榉树继代增殖培养过程中的抗褐化能力的强弱以及对生长的影响。AC 2.0 g/L,PVP 2.0 g/L,Vc 15 mg/L,每个处理15瓶,留15瓶作为空白对照。培养基选用WPM+BA 1.0 mg/L,培养基中添加琼脂4.0 g/L,蔗糖30 g/L,pH值调至5.8。
1.2.3 材料来源对继代增殖效果的影响
针对榉树继代增殖培养过程中,芽体愈伤化现象严重这一问题,对比4种来源材料的愈伤产生情况,研究不同材料的适宜增殖方法。

表1 继代增殖试验设计方案L9(34)Table 1 The orthogonal test L9(34) plan of multiplication of subculture buds mg·L-1
2 结果与分析
2.1 基本培养基及植物激素对继代芽增殖效果的影响
将第1种来源的材料,即诱导萌发的腋芽丛生芽,自基部切离,接种到继代培养基上,每处理接种10瓶,每瓶接种1株,每处理重复2次。培养35 d后,调查统计芽增殖及生长情况,结果见表2。
采用直观分析法,对芽增殖倍数这个指标进行分析。影响增殖倍数的指标从主到次为:BA(极差3.90)、KT(极差1.10)、NAA(极差0.67)、基本培养基(极差0.63)。方差分析结果显示:4个因素中因素D(BA)达到显著水平(F=32.819>F0.05=19.000)。均值(k)表明,最优组合为A2B2C3D3,即WPM+NAA 0.5 mg/L+KT 2.0 mg/L+BA 4.0 mg/L培养基,但本试验中不含该组合,因为正交试验是一种均一性试验设计,不可能含所有处理组合[10-11]。但根据表1仍可选出较好的处理组合A1B3C3D3,即MS+NAA 1.0 mg/L+KT2.0 mg/L+BA 4.0 mg/L,也可达较好的增殖效果,增殖率为5.5。
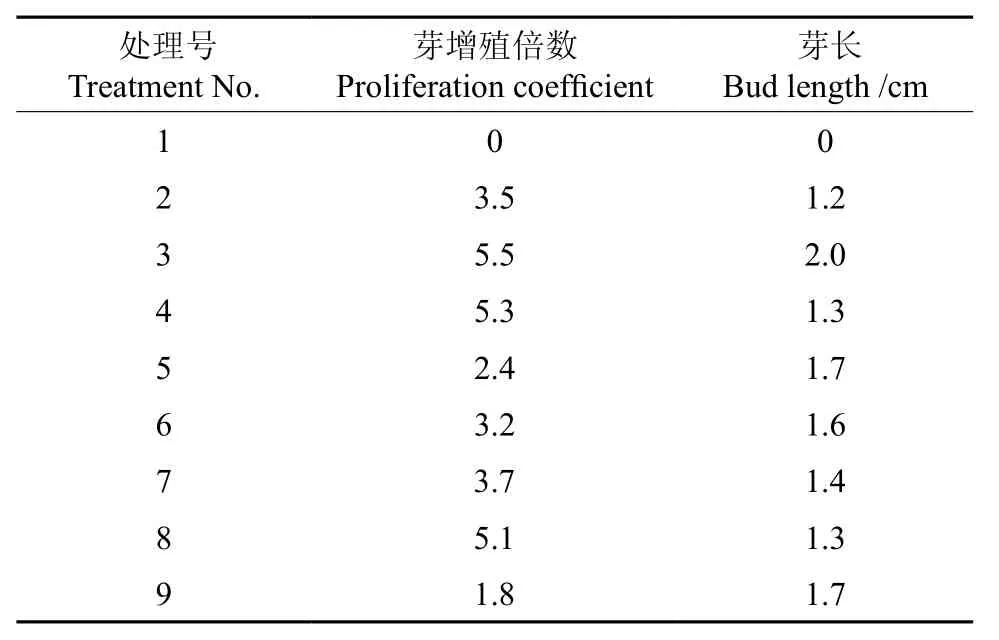
表2 培养35 d时芽平均增殖倍数和芽长Table 2 Bud proliferation coefficient and length after 35 days
采用直观分析法,对芽长这个指标进行分析。影响芽长的指标从主到次为:NAA(极差0.867)、KT(极差0.733)、基本培养基(极差0.466)、BA(极差0.400)。方差分析结果显示:4个因素均未达到显著水平。均值(k)表明,最优组合为A2B3C3D1,即WPM+NAA 1.0 mg/L+KT 2.0 mg/L培养基,榉树继代芽可以达到较好的抽长效果。
2.2 抗氧化剂和吸附剂抑制褐化的效果
在培养基中加入抗氧化剂或活性炭,对防止某些植物培养物的褐变具有一定的效果。3种抗氧化剂和吸附剂抑制继代芽褐变的效果见表3。结果表明,2.0 g/L PVP具有良好的抑制继代芽褐变的作用,加入该物质后,继代芽几乎无褐化现象发生。即使偶尔出现少量褐化,也只发生在叶片,对芽体生长无明显损害。15 mg/L Vc对继代芽褐化无明显抑制作用。而添加2.0 g/L AC,也对继代芽的褐化无抑制作用(见图5),芽体在添加活性炭的培养基中褐化,继代芽在添加活性炭的培养基中前期生长健康,叶片颜色转为深绿色,但培养15 d后继代芽会出现明显玻璃化的现象(见图6)。

表3 抗氧化剂和吸附剂的防褐化效果†Table 3 Inhibition effect of antioxidants or adsorbents on browning

图5 芽体褐化Fig.5 Bud browning

图6 芽体玻璃化Fig.6 Bud vitri fication
2.3 材料来源对继代芽增殖效果的影响
第1种来源的材料(即试管腋芽丛生芽),由于在初代培养时能吸收来自母株茎段的大量营养,因此生长健壮,木质化程度较高。这类材料可使用WPM+NAA 0.5 mg/L+KT 2.0 mg/L+BA 4.0 mg/L培养基,获得高的增殖系数。
第2种来源的材料(即幼嫩的顶芽),该材料直接来自母株,大多数顶芽由于过于细嫩,在消毒时易被杀死,因此得到这类芽的几率较小,这类芽在添加BA的培养基上极易出现愈伤化,愈伤化能导致整个芽体被包埋而死亡(见图7)。因而,这类芽不适宜在添加BA的培养基上培养,使用KT代替BA,虽然增殖系数降低,但避免了愈伤化现象的发生,保证了继代芽的健康生长。
第3种来源的材料(即试管腋芽单芽)和第4种来源的材料(即无菌播种的萌发芽)同第2种材料,芽较细弱,使用KT代替BA,能取得较好的继代培养效果,芽健壮(见图8)。第2种、第3种和第4种来源的材料经过数代继代增殖培养后,芽体木质化程度逐渐增强,可转入添加BA的培养基中。
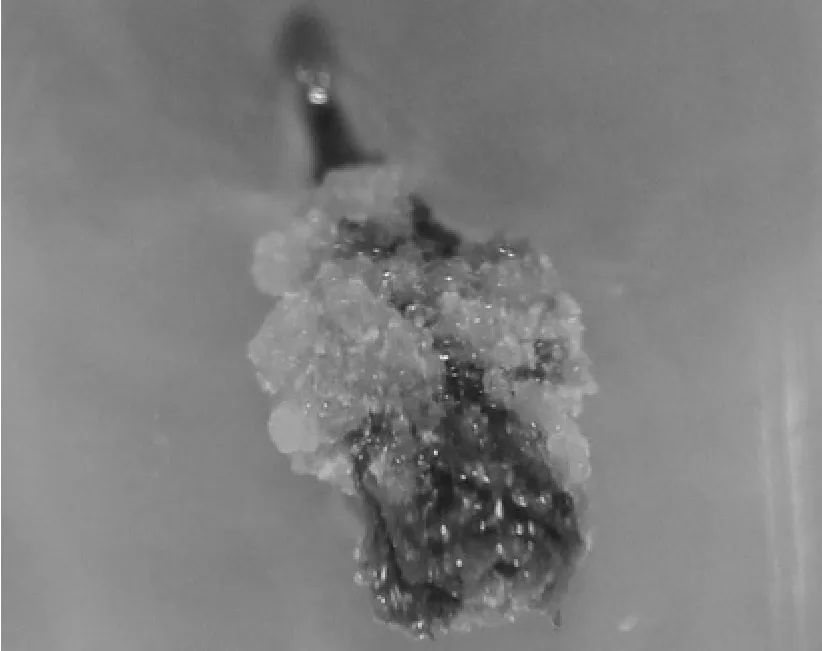
图7 顶芽愈伤化Fig.7 Terminal bud with callus formation

图8 无菌播种的萌发芽产生增殖芽Fig.8 Proli firation bud from plantlet after aseptic seeding
3 结论与讨论
活性炭是吸附性较强的无机吸附剂,但它并没有选择性,在吸附酚类物质的同时,也把培养基中的营养物质吸附掉,短时间内对培养物没有影响,时间长了外植体就因缺少营养而枯死[12]。前人分析凡是能够钝化多酚氧化酶(PPO)、过氧化物酶(POD)等酶系统活性的抗氧化剂,理论上都具有阻碍或防止外植体褐变的作用[13]。但某些抗氧化剂(如Vc)不耐高温。而PVP是酚类物质的专一吸附剂[14-15],且耐高温,选择PVP作为防止褐变物质从理论上是可行的。本试验中选用了PVP控制榉树组培继代芽褐变,取得了显著效果。
前人已经对榉树组培做过大量研究。但大多数研究者并没有提到愈伤化的现象。笔者通过研究发现,榉树组培继代增殖过程中的愈伤化严重危害榉树组培继代芽的健康生长。KT可以在前几代继代培养过程中暂时替代BA,不产生愈伤的同时,取得一定的增殖效果。但其作用并不稳定,即有时可以取得3倍甚至4倍的增殖效果,有时又不发生增殖。因而KT的增殖效果在稳定性上较BA差,在后期继代培养过程中KT不能完全代替BA。
观察发现:木质化程度高的继代芽在继代增殖过程中不易产生愈伤。因此通过各种途径提高组培继代芽的木质化程度至关重要。基本培养基、光照、温度、琼脂等都是优化的对象,如果能迅速提高组培继代芽的木质化程度,则能避免愈伤的产生,从而大幅度提高榉树继代增殖的效率。
后续的研究中发现,用IBA替代NAA或者直接去掉培养基中的生长素,可以减缓愈伤组织的产生,而对榉树组培继代培养的增殖倍数等重要参数不产生明显影响。因而后期的继代增殖培养基中只采用BA和KT的组合作为生长调节物质。
参考文献:
[1]刘海龙,张日清,汪灵丹,等.榉树嫩枝扦插技术的研究[J].中南林业科技大学学报,2013,33(9):11-13.
[2]汪灵丹,张日清. 大叶榉组培苗生根诱导和移栽试验[J]. 经济林研究,2008,26(3):59-63.
[3]汪灵丹,张日清,金晓玲. 外植体的选择和消毒对大叶榉组织培养的影响[J]. 湖南林业科技,2008,35(2):21-23.
[4]王以红,项东云,申文辉,等.广西桉树无性系育苗产业化现状及其发展策略[J].广西林业科学,2006,35(4):271-274.
[5]林贵美.香蕉组培苗的研究与推广[J].中国热带农业,2005,(6): 24-27.
[6]金晓玲.榉树的生物学特性和微繁技术的研究[D].长沙:中南林学院,2004.
[7]钟飞霞,金晓玲,康 睿. 榉树无性繁殖技术研究进展[J]. 现代农业科技,2012,(7):217,220.
[8]汪灵丹,张日清,金晓玲.大叶榉顶芽诱导与增殖培养[J]. 中南林业科技大学学报,2010,30(6):75-79.
[9]张日清,刘海龙,汪灵丹,等.榉树无菌播种技术[J].经济林研究,2013,31(1):139-142.
[10]孙周平,褚丽敏,洪仁伟.正交设计在刺五加组织培养中的应用[J].中国农学通报,2010,26(4):85-88.
[11]玄雪梅,王 艳,蔡伟民.正交设计法在刺叶墙藓原代组织培养中的应用[J].生物技术, 2004,14(3):32-33.
[12]刘均利,马明东. 华盖木组织培养中褐化控制研究[J]. 浙江林业科技,2007,27(1):20-23.
[13]崔堂兵,郭 甬,张长远.植物组织培养中褐变现象的产生机理及克服方法[J].广东农业科学,2001(3):16-18.
[14]姚洪军,罗晓芳,田砚亭.植物组织培养褐变的研究进展[J].北京林业大学学报,1999,21(3):78-84.
[15]陈 彪,陈伟栋,梁钾贤,等.利用PVP防止甘蔗组织培养接种物褐变的研究[J].华南农业大学学报,1999,20(3):63-66.

