水淹对双穗雀稗抗氧化酶活性及碳水化合物含量的影响
谭淑端,朱明勇,张克荣,朱佳文,魏杲霞,张全发*
(1.中国科学院武汉植物园水生植物与流域生态重点实验室,湖北 武汉430074;2.湖南农业大学生物科学技术学院,湖南 长沙410128)
因为水淹条件下,植物体内氧气和二氧化碳等气体扩散和植物对光照的获取受到限制,使水淹成为植物遭受的主要的非生物胁迫之一。在缺氧植物细胞中,其氧化胁迫反应与分子氧还原成超氧阴离子自由基,单线态氧,羟氢氧基和过氧化氢等有毒的自由基[1]。为了抵抗活性氧分子的毒害作用,植物进化了一套包括抗氧化酶及其代谢物等组成的复杂的抗氧化酶防御系统,为植株抵御厌氧或缺氧胁迫并生存下来起着至关重要的作用[2-4]。
许多研究已经强调了非结构性碳水化合物含量水平和其在植物耐淹能力和露出水面后的恢复生长能力方面的重要性[5,6]。与对水淹生境敏感的物种相比,耐淹物种通常会抑制叶片和茎的伸长生长,从而保持高的碳水化合物储量,当胁迫生境解除时,能够恢复生长而幸存下来[5]。物种在解除水淹胁迫时,能保存6%的淹水前体内碳水化合物的含量,当其回到正常生长环境条件下,能快速的长出新的叶片[5]。因此,植株水淹后能保持高生物储量,有利于其对水淹胁迫的忍耐和抵抗。
根据三峡大坝运行的实际规律,9月下旬水库开始蓄水,水位逐步升高至175m;12月至次年4月,维持在较高水位;5月开始才逐步降低水位,将原陆地生境变为冬水夏陆交替型生境。因此,要求用于该处植被恢复的物种具备水淹季节主要是冬季耐淹,露出水面后能快速恢复生长。
双穗雀稗(Paspalumdistichum)是一种多年生禾本科单子叶杂草,夏绿冬枯,为典型的暖季型草。它的根系和根状茎相当发达。谭淑端等[7]的研究表明双穗雀稗经过25m深连续5个月的水淹胁迫后,其生存率仍在80%以上,是一种潜在的适于三峡水库消落带植被恢复的物种。本试验试图研究双穗雀稗经受不同深度和不同水淹持续时间的胁迫后植株体内抗氧化酶活性及可溶性糖和淀粉含量的变化,探讨双穗雀稗对水淹胁迫的形态生理方面的响应,为进一步探究双穗雀稗用于三峡库区消落带或其他河岸带植被恢复的可能性。
1 材料与方法
1.1 材料
研究地点为湖北宜昌秭归兰陵溪,地处长江上游下段的三峡河谷地带,属鄂西南山区(E 110°54′,N 30°52′)。该地属亚热带季风气候,≥10℃的年活动积温为5 723.6℃,年最冷月平均温度为6.5℃,年无霜期为306d,降水量为1 000mm左右,空气相对湿度72%,年日照时数1 631.5h。
于2008年8月底选取三峡库区自然消落带生长的双穗雀稗当年生分蘖苗作为研究对象(中国科学院武汉植物园秭归三峡消落带研究试验基地提供)。将生长均匀的分蘖苗移入塑料桶中,每桶5株。桶内径为30cm,桶高15cm,桶底钻孔。土壤基质采用三峡库区兰陵溪岸边的砂壤土。移栽的植株间隔30cm均匀的放置在兰陵溪开阔的自然环境下尽量使其保持生长一致。
1.2 方法
于2008年11月2日将所有盆栽植株置于三峡水库支流兰陵溪进行水淹处理,未淹对照于当地自然条件下生长。水淹设4个不同处理(0,1,5和15m),分别在水淹的0,3,7,15,30,60,90,120和150d取样,每个处理重复3次,立即用自来水冲洗干净。取适量的新鲜根用液氮冷冻,然后放到-70℃储藏用于丙二醛(MDA),过氧化氢酶(catalase,CAT),超氧化物歧化酶(superoxide dismutase,SOD),过氧化物酶(peroxidase,POD),谷胱甘肽还原酶(glutathione reductase,GR)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)等指标的测定。另一部分根和茎用冰盒带到实验室,用于可溶性糖和淀粉含量的测定。
试验的水淹时间主要是根据三峡水库运行节律来定的(11月-4月水淹)。
1.3 指标测定
丙二醛含量测定按照张志良和瞿伟菁[8]的方法。过氧化氢酶活性(CAT)测定参照Aebi和Bergmeyer[9]的方法。超氧化物歧化酶活性(SOD)和过氧化物酶活性(POD)测定参照李合生[10]的方法。谷胱甘肽还原酶(GR)测定参照Foyer和 Halliwell的方法[11]。抗坏血酸过氧化物酶(APX)活性测定参照Nakano和Asada的方法[12]。可溶性糖和淀粉含量的测定主要是参照文献[13]的方法。
1.4 统计分析
数据通过SPSS 13.0进行方差分析及差异显著性检验,并用LSD多重比较进行所需的后续检验(P=0.05或P=0.01)。用Levene法检验方差齐性,方差不齐对数据进行log10的对数转换。
2 结果与分析
2.1 MDA含量变化
水淹植株体内MDA含量比未淹对照植株MDA含量高 (图1)。1,5和15m深水淹处理植株体内MDA含量随水淹胁迫时间的增加而增大。即水淹深度越大,水淹胁迫时间越长的处理,植株体内MDA含量越高。1和5m深水淹处理,在水淹时间的0~90d内,植株体内MDA含量增加缓慢,而且相同水淹时间处理植株体内MDA含量差异不显著(P>0.05)。从水淹的90d,1和5m深水淹植株体内的MDA含量随着水淹时间的延长呈急剧的增加。15m深水淹处理植株,从试验开始到连续水淹的60d,植株体内MDA含量随水淹时间的延长呈递增趋势。从水淹的60d到水淹的90d,植株体内MDA含量骤降,然后又随着水淹深度的增加而增加。
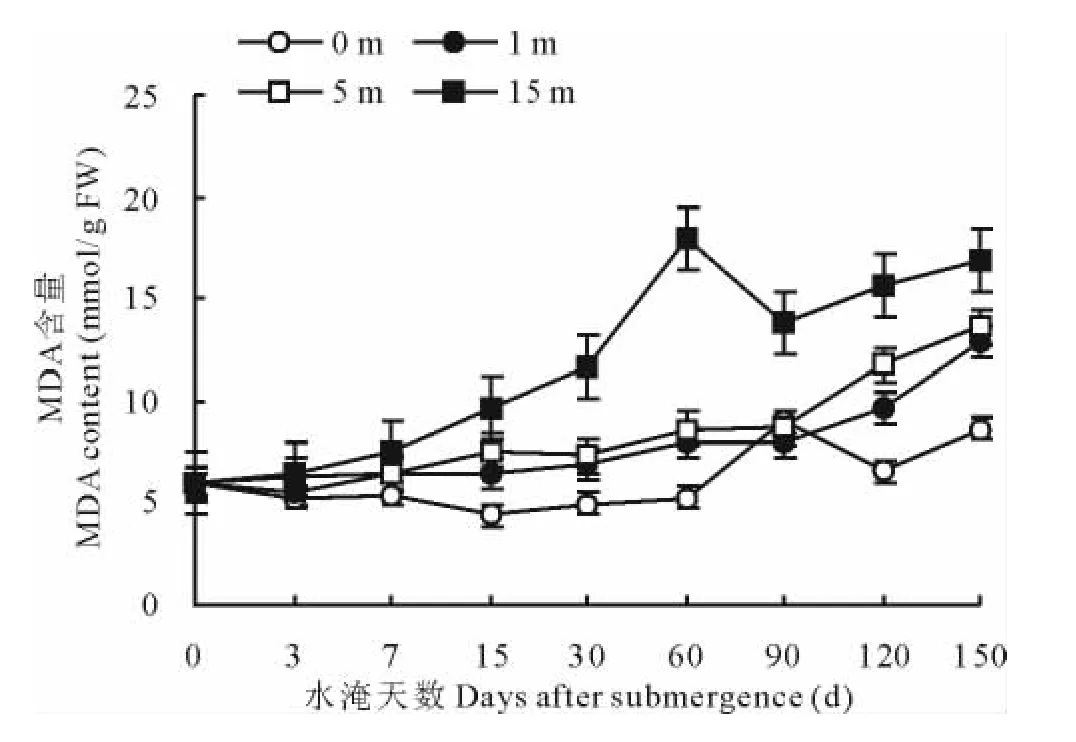
图1 不同水淹胁迫对植株根系MDA含量变化的影响Fig.1 Effects of different submergence stress on MDA content of roots
2.2 抗氧化酶活性
水淹胁迫处理植株CAT含量随水淹时间延长的变化趋势与未淹处理植株随试验时间延长的变化趋势基本一致(图2),都是随水淹胁迫处理时间的延长,植株体内CAT含量呈增加趋势。3个深度水淹处理植株CAT含量的最大值出现在水淹胁迫处理后的第120天。随后,植株的CAT含量都随着处理时间的增加变化较平缓,直到试验结束。尽管所有水淹处理植株的CAT比对照植株的高,但CAT含量的多少与植株遭受的水淹胁迫程度的高低比较一致。即随胁迫程度的增加其值也相应较大。植株分别经受1,5和15 m深连续150d的胁迫处理后,CAT分别为7.86,9.27和10.22U/g FW,分别是胁迫处理开始时植株体内CAT含量的14.83,17.48和19.28倍。
未淹对照处理植株SOD活性随试验时间的变化不显著(P>0.05)。从水淹开始到水淹的第60天,1,5和15m深度处理植株体内SOD活性都随着水淹胁迫处理时间的递增呈增加趋势。随后,3个深度胁迫处理植株体内SOD活性随水淹胁迫时间的递增而下降,直到试验结束。但整个试验期间,试验时间相同,水淹深度胁迫处理不同的植株体内,被淹植株SOD含量都较未淹对照植株大。总体上来说,SOD的含量大小与其遭受的胁迫程度有关(水淹持续时间和水淹深度)。不同水淹胁迫处理植株SOD含量存在显著差异(P<0.05)。
本试验中未淹对照植株与被淹植株一样,植株体内POD活性一致地随着试验时间的延长而递增。在水淹的15d内,未淹对照植株POD活性与1,5和15 m水淹处理植株存在显著差异(P<0.05)。1和5m深水淹处理植株之间差异不显著(P>0.05),但他们与15m深处理植株之间差异显著(P<0.05)。从水淹试验的第15天开始,所有试验处理植株体内POD活性较前期增加幅度加大。不同深度水淹处理植株之间,POD活性随水淹胁迫的增加程度与其遭受的胁迫程度呈正相关。

图2 不同水淹胁迫对植株根系POD,CAT,SOD活性变化的影响Fig.2 Effects of different submergence stress on POD,CAT,SOD activities of roots
未淹对照植株体内APX和GR活性随试验时间的变化不显著(P>0.05)(图3)。水淹胁迫诱导了植株体内APX和GR活性的增加。除了1m深水淹处理植株体内GR活性随试验处理时间的延长增加幅度较少外,其他受淹处理植株体内的APX和GR活性随水淹胁迫时间的延长增加幅度较大。5和15m深水淹胁迫处理植株APX活性的最大值分别出现在持续水淹的30和60d。1,5和15m深水淹胁迫处理植株体内GR活性最大值分别出现在持续水淹后的90,90和60d。APX和GR活性的增加幅度基本上都随着水淹胁迫程度的增加而增加。
2.3 碳水化合物消耗
在试验的7d内,未淹对照植株茎可溶性糖含量随试验时间的延长呈增加趋势(图4);从试验的第7天开始,茎的可溶性糖含量随着试验时间的延长呈递减趋势;试验进行到120d,其减少的程度增大。分别经受1,5和15 m深水淹植株,其茎可溶性糖含量一致的随水淹时间的递增而减少,且水淹深度越大其减少程度越大。从开始水淹到水淹胁迫的第60天,1和5m深受淹植株可溶性糖的下降幅度较大;从水淹的第60天开始,被淹植株体内可溶性糖含量的下降比较平缓,直到水淹胁迫的120d,随之,其下降幅度加剧。15m深被淹植株在水淹的15 d内,体内可溶性糖含量的下降较大,随之下降平缓直到水淹的90d。从水淹的90d直到试验结束(水淹150d),15m深植株体内可溶性糖含量的下降随水淹深度的递增而加剧。

图3 不同水淹胁迫对植株根系APX,GR活性变化的影响Fig.3 Effects of different submergence stress on APX and GR activities of roots
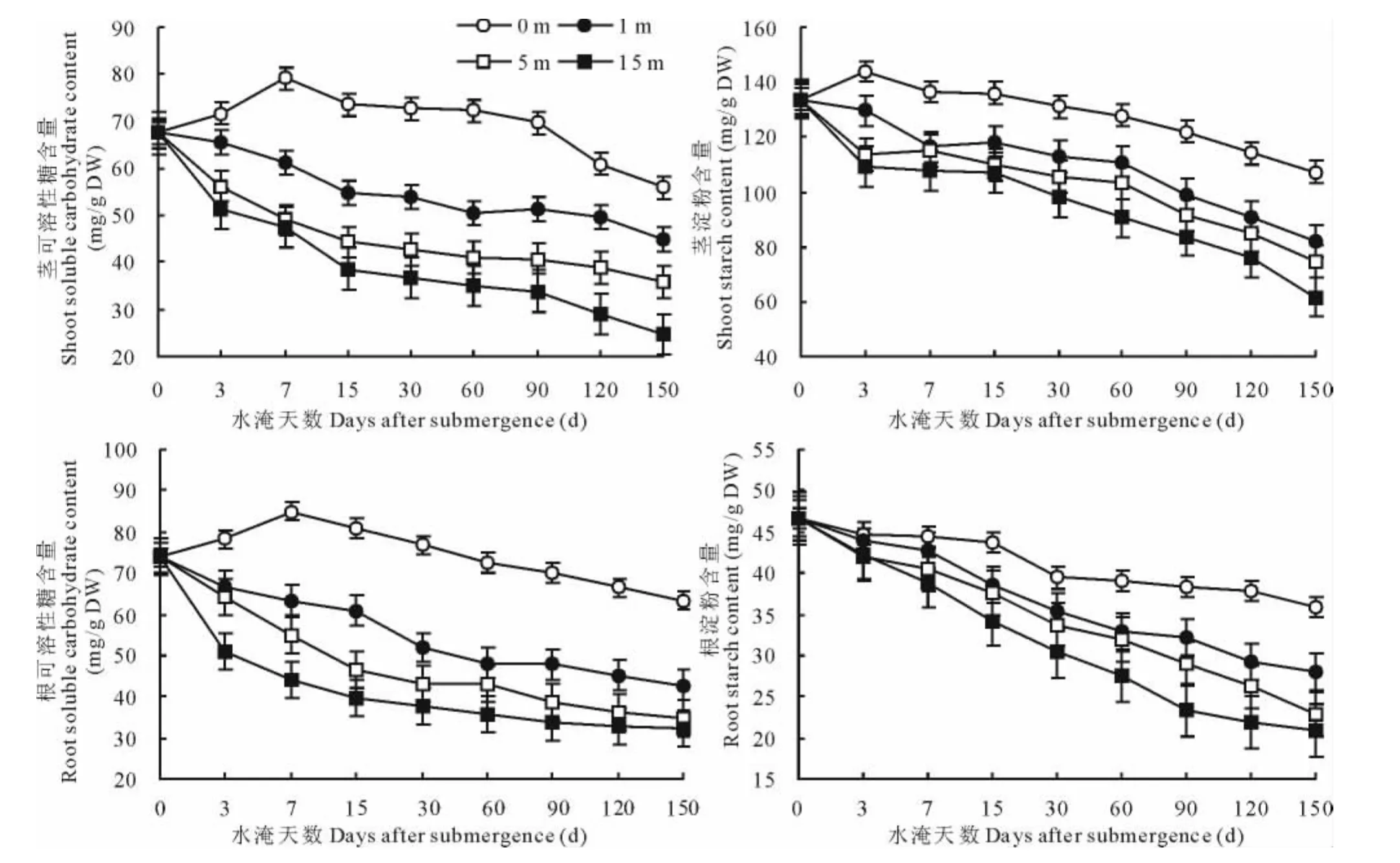
图4 不同水淹胁迫对植株茎和根的可溶性碳水化合物和淀粉含量变化的影响Fig.4 Effects of different submergence stress on the total soluble sugar and starch contents of shoot and root
受不同水淹深度胁迫植株根可溶性糖含量随水淹胁迫时间的变化情况与未淹植株的变化有差异(P<0.05)。从水淹开始到第7天,未淹对照植株根可溶性糖含量随试验时间的延长有所增加;从试验的第7天开始,试验植株根可溶性糖含量随着试验的延续呈逐渐下降的趋势。从试验开始到水淹的30d,1,5和15m水淹植株根可溶性糖含量一致地随着水淹时间的递增呈剧烈的减少,然后其下降趋于平缓,直到试验结束。植株遭受的水淹胁迫程度越大,其根可溶性糖含量的下降幅度也越大。
除未淹对照植株从开始试验到第5天,其茎淀粉含量略有增加外,其他处理植株,根茎淀粉含量一致的随试验时间的增加而减少(图4)。整个试验期间,未淹对照植株茎淀粉含量的减少比较平缓。1,5和15m水深处理植株,在受淹的前3d,茎淀粉含量下降显著,随之处于下降的平缓期,直到水淹的第15天,然后,各受淹处理植株茎淀粉含量呈急剧的下降。总体上,所有处理植株根淀粉的减少程度较茎淀粉的减少程度大。未淹对照植株从试验的第15天到30天,根淀粉含量有一个剧烈的下降外,其余试验时间,根淀粉含量的减少处于相对平缓。但总趋势是随着试验时间的递增其含量呈递减趋势。
3 讨论
氧气在水中的溶解性是很低的。氧浓度从大气中的约266×10-6g/cm3(8.31mol/m3)到水中的少于8.26×10-6g/cm3(0.25mol/m3)[14]。当氧气浓度≤5%时,植物会遭受厌氧或缺氧胁迫[15]。因此,植株部分或全部水淹会限制植株体内氧的扩散,从而限制植株的有氧呼吸。水稻(Oryzasativa)和芦苇(Phragmitescommunis)等耐淹植物进化了许多在厌氧或缺氧环境中生存下来的机制。这些机制包括:1)在氧气缺乏的条件下,植株体内抗氧化酶活性的作用来平衡植株体内活性氧分子的毒害作用[16];2)受淹植株通过改变能量代谢来保持活力所需的能量,直到水淹环境得到改善[17]。那么这些适应策略是否是促成双穗雀稗耐长期水淹胁迫的策略呢?本试验针对这个问题进行了探讨。
3.1 抗氧化酶活性的变化
厌氧组织中自由脂肪酸增加,细胞膜渗漏,细胞内的电解质丧失。在正常膜功能和膜功能瓦解之间,只有很少的一段距离。从丙二醛(MDA)和乙烷等物质的出现可以很充分的证明细胞发生了脂质过氧化[18]。本试验中,测定了各处理植株体内MDA含量的变化。MDA值基本上是随着水淹胁迫时间的延长和胁迫程度的增大而增大的,说明了被淹植株遭到了不同程度的伤害。耐厌氧胁迫植物对厌氧胁迫的主要策略之一可能是确保植株在厌氧条件下膜脂的稳定性,及保护厌氧胁迫植株各组织免遭过氧化伤害,而抗氧化酶系统在其中发挥着重要的作用。
湿地生境生长的具有地下茎的物种通常生来就具有很好的防御厌氧胁迫伤害的能力。比较研究了耐缺氧物种黄菖蒲(Irispseudacorus)和不耐缺氧物种德国鸢尾 (Irisgermanica)的越冬块茎内过氧化酶对植株抵抗缺氧胁迫后过氧化伤害的作用。在经历1个月缺氧培养后,再进行厌氧胁迫后生长,耐缺氧胁迫物种与不耐缺氧胁迫物种的区别是:耐缺氧植株能增加体内SOD含量,进而抵挡体内过氧化物产生的潜在伤害[19]。本试验研究结果表明水淹处理植株CAT,SOD和POD都随着水淹深度和水淹持续时间的增加而增加,且其值都比未淹对照植株高。本试验中,GR和APX在水淹处理植株中都增加了,且在不同程度的水淹胁迫处理中存在着显著差异(P<0.05)。他们的增加确保了被淹植株体内活性氧分子的解毒和还原型抗坏血酸的再生。抗坏血酸可以直接参加过氧化物,羟氢氧基和单线态氧毒性的清除,同时,他还可以作为辅酶在植株体内发挥作用[20]。
3.2 碳水化合物含量的变化
碳水化合物的可利用性是维持植株旺盛发酵代谢所必须的[21,22]。厌氧或缺氧胁迫导致植株受伤的一个可能原因是体内碳水化合物饥饿[23]。因此在厌氧或缺氧条件下,耐淹基因型能够保持植株足够的易于利用的可溶性糖的供应;相反地,厌氧敏感型物种就不具备这种能力。SuSy是厌氧条件下负责植株体内蔗糖水解成果糖和葡萄糖的主要酶类[24]。大量研究报道了碳水化合物在许多植物耐淹能力中的作用[23-26]。研究结果因植物基因型,胁迫的程度和胁迫持续时间以及被研究的组织不同而存在差异。本试验研究了经受不同深度水淹胁迫的双穗雀稗茎和根的可溶性糖和淀粉含量随不同水淹持续时间的变化情况。被淹双穗雀稗植株茎和根的可溶性糖和淀粉一致地随着水淹持续时间的递增而递减。水淹深度越大的处理,植株茎和根的可溶性糖和淀粉含量越低,且随水淹持续时间的递增其下降幅度也相应增大。尽管没对植株体内与糖类代谢相关酶的活性进行测定,但从可溶性糖和淀粉含量的变化趋势可以初步说明,水淹双穗雀稗植株体内的淀粉能很好的水解成植株厌氧代谢所需的可溶性糖形式。受淹植株能成功的运用体内的糖酵解底物可溶性糖,生产维持植株生长或生存所需的能量,从而捍卫其耐水淹能力。在遭受长期不同水淹深度的水淹胁迫后,其回归正常的生长环境后能快速的恢复生长并迅速长成新的植株,为下一阶段的逆境胁迫奠定好能量供应基础。有关水淹胁迫双穗雀稗植株体内可溶性糖类的代谢过程和分子机理值得做深入研究。
3.3 季节对植株耐淹能力的影响
在夏季,水甜茅(Glyceriamaxima)分离的根状茎完全抗缺氧的时间少于1周。在夏季高温缺氧的条件下,4 d内植株就会消耗体内总非结构性碳水化合物储量的50%[27]。相比之下,在22℃的实验室条件下,越冬地下茎可以生存3周,毫无疑问在野外条件下可以生存更长时间。耐厌氧胁迫季节依赖性的生理基础目前还没有充分的理解,可能与冬天植株体内高碳水化合物储量和越冬器官低的代谢活力有关。以植株在回到正常环境中生长后能否长出新的茎的能力为检测标准,冬天黄菖蒲单个根状茎在厌氧条件下的最大生存时间是65d,夏天大概是50d[23]。根据三峡水库的水淹节律,本试验中植株的水淹时间主要是冬季,这为植株降低能耗,抵抗更长时间的水淹胁迫奠定了好的基础。但就双穗雀稗植株在夏季是否具备如此强的耐水淹能力仍需进行验证。
4 结论
1)从抗氧化酶的保护机制来看,本试验数据支持在厌氧胁迫条件下,植株通过包括涉及CAT,SOD,POD,GR和APX等多种抗氧化酶共同作用来保护植株免受活性氧分子的毒害。这些数据表明根系的抗氧化酶系统在双穗雀稗抵御和忍耐长期水淹胁迫中起着至关重要的作用。总体来说,抗氧化酶活性升高水平与遭受的胁迫程度呈正相关,植株的抗氧化酶系统受各种各样复杂的环境因子所共同调节着。
2)水淹双穗雀稗植株体内的淀粉能很好的水解成植株厌氧代谢所需的可溶性糖形式。受淹植株能成功的运用体内的糖酵解底物可溶性糖,生产维持植株生长或生存所需的能量,从而捍卫其耐水淹能力。
3)根据三峡水库的水淹节律,本试验中植株的水淹时间主要是冬季,这为植株降低能耗,抵抗更长时间的水淹胁迫奠定了好的能量基础。
[1] Lin K H R,Weng C C,Lo H F,etal.Study of the root antioxidative system of tomatoes and eggplants under waterlogged conditions[J].Plant Science,2004,167:355-365.
[2] Ahmed S,Nawata E,Hosokawa M,etal.Alterations in photosynthesis and some antioxidant enzymatic activities of mungbean subjected to waterlogging[J].Plant Science,2002,163:117-123.
[3] Sairam R K,Rao K V,Srivastava G C.Differential response of wheat genotypes to long term salinity stress in relation to oxidative stress,antioxidant activity and osmolyte concentration[J].Plant Science,2002,163:1037-1046.
[4] 谭淑端,朱明勇,党海山,等.三峡库区狗牙根对深淹胁迫的生理响应[J].生态学报,2009,29:3685-3691.
[5] Das K K,Sarkar R K,Ismail A M.Elongation ability and non-structural carbohydrate levels in relation to submergence tolerance in rice[J].Plant Science,2005,168:131-136.
[6] Luo F L,Nagel K A,Scharr H,etal.Recovery dynamics of growth,photosynthesis and carbohydrate accumulation after desubmergence:a comparison between two wetland plants showing escape and quiescence strategies[J].Annals of Botany,2011,107:49-63.
[7] 谭淑端,张守君,张克荣,等.长期深淹对三峡库区三种草本植物的恢复生长及光合特性的影响[J].武汉植物学研究,2009,27(4):391-396.
[8] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2002.
[9] Aebi H,Bergmeyer H U.Methods of Enzymatic Analysis[M].New York and London:Bergstr.(Germany)and Academic Press,1983.
[10] 李合生.植物生理生化实验技术与方法[M].北京:高等教育出版社,2000.
[11] Foyer C H,Halliwell B.The presence of glutathione and glutathione reductase in chloroplasts:aproposed role in ascorbic acid metabolism[J].Planta,1976,133:21-25.
[12] Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant and Cell Physiology,1981,22:867-880.
[13] Das K K,Sarkar R K,Ismail A M.Elongation ability and non-structural carbohydrate levels in relation to submergence tolerance in rice[J].Plant Science,2005,168:131-136.
[14] Jackson M,Ram P.Physiological and molecular basis of susceptibility and tolerance of rice plants to complete submergence[J].Annals of Botany,2003,91:227-241.
[15] Sachs M,Subbaiah C,Saab I.Anaerobic gene expression and flooding tolerance in maize[J].Journal of Experimental Botany,1996,47:1-15.
[16] Tan S D,Zhu M Y,Zhang Q F.Physiological responses of bermudagrass(Cynodondactylon)to submergence[J].Acta Physiologiae Plantarum,2009,32:133-140.
[17] Fukao T,Xu K,Ronald P,etal.A variable cluster of ethylene response factor-like genes regulates metabolic and developmental acclimation responses to submergence in rice[J].The Plant Cell,2006,18:2021-2034.
[18] 刘晓军,洪光宇,袁志诚,等.干热胁迫下两种苇状羊茅对不同水肥处理的响应机理[J].草业学报,2011,20(1):46-54.
[19] Monk L,Fagerstedt K,Crawford R.Superoxide dismutase as an anaerobic polypeptide 1Akey factor in recovery from oxygen deprivation inIrispseudacorus[J].Plant Physiology,1987,85:1016-1020.
[20] Fedoroff N.Redox regulatory mechanisms in cellular stress responses[J].Annals of Botany,2006,98:289-300.
[21] 王丹,宣继萍,郭海林,等.结缕草的抗寒性与体内碳水化合物、脯氨酸、可溶性蛋白季节动态变化的关系[J].草业学报,2011,20(4):98-107.
[22] 黄德君,毛祝新,傅华.牧草中水溶性碳水化合物及其影响因素[J].草业学报,2011,20(6):270-278.
[23] Schluter U,Crawford R.Long-term anoxia tolerance in leaves ofAcoruscalamusL.andIrispseudacorusL[J].Journal of Experimental Botany,2001,52(364):2213-2225.
[24] Kato-Noguchi H.Sugar utilization and anoxia tolerance in rice roots acclimated by hypoxic pretreatment[J].Journal of Plant Physiology,2004,161:803-808.
[25] Gibbs J,Greenway H.Mechanisms of anoxia tolerance in plants.I.Growth,survival and anaerobic catabolism[J].Functional Plant Biology,2003,30(1):1-47.
[26] Greenway H,Gibbs Jane.Mechanisms of anoxia tolerance in plants.Ⅱ.Energy requirements for maintenance and energy distribution to essential processes[J].Functional Plant Biology,2003,30:999-1036.
[27] Barclay A M,Crawford R M M.The effect of anaerobiosis on carbohydrate levels in storage tissues of wetland plants[J].Annals of Botany,1983,51:255-259.

