菊苣主要表型性状的多元统计分析
梁小玉,张新全,白史且,季杨,黄琳凯,周凯
(1.四川农业大学草业科学系,四川 雅安625014;2.四川省畜牧科学研究院,四川 成都610066;3.四川省草原科学研究院,四川 成都611731)
菊苣(Cichoriumintybus)为菊科(Asteraceae)二倍体自交不亲和的多年生直根系草本植物[1]。菊苣主要分布于欧洲及地中海盆地,北非、中亚和北美也有其自然分布[2-3],现在广泛分布于全世界温带和半干旱地区[4]。菊苣是极具发展潜力的重要经济植物[5],具有食用、饲用、药用以及工业用等多种用途[6-8]。饲用菊苣具有很多优良品质:营养丰富[接近甚至超过某些苜蓿(Medicagosativa)品种]、产量高、适口性好、消化率高[9-11];抗逆性强,耐干旱,有较强的抗病性和抗虫性[12];饲喂家畜不仅能够减少牲畜体内寄生虫的发生,而且可以提高牲畜的生产性能[13-14]。新西兰等畜牧业发达国家培育了很多饲用型菊苣品种。但是,到目前为止,中国没有自主知识产权的饲用菊苣登记品种,完全依赖从国外引进。目前,生产上应用最多而且通过中国审定并登记的菊苣品种仅有3个引进品种,即“普那”、“将军”和“欧洲”。中国幅员辽阔、地理形态与气候条件多样化。部分品种引进后在中国某些地方适应性较差,有的品种已经出现严重退化或者在南方越夏困难,容易产生根腐病,限制其大面积推广应用,因此急需培育优质高产的饲草菊苣品种。我们从美国基因库引进了75份菊苣种质,在中国采集了5份。为了更有效地对所收集到的菊苣种质资源进行鉴定与利用,必须对所收集到的菊苣种质遗传基础进行评价[15-16]。
目前有许多标记用于研究植物种质变异和遗传关系,包括种子蛋白、同工酶及各种类型的分子标记[17]。然而,形态特征的鉴定是种质评价和分类的第一步[18],形态学标记是鉴别遗传多样性最原始、最基本的方法,是植物种间或种内分类的重要依据之一[19]。由于作物数量性状通常是重要的经济性状,遗传多样性分析中常利用表型数量性状进行分析,但数量性状容易受环境影响,而质量性状能够起到遗传基因标记作用[20-21]。要想较为全面地反映出群体的遗传多样性,必须综合各种不同类型的性状数据进行研究。形态学标记的多元分析已经成功地应用于很多作物种质资源遗传多样性评价。用多元分析方法对芭蕉(Musabasjoo)形态进行多样性分析,能确定最重要的可以用于品种鉴定或者区分野生材料和栽培材料的主要特征性状[21-22]。分子标记与形态标记结合利用多元统计方法分析草莓(Fragariaananassa)的遗传多样性及遗传关系,可以确定形态变异与环境条件有关[23]。还有研究者有效应用多元分析鉴定甜瓜(Cucumismelo)居群之间的关系[24]。对野生菊苣和品种自然杂交后代进行分子标记和形态以及适应性多元分析评价,结果表明杂种后代在生产性能和繁殖力优于野生亲本[25]。罗燕等[26]利用形态标记对菊苣遗传多样性进行研究,发现遗传多样性丰富,且与地理来源和气候类型有一定的关系,但其研究材料少,且只研究了数量性状。生产应用中,牧场主要通过对菊苣叶部形态等表型性状能够快速确定亲本进行饲草菊苣选育[27-28]。以上研究结果表明,应用多元统计方法分析物种的遗传多样性是很必要,也是有效的[29]。
本研究对80份材料植物学形态特征进行观测,通过数量性状和质量性状的多元统计分析,揭示其表型变异特征,并在此基础上进行相关性及主成分分析和聚类分析,快速找出不同类型材料差异的主要性状。对扩大我国菊苣基因资源,鉴别菊苣特异种质,确定核心亲本,了解影响菊苣产量的各相关农艺性状间的主次和依存关系,促进菊苣新品种的选育和改良等提供依据。
1 材料与方法
1.1 试验区概况
试验地位于四川省洪雅县阳平试验站,地理坐标为东经103°25′,北纬29°25′,海拔416m。洪雅属中亚热带湿润气候,在四川盆地及丘陵平原气候中具有代表性。常年平均气温16.8℃,最冷1月,平均气温为6.6℃,最热7月,平均气温25.7℃,年降水量1435.8mm,全年日照时间1079.9h,无霜期303d。
1.2 试验材料
供试菊苣种质来源于荷兰、意大利、法国、美国、伊朗、中国等3个大洲的16个国家,总计80份。其中,菊苣种75份,苦苣(Cichoriumendivia)种5份(编号为1,54,55,74和80的材料)为对照(表1)。
1.3 试验内容与方法
试验采用随机区组设计,每个小区面积为16m2(4m×4m),走道宽0.5m,保护行宽0.5m。每个材料设3次重复。播种方式为穴播,穴距30cm,行距40cm,播深1cm,每穴播种3~4粒种子,最后每穴留1株壮苗。播前土地每hm2施复合肥300kg,尿素150kg,将肥料翻入耕作层,压实平整。出苗后科学管理田间杂草等。测定表型性状时,每个指标重复10次。具体测量数量性状指标有9个(包括:叶长、叶宽、单株叶片数、株高、基茎直径、花序直径、小花数/花序、2级生殖枝数/株及3级生殖枝数/株),质量性状指标有7个(包括:叶色、叶形、叶缘、叶柄、莲座期株型、绒毛和花色)。叶长、叶宽和叶片数量3个数量性状以及所有质量性状在莲座末期测定,其余表型性状在盛花期测定。表型质量性状以数字编码的方式转换成数量形式[30]:1)叶片形状:圆形1,阔卵形2,椭圆3,倒披针4,披针形5;2)叶片颜色:浅绿1,中绿2,深绿3,杂色4,红5;3)叶缘:全缘1,波状2,中裂3,深裂4;4)叶柄颜色:红0,绿1;5)莲座期株型:直立1,半直立2,匍匐3;6)叶片背面是否具有绒毛:无0,有1;7)花序颜色:白色0,蓝色1。
1.4 统计分析
在Excel软件中对数量性状数据进行变异系数分析。利用NTSYSpc软件对数量和质量性状进行材料间欧氏遗传距离分析,质量性状指标首先在Standardization模块中标准化为(0,1)矩阵后和数量性状指标统一为一个标准化矩阵再在SAHN模块中采用可变类平均法进行聚类分析(un-weighted pair-group method with arithmetic mean algorithm,UPGMA)。用SPSS 17.0软件对数量性状进行方差分析、相关性分析和主成分分析(principal component analysis,PCA),确定反映菊苣表型差异的主要形态学指标。
2 结果与分析
2.1 菊苣形态变异分析
2.1.1 菊苣材料个体间变异分析 对75份菊苣材料间主要数量性状变异情况进行分析(表2)。结果显示,9个数量性状差异均达到极显著水平,通过材料间F检验值比较,叶宽的F检验值最大(100.69),花序直径最小(6.24)。变异系数结果显示,3级生殖枝变异系数最大,达到30.18%,说明生殖枝潜力很大,其次为株高(20.17%),花序直径最小,仅8.59%,是比较稳定的植物学性状。从整体变异程度来看,营养器官(如生殖枝、株高、叶片大小等)变异程度要大于生殖器官(如花序直径和小花数/花序)。表明菊苣不同性状间遗传差异较大,而且个体间的差异是由外在自然环境和内在遗传因素共同决定的,营养器官的表型特征更容易受外界环境的影响。均值、标准差及变异系数等具体参数见表2。

表1 供试材料来源与类型Table 1 Sources and types of tested materials
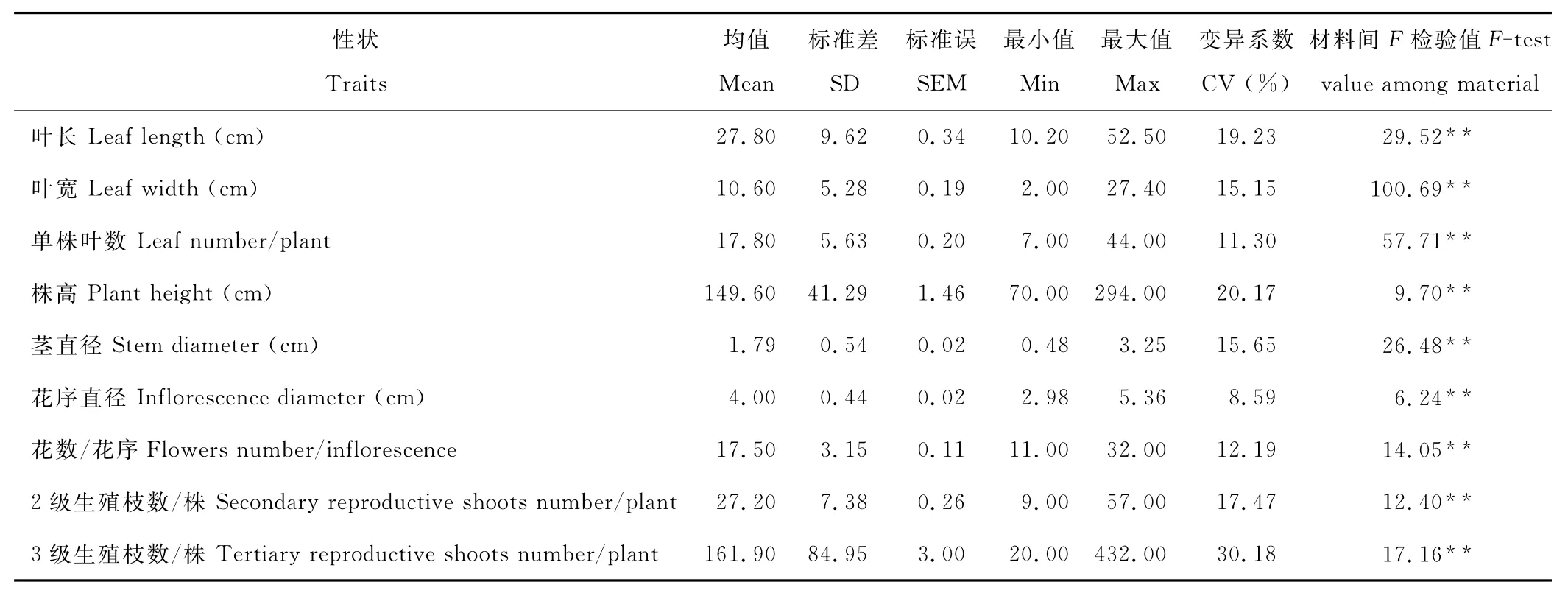
表2 供试材料数量性状差异Table 2 Differences of quantity traits among tested materials
2.1.2 不同菊苣材料类型间变异分析 75份菊苣材料来源于不同的国家,包括栽培材料、品种和野生材料3种类型。对材料类型间进行方差分析,结果显示,除单株3级生殖枝为显著水平外,其余性状均达到极显著水平,不同类型间F检验值最大的是茎直径(388.49),最小的是单株3级生殖枝(4.47)。9个数量性状中,野生材料的单株3级生殖枝变异程度最高(31.11%),品种类型的花序直径变异程度最小(8.48%)。野生材料的单株3级生殖枝、花序直径、单株叶片数量和叶宽等数量性状具有更丰富的变异,而品种类型材料的叶长、茎直径、小花数/花序和2级生殖枝具有丰富的变异,栽培类型材料变异程度较品种和野生材料小,但是株高性状表现突出,而且比野生类型材料高4.86%。从表3可以看出,虽然75份菊苣材料来源于不同的国家和地区,但是经过多年自然变异和人为选择,野生材料叶宽、株高和茎直径等主要性状已经分化成与栽培材料和品种性状特征差异较大的不同类型。野生材料具有明显的表型特征,植株低矮、莲座期株型呈匍匐型,茎秆纤细、叶片很窄且深裂、花序小而且小花数少。
2.2 菊苣植物学形态指标之间的相关分析
将菊苣不同材料各植物学形态数量指标进行相关分析(表4),结果表明,菊苣株高同基茎直径、单株2级生殖枝数、叶宽和花序直径呈极显著正相关,而同叶长呈极显著负相关;基茎直径和叶宽、小花数/花序呈极显著正相关,与花序直径呈显著正相关;单株2级生殖枝同单株3级生殖枝、叶宽、花序直径呈极显著正相关,单株2级生殖枝和单株3级生殖枝均与小花数/花序和叶长呈极显著负相关;叶宽与叶长极显著负相关,但与花序直径极显著正相关,叶长与单株叶片数量呈极显著正相关。营养器官和生殖器官之间存在显著或者极显著相关性。总之,菊苣叶片越宽大,植株也越高大,基茎直径也越粗壮,而且单株2和3级生殖枝也越多,但同时叶片长度显著降低,单个花序小花的数量也会相应显著降低,可能导致单个花序种子减少。
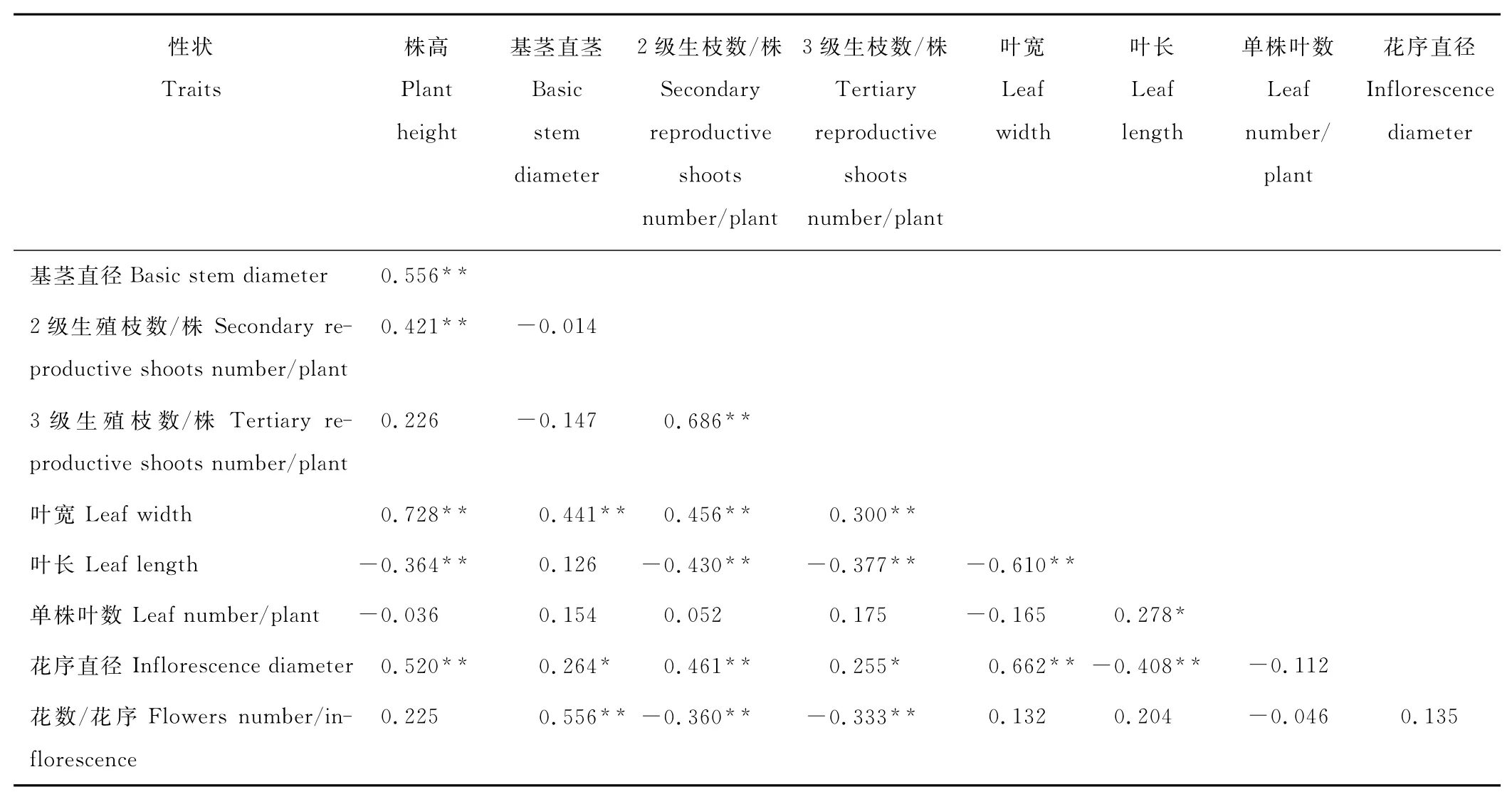
表4 菊苣植物学形态指标之间的相关分析Table 4 Correlation analysis in botanical indicators of Cichorium cm
2.3 80份菊苣种质聚类分析
为了研究菊苣种内以及菊苣与苦苣种间的亲缘关系,采用9个主要数量形态指标以及遗传上较为稳定、不易受环境影响的质量指标计算材料间的欧氏距离,利用可变类平均法进行聚类分析(图1)。在欧氏距离为13.22阈值时,80份材料分为5组,前3组材料占总材料的93.75%,基本是按照形态分为3个类型,即:1)窄叶、叶缘基本为深裂、莲座期植株匍匐型;2)中等宽叶、浅裂或者中裂、直立型;3)阔叶、波状或浅裂或者全缘、直立型。第1组36份材料(材料编号分别为:1,2,3,4,6,8,9,10,11,12,13,14,15,16,23,24,25,26,27,28,29,31,33,40,54,55,69,72,73,74,75,76,77,78,79,80),大部分为栽培材料,主要为第2种形态类型,其特点是叶片为椭圆形,叶片长度和宽度均为中等,叶色中绿,叶柄也为绿色,株型直立,植株较高大,生殖枝和小花数较多,花序大小居中。5份苦苣全部聚在本组第1个亚组,表明苦苣与叶片呈椭圆形的菊苣遗传亲缘关系较近,但是又有一定的遗传差异。少数窄叶形和阔叶形的菊苣也聚在本组,可能椭圆形材料是窄叶形和阔叶形菊苣的中间材料。第2组16份材料(材料编号分别为:32,56,57,58,59,60,61,62,63,64,65,66,67,68,70,71),本组材料全部为野生材料,主要为第1种形态类型,具有明显的外部形态特征:叶片均为窄长的深绿色披针形叶,均表现为深裂,莲座期均表现为匍匐生长,叶柄多数为红叶柄。数量性状显示,本组野生材料株型矮小,茎秆纤细,2级生殖枝较少,花序小而且小花数量少。第3组23份材料(材料编号分别为:5,7,17,18,19,21,22,30,34,36,37,38,41,42,43,44,45,46,48,49,50,51,53)包括栽培材料和品种2种材料类型,主要为第3种形态类型。基本上将意大利的全部菊苣品种聚在了一起。本组材料特点主要表现为:叶片宽大(多为圆形,少数为阔卵形),植株高大,茎秆较粗壮,2和3级生殖枝最多,花序为大花型,小花数最多。红叶和斑叶形菊苣基本聚在本组。第4组仅2份材料,即编号为20的PI651936和编号为52的PI652043,前者为法国的菊苣栽培材料,后者为意大利的菊苣品种,2份材料在表型质量性状上表现一致(绿叶、距圆),数量性状差异不显著,表明2份材料间其亲缘关系较近。第5组包括编号为35,39和47的3份意大利材料,叶片形态表现同野生材料,为窄叶型,但株型均直立,3份材料共同点还表现在茎秆较为粗壮、2级和3级生殖枝特别多,小花数较多。不同材料的形态分类与地理来源无严格的一致关系。大部分来源相同的材料基本能聚在一起,尤其是野生材料。中国、美国、波兰、匈牙利以及荷兰等国的材料基本是按照地理聚类,意大利、法国以及德国等国的材料在聚类图中交错分布。来源于意大利的品种基本聚在一个组内。
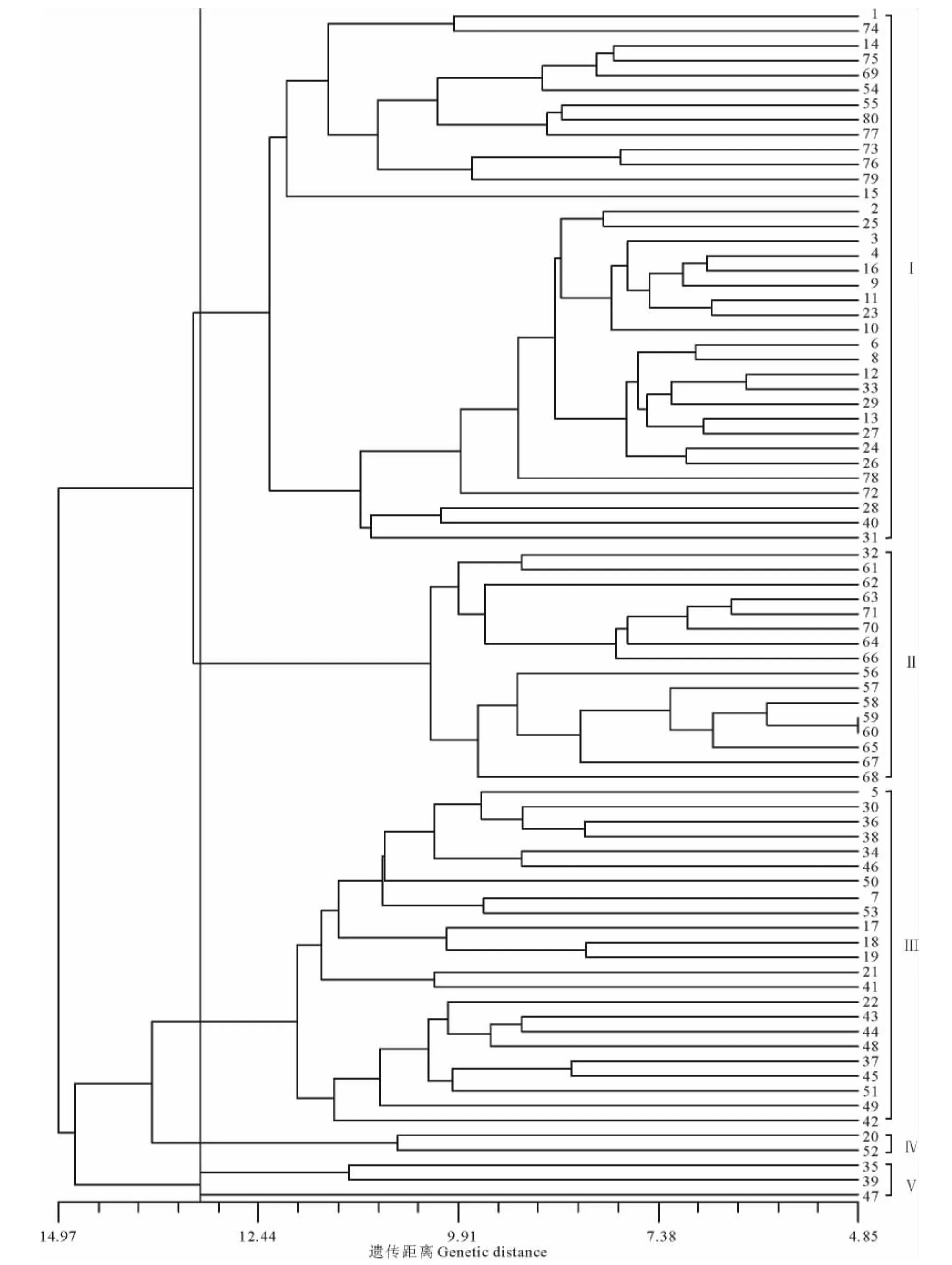
图1 80份菊苣聚类分析Fig.1 Dendrogram of 80accessions of Cichorium
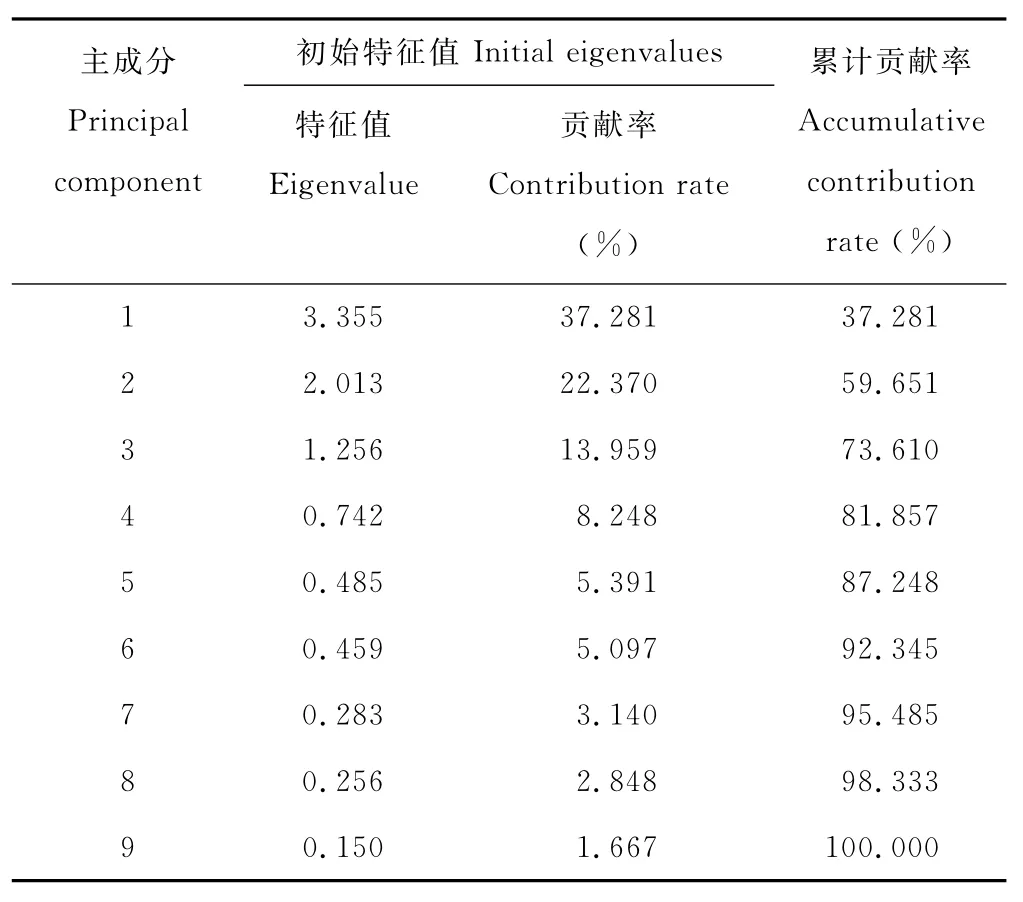
表5 对原有变量的总体描述Table 5 Factor analysis of the initial eigenvalue on original variables
2.4 菊苣不同形态指标的主成分分析
为探明影响菊苣不同材料间以及不同材料类型间差异显著的主要原因,对菊苣株高、叶长等9个数量性状进行主成分分析。按照特征值大于1的原则提取前3个主成分[31]。由表5可以看出,在9个主成分中,前3个主成分对变量的总体描述累计贡献率达73.610%,它们可以描述出原始因子所代表的绝大部分信息。因此,抽取前3个主成分进行因子载荷分析(表6),第1主成分的贡献率为37.281%,在第1因子中,叶片宽度和株高2个正向特征向量值较高,是反映第1因子特征值的主要性状指标;第2主成分的贡献率为22.370%,第2主成分中,小花数和基茎直径2个正向特征向量值最高,是构成第2因子特征值的主要指标;第3主成分中,叶片数正向特征向量值最高,是构成第3因子特征值的主要指标。这3个主成分包含了9个性状指标。其中第1主成分和第3主成分反映的是营养器官的特点,第2主成分反映的是生殖器官的特点。总体看,叶片数、叶宽、株高和小花数等7个性状均呈现0.7以上的总载荷量,这些性状在菊苣的数量分类中居于重要位置。即不同材料间和类型间的差异主要来源于叶片宽度、株高、小花数/花序和小花直径。
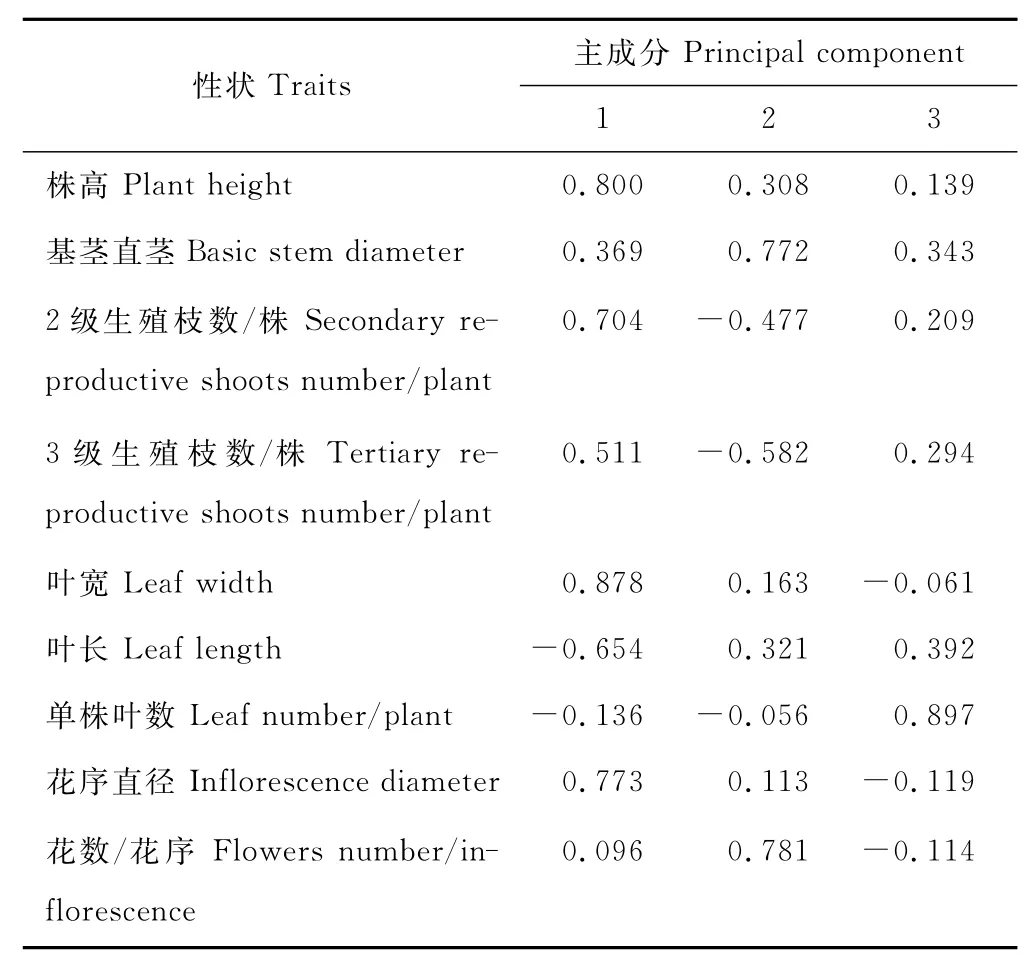
表6 9个形态性状指标前3个主成分的负荷量及共同度Table 6 Loading factor and common degree of the first three principal components in 9morphological traits
3 讨论与结论
3.1 表型变异对菊苣育种的意义
一个物种的进化潜力和抵御不良环境的能力取决于种群内遗传变异的大小,也有赖于遗传变异的种群结构[32]。表型性状由于提供了一个简单的方式来量化遗传变异评估基因型,常常用于分析种质遗传多样性[33],而多样性是提高产量或者提高生物和非生物抗性育种目标的必要条件[34],因此,根据形态鉴定和分类,有利于种质遗传改良、优良种质资源保存及开发利用[23]。菊苣是自交不亲和的植物,在漫长的环境和气候适应过程中,经过长期天然杂交、人工选择培育和自然淘汰,积累了大量的遗传变异,蕴含了丰富的遗传多样性,具有很高价值的遗传潜力[3,26]。本研究中,菊苣不同材料间和类型间均存在丰富的遗传变异,且在不同类型间已产生明显的表型分化。各性状指标在材料间和类型之间差异不平衡,即不同的性状对相同的生境因子影响的反应不同。菊苣生态分布非常广泛[4],而对于生态广布种来说,可能是通过基因型和表型对不同环境条件的适应变异结合从而形成生理、形态和解剖变异特征[35]。此外,人类管理对驯化作物形态分化有显著的影响[36],对不同的经济性状要求不同。驯化作物与野生物种比较通常在形态学、生态和生理学有所不同,野生材料饲草性能更差,品种和中间材料生产性能优于野生材料[25]。本研究中,野生材料叶片数量、小花数以及株高等重要经济性状较栽培材料和品种低,但是,大部分经济性状变异度更高,前人的研究也得到了相似的结果[27],表明菊苣野生种与栽培材料和品种之间遗传距离较远,遗传改良的潜力更大。
菊苣株高与叶形态性状、茎直径以及生殖枝之间、茎直径与生殖枝之间、生殖枝与小花之间等形态性状间多存在相关性,可能是控制相关性状的基因之间存在着某种连锁现象[30]。菊苣株高与叶宽2个性状之间的相关性最强,其次为2级生殖枝与3级生殖枝之间的。总的来看,菊苣株型越高大,叶片越宽大,生殖枝也越多,花序直径也越大,但是单个花序的小花数也会相应显著降低,小花数的多少涉及单个花序结种情况。头状花序受田间管理和环境影响[37]。因此,要想获得单位面积营养体与种子高产,必须通过栽培管理措施协调株高、生殖枝和小花数等相关性状。此外,株型越高大,菊苣的基茎直径也越粗壮,表明菊苣的抗倒伏性也相应提高。植物对气候的适应是在多个水平下发生的,包括表型和基因对逆境的适应性变异等[38],菊苣在长期的环境适应过程中,在形态上也产生了相应的适应性改变。
3.2 菊苣种质形态聚类分析
地理因素在驯化物种演化过程中发挥了重要的作用[37],用形态性状进行聚类分析,能粗略地反映出材料之间的亲缘关系。对苜蓿品种进行形态聚类分析,发现形态和地理起源一致,认为可能是育种者针对当地的农业生态条件进行形态选择或者进行多系杂交选育高产品种造成[39]。还有其他类似研究也获得了相似的结果[40-41]。本研究结果显示,形态与地理来源无严格的一致性关系,这可能与频繁的种质交换有关,地理隔离并不是引起遗传多样性的唯一因素,不同自然环境条件下的遗传漂变和自然选择可能造成遗传多样性[37]。意大利、法国、德国等国部分材料出现了地理上的交叉分布,可能是这几个国家均为菊苣起源中心、地理位置靠近,出现大量的基因流动,也可能是他们具有相同的祖先[15]。意大利菊苣品种基本聚在了一起,表明意大利不仅菊苣种质多样性丰富而且拥有自己的核心种质,这些核心种质资源与别的种质相对交流也较少。亲本间遗传距离的大小与杂种优势之间有一定的关系。但是,育种选配亲本时,不能仅以双亲地理上的差异来判断双亲遗传差异的大小,更不能将其作为选配亲本的唯一指标[42]。
对多个性状进行聚类,结果比较稳定。80份菊苣聚为5组,但主要为3种形态类型。野生材料具有野生种质稳定的遗传特性,形态特征显著,单独聚为1组,明显表现出与栽培材料和品种较远的亲缘关系。5份苦苣聚在了一个亚组内,表明遗传距离是度量菊苣种内和种间遗传差异的有效参数,但是形态分析不能把菊苣和苦苣完全鉴定出来,也可能与苦苣和菊苣亲缘关系较近有关[43]。第4组和第5组综合表型与前3组差距明显,单独聚为2组,但并不是严格按照形态类型聚类,体现了明显的遗传分化。可能是有些性状的差异被另一些性状的差异掩盖,从而造成类群间差别模糊,也可能是野生菊苣和苦苣杂交亲和性好,产生了天然杂交[44];再有可能是驯化材料是由野生种群直接驯化出来的,或者有栽培材料基因逃逸到野生材料中,因此,野生材料和栽培材料之间出现部分重叠[36]。这也暗示,可以利用人工杂交的方式,聚合野生材料和栽培材料的优异性状,得到高产、优质、高抗的菊苣新品种。
3.3 主成分分析在菊苣亲本选配中的作用
主成分分析是指在不损失或很少损失原有信息的前提下,将多个相互关联的数量性状综合为个数较少、彼此独立而且能控制所有变量的综合指标的一种方法,能够揭示性状特征之间的关系[19,27,40]。基于主成分分析结果的聚类分组有利于建立潜在的杂种优势群体,杂交育种时能够最大程度发挥杂种优势[18]。如果提取的主成分累计特征值大于70%,就可以用这几个主成分对事物的属性进行概括性分析,基本可以得出影响事物性质的主要因素。本研究中,将菊苣的9个数量性状简化成营养体和种子产量综合因子、种子产量因子和营养体产量因子等3个相互独立的主成分,这3个主成分对变异的累计贡献率达73.61%,其中营养体和种子产量综合因子的贡献率最大,为37.28%。在主成分分析结果指导育种工作时,理论上应是第一主成分值愈大愈好[40]。但在实际生产过程中,综合因子过大,可能会导致菊苣叶长、叶片数量降低,而且导致菊苣抗倒伏能力下降,因此3个因子应该根据生产目的协调发展。在具体育种工作中,选配亲本材料应依据主成分的排序,具体分析与全面评价每个亲本材料综合指标的优劣,依据菊苣育种目标,结合聚类分析,合理地选配组合,以便尽快育出高产、品质优良、抗逆性强的菊苣新品种以满足生产需求。
总之,菊苣表型性状的多元分析能有效鉴定不同生态型菊苣并进行分组,参试菊苣种质具有丰富的遗传多样性。在菊苣育种过程中,可以通过菊苣形态特征进行有目的的早期选择。菊苣生殖枝、株高以及小花数和叶片等外部性状变异较大可以用系统选育方法对其进行改良,选育出种子高产而株型低矮抗倒伏或者营养体丰富的品种。菊苣野生材料的主要经济性状表现出高度的变异,而使用野生物种可以提供一个更广的遗传基础和具有抵抗生物和非生物逆境的潜在抗性基因资源[45]。其中,野生材料PI652023小花数高达21.1个,结实性能很强,可以考虑选配为育种亲本。椭圆形叶菊苣可以作为饲草菊苣品种选育的重点基础材料。但是,本研究中形态指标不多,且数量性状很难剔除环境条件或基因显隐性的影响。因此,应加大取样的范围,选用更多的形态指标(如根、种子、花等),并结合核型分析、分子标记等手段进行育种研究[21]。
致谢:四川农业大学马迎梅老师对本研究提出宝贵的修改意见。
[1] Hauser T P,Jrgensen R B,Toneatto F.Reduced sexual compatibility between cultivated and wild chicory and their F1hybrids[J].Genetic Resources and Crop Evolution,2012,59:783-791.
[2] Baes P G,Cutsem P J.Isozyme polymorphism in three gene pools of cultivated chicory(CichoriumintybusL.)[J].Euphytica,1993,71:143-150.
[4] Kiers A M,Mes T H M,Meijden der R Van,etal.A search for diagnostic AFLP markers in cichorium species with emphasis on endive and chicory cultivar groups[J].Genome,2000,43:470-476.
[5] Bais Pal H,Ravishankar G A.CichoriumintybusL.- cultivation,processing,utility,value addition and biotechnology,with an emphasis on current status and future prospects[J].Journal of the Science of Food and Agriculture,2001,81:467-484.
[6] Wang Q Z,Cui J.Perspectives and utilization technologies of chicory(CichoriumintybusL.):A review[J].African Journal of Biotechnology,2011,10(11):1966-1977.
[7] 张玉,白史且,王曾珍,等.航天搭载菊苣种子的生物学特性研究[J].草业学报,2012,21(2):300-304.
[8] 刘建宁,石永红,侯志宏,等.4份菊苣种质材料苗期抗旱性评价[J].草业学报,2012,21(2):241-248.
[9] Sanderson M A,Labreveux M,Hall M H,etal.Nutritive value of chicory and english plantain forage[J].Crop Science,2003,43:1797-1804.
[10] Ivarsson E,Frankow-Lindberg B E,Andersson H K,etal.Growth performance,digestibility and faecal coliform bacteria in weaned piglets fed a cereal-based diet including either chicory(CichoriumintybusL.)or ribwort(PlantagolanceolataL.)forage[J].Animal,2011,5:558-564.
[11] Sulas L.Forage chicory:A valuable crop for mediterranean environments[J].Cahiers Options Mediterraneennes,2004,62:137-140.
[12] Kraker de J W,Franssen M C,Joerink M,etal.Biosynthesis of costunolide,dihydrocostunolide,and leucodin.demonstration of cytochrome P450-Catalyzed formation of the lactone ring present in sesquiterpene lactones of chicory[J].Plant Physiology,2002,129:257-268.
[14] Lema M,Kebe S,Opio R.Growth rate,carcass trait and blood chemistry of cross-bred meat goats grazing puna chicory,rackmaster refuge mix and sahara bermudagrass[J].Journal of Applied Animal Research,2008,33:1-6.
[15] Rabbani M A,Iwabuchi A,Murakami Y,etal.Phenotypic variation and the relationships among mustard(BrassicajunceaL.)germplasm from pakistan[J].Euphytica,1998,101:357-366.
[16] Ayana A,Bekele E.Multivariate analysis of morphological variation in sorghum (Sorghumbicolor(L.)moench)germplasm from ethiopia and eritrea[J].Genetic Resources and Crop Evolution,1999,46:273-284.
[17] 何庆元,王吴斌,杨红燕,等.利用SCoT标记分析不同秋眠型苜蓿的遗传多样性[J].草业学报,2012,21(2):133-140.
[18] Smith J S C,Smith O S.The description and assessment of distances between inbred lines of maize:The utility of morphological,biochemical and genetic descriptors and a scheme for the testing of distinctiveness between inbred lines[J].Maydica,1989,34:151-161.
[19] 周波,江海东,张秀新,等.部分引进牡丹品种的形态多样性[J].生物多样性,2011,19(5):543-550.
[20] 刘新龙,马丽,蔡青,等.云南甘蔗品种表型性状的遗传多样性分析[J].植物遗传资源学报,2010,11(6):703-708.
[21] Ortiz R.Morphological variation in musa germplasm[J].Genetic Resources and Crop Evolution,1997,44:393-404.
[22] Swennen R,Vuylsteke D,Ortiz R.Phenotypic diversity and patterns of variation in west and central african plantains(Musaspp.,Aab Group Musaceae)[J].Economic Botany,1995,49:320-327.
[23] Harrison R E,Luby J J,Furnier G R,etal.Differences in the apportionment of molecular and morphological variation in north American strawberry and the consequences for genetic resource management[J].Genetic Resources and Crop Evolution,2000,47:647-657.
[24] Murthy H N,Manohar S H.Estimation of phenotypic divergence in a collection ofCucumismelo,including shelf-life of fruit[J].Scientia Horticulturae,2012,148:74-82.
[26] 罗燕,白史且,彭燕,等.菊苣种质资源的重要形态性状的变异研究[J].草地学报,2011,19(1):107-113,121.
[27] Van C P,Du J P,Boutte C,etal.Distinction between cultivated and wild chicory gene pools using AFLP markers[J].Theoretical and Applied Genetics,2003,107:713-718.
[28] Andersen C,Nielsen T S,Purup S,etal.Phyto-oestrogens in herbage and milk from cows grazing white clover,red clover,lucerne or chicory-rich pastures[J].Animal,2009,(3):89-95.
[29] Amurrio J M,Ron A M D,Zeven A C.Numerical taxonomy of iberian pea landraces based on quantitative and qualitative characters[J].Euphytica,1995,82:195-205.
[30] 于万里,张博.新疆昭苏野生黄花苜蓿果实形态变异研究[J].草业学报,2012,21(2):249-255.
[31] 汪宝卿,张礼凤,戴海英,等.黄淮海地区夏大豆农艺性状的遗传变异、相关及主成分分析[J].大豆科学,2012,31(2):208-212.
[32] Grant P R,Grant B R.Hybridization of bird species[J].Science,1992,25:193-197.
[33] Fufa H,Baenziger P S,Beecher B S,etal.Comparison of phenotypic and molecular marker-based classifications of hard Red winter wheat cultivars[J].Euphytica,2005,145:133-146.
[34] Kefyalew T,Tefera H,Assefa K,etal.Phenotypic diversity for qualitative and phenologic characters in germplasm collections of tef(Eragrostis Tef)[J].Genetic Resources and Crop Evolution,2000,47:73-80.
[35] Cordell S,Goldstein G,Mueller-Dombois D,etal.Physiological and morphological variation inMetrosiderospolymorpha,a dominant hawaiian tree species,along an altitudinal gradient:the role of phenotypic plasticity[J].Oecologia,1998,113:188-196.
[36] Casas A,Caballero J,Valiente-Banuet A,etal.Morphological variation and the process of domestication ofStenocereusstellatus(Cactaceae)in central mexico[J].American Journal of Botany,1999,86:522-533.
[37] Jaradat A A,Shahid M.Patterns of phenotypic variation in a germplasm collection ofCarthamustinctoriusL.from the middle east[J].Genetic Resources and Crop Evolution,2006,53:225-244.
[38] Norberg J,Swaney D P,Dushoff J,etal.Phenotypic diversity and ecosystem functioning in changing environments:A theoretical framework[J].Proceedings of the National Academy of Sciences,2001,98:11376-11381./
[40] Dias J S,Monteiro A A,Lima M B.Numerical taxonomy of portuguese tronchuda cabbage and galega kale landraces using morphological characters[J].Euphytica,1993,69:51-68.
[41] Düzyaman E.Phenotypic diversity within a collection of distinct okra(Abelmoschusesculentus)cultivars derived from Turkish Land races[J].Genetic Resources and Crop Evolution,2005,52:1019-1030.
[42] 姜永平,吴春芳,陈惠,等.12个鲜食大豆数量性状的主成分和遗传距离分析[J].中国农学通报,2012,23(8):193-197.
[43] Simone De M,Morgante M,Lucchin M,etal.A first linkage map ofCichoriumintybusL.using a one-way pseudo-testcross and PCR-derived markers[J].Molecular Breeding,1997,3:415-425.
[44] Kiers A M,Mes T H M,Van Der Meijden R,etal.Morphologically definedCichorium(Asteraceae)species reflect lineages based on chloroplast and nuclear(Its)DNA data[J].Systematic Botany,1999,24(4):645-659.
[45] Singh R,Sharma P,Varshney R K,etal.Chickpea improvement:role of wild species and genetic markers[J].Biotechnology & Genetic Engineering Reviews,2008,25:267-313.
——植物学教材质疑(六)

