硝酸浸取磷矿制轻质碳酸钙工艺研究
胡兆平,贾洪秀,庞世花,刘阳,贾亮
(山东金正大生态工程股份有限公司,山东临沭 276700)
硝酸浸取磷矿制轻质碳酸钙工艺研究
胡兆平,贾洪秀,庞世花,刘阳,贾亮
(山东金正大生态工程股份有限公司,山东临沭 276700)
硝酸萃取磷矿后的酸解液,通过冷冻结晶法得到硝酸钙晶体,然后以硝酸钙为原料,通过加入碳酸氢铵进行碳化制取轻质碳酸钙。结果表明,碳化反应的初始反应温度为常温,硝酸钙溶液的质量分数为23%左右,碳酸氢铵和氨水按理论加入量的110%进行反应,用产品质量的4倍洗水量洗涤产品,制备的轻质碳酸钙产品各项指标均达到HG/T 2226—2000《工业沉淀碳酸钙》标准的要求。
硝酸钙;碳酸氢铵;碳化;轻质碳酸钙
冷冻法硝酸磷肥[1-2]工厂生产硝酸磷肥产品的同时副产四水硝酸钙。由于四水硝酸钙相对湿度较低,吸湿性较强,加之含氮量又很低,一般不适宜直接作化肥,往往将其加工成其他产品使用。由硝酸钙制取轻质碳酸钙,较两步法[3]制取轻质碳酸钙不仅成本低,而且提高了硝酸萃取磷矿的附加值。笔者用硝酸萃取磷矿,得到酸解液,通过冷冻结晶法得到硝酸钙晶体,然后以硝酸钙为原料,精制,碳化,制成轻质碳酸钙产品。
1 实验部分
1.1 仪器和原料
HH-S型水浴锅1台,JJ-1型精密增力电动搅拌器1台,500 mL烧杯4个,250 mL烧杯6个,玻璃棒2支,温度计2支,布氏漏斗1个,烘箱1台,PHS-3C型酸度计1台,冰箱1台,滤纸若干。
硝酸钙溶液;碳酸氢铵;浓氨水;EDTA标准溶液;三乙醇胺;钙黄绿素-甲基百里酚兰-酚酞混合指示剂(简称CMP);KOH,150 g/L。
1.2 实验内容
将硝酸钙晶体溶解,边搅拌边加入浓氨水调节pH,当pH为8.0~8.5时,停止加氨水。用布氏漏斗抽滤,得滤液。将所得滤液分成相同的n份于1#~n#的250 mL烧杯中,先固定其他条件,依次变动硝酸钙溶液浓度、反应温度、反应物加入量,搅拌10 min,抽滤,用水洗涤产品,90℃下烘干2 h。分别测量1#~n#产品沉降体积,分析产品中碳酸钙的纯度。
2 结果与讨论
2.1 反应条件对碳酸钙成品的影响
2.1.1 硝酸钙溶液浓度对碳酸钙成品的影响
固定其他反应条件,改变硝酸钙浓度,结果见图1。由图1可知,60℃条件下,硝酸钙溶液浓度越高,产品的沉降体积越大。这可能是因为钙的浓度增大,有益于晶核的形成而不利于晶体的生长,溶液的过饱和度大,晶体的粒径小,所以沉降体积大。但是,硝酸钙浓度太大,在精制过程中钙的损失率显著增大,所以,硝酸钙溶液最佳质量分数暂定为23%左右。
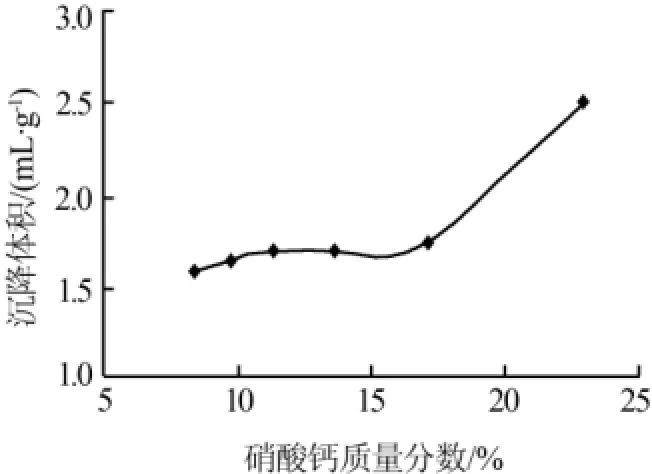
图1 硝酸钙溶液浓度对轻质碳酸钙沉降体积的影响
2.1.2 反应温度对碳酸钙产品的影响
固定其他反应条件,改变反应温度,结果见图2。由图2可见,常温下所得碳酸钙产品沉降体积最大。高温下,晶体的生长速度快于晶粒的形成速度,晶体趋向于长大。根据斯托克斯定律可知,粒径越大,沉降体积越小。

图2 反应温度对轻质碳酸钙沉降体积的影响
2.1.3 碳酸氢铵和氨水的加入量对碳酸钙产品的影响
固定其他反应条件,改变反应物的加入量进行实验。碳酸氢铵和氨水的加入量为理论量的100%时,反应不完全,沉降体积为8.79 mL/g;碳酸氢铵和氨水的加入量为理论量的105%时,有少量未完全反应,沉降体积为4.91 mL/g;碳酸氢铵和氨水的加入量为理论量的115%和120%时,反应完全,沉降体积分别为4.88 mL/g和5.11 mL/g。所以,实验最佳碳酸氢铵和氨水的加入量为理论量的110%。
2.1.4 不同洗水量对碳酸钙产品的影响
洗水量对轻质碳酸钙纯度的影响见图3。由图3可见,洗水量为72 mL时(产品质量为18 g,即洗水量是产品质量的4倍时),产品纯度即可达到99%以上。在实现工业化的过程中,洗水的这部分将被硝酸铵溶液带走,要浓缩得到硝酸铵固体,加水量越少成本越低,利润越高。所以,保证产品纯度达到优级品的最佳洗水量为产品质量的4倍。

图3 不同洗水量对轻质碳酸钙纯度的影响
2.2 自制轻质碳酸钙产品质量分析
自制轻质碳酸钙产品质量见表1。制备的轻质碳酸钙各项指标均达到HG/T 2226—2000《工业沉淀碳酸钙》标准的要求。

表1 自制轻质碳酸钙质量
2.3 轻质碳酸钙产品形貌
自制轻质碳酸钙产品的SEM图见图4。由图4可知,自制产品呈立方形颗粒,粒径大小比较均匀。

图4 自制轻质碳酸钙产品形貌
3 结论
以硝酸钙为原料制备轻质碳酸钙的最佳条件为:反应温度为常温,硝酸钙溶液质量分数为23%左右,洗水量是产品质量的4倍。制备的轻质碳酸钙各项指标均达到HG/T 2226—2000《工业沉淀碳酸钙》标准的要求。
[1]吴德桥,陈红琼,钟本和,等.我国发展硝酸磷肥的生产工艺探讨[J].磷肥与复肥,2009,24(4):36-39.
[2]冯文玉.间接冷冻法硝酸磷肥工艺流程简介[J].山西化工,1983(5):8-10.
[3]张西兴.磷石膏综合利用产出的氯化钙深加工研究[J].非金属矿,2004,27(6):6-7.
联系方式:jiahongxiu1985@163.com
Preparation of light calcium carbonate by nitric acid leaching phosphate ore
Hu Zhaoping,Jia Hongxiu,Pang Shihua,Liu Yang,Jia Liang
(Shandong Kingenta Ecological Engineering Co.,Ltd.,Linshu 276700,China)
Calcium nitrate crystal can be obtained by freezing crystallization method from acid solution acquired from nitric acid extracting phosphate rock.After that,light calcium carbonate was prepared by carbonization reaction between ammonium hydrogen carbonate and calcium nitrate crystal.Results show that,the initial carbonization reaction temperature was the normal temperature,mass fraction of calcium nitrate solution was about 23%,ammonium hydrogen carbonate and ammonia dosages were both 110%of theoretical addition amounts,and products were washed by four times of product weight washing water.All quality indexes of the product can meet the standard of Industrial Precipitated Calcium Carbonate,HG/T 2226—2000.
calcium nitrate;ammonium hydrogen carbonate;carbonization;light calcium carbonate
TQ132.32
A
1006-4990(2013)07-0042-02
2013-03-15
胡兆平(1966—),男,本科,主要从事肥料方面的研究工作,已发表文章8篇,现获国家授权专利6项。

