5-羟基雷公藤内酯醇不是P-糖蛋白底物或抑制剂*
徐佳 向志雄 刘海燕
(上海医药集团股份有限公司中央研究院 上海 201203)
类风湿性关节炎(RA)是一种常见且顽固的慢性全身性自身免疫系统疾病,多数免疫抑制剂对机体免疫系统的作用缺乏特异性和选择性,毒副作用大,限制了其广泛使用[1-2]。(5R)-5-羟基雷公藤内酯醇(简称T8)是我院正在开发的用于治疗类风湿性关节炎的一类创新药物,与其先导化合物雷公藤内酯醇相比,具有更强的成药性[3]。该化合物目前已经进入I期临床研究阶段,需要评价其药物-药物相互作用的可能性。
P-gp是由多药耐药1基因(mdr1)编码的ATP依赖性膜蛋白,作为药物泵出转运子的P-gp可在许多组织中表达,是某些药物的生物利用度低下和产生药物-药物相互作用或药物-食物相互作用的原因[4-7]。P-gp分子上有多个药物结合位点,故其底物范围非常广泛。由于P-gp底物和分布的广泛性,在合用药物时,可能发生竞争性或非竞争性的药物相互作用,影响药动学过程,引起临床疗效的改变或产生毒性[8-9]。美国食品和药品管理局(FDA)规定须从药物代谢动力学角度评价化合物是否是P-gp的底物或抑制剂[10]。
人类mdr1基因转染犬肾上皮细胞系MDCK(Madin-Daby canine kidney)后形成 MDCK-MDR1细胞系,融合后形成不规则的多层细胞膜,P-gp 在上层细胞膜上高表达,专一性地用来判断药物是否是依赖P-gp转运的底物或抑制剂,可利用其作为肠道黏膜和血脑屏障药物透过性的体外快速筛选模型[11-13]。我们利用MDCK-MDR1细胞模型快速预测T8是否是依赖P-gp介导的底物或抑制剂,为临床药物-药物相互作用研究提供参考。
1 材料与方法
1.1 材料
1.1.1 药品与试剂
培养基:高糖DMEM培养基 (Gibco),含肝素 (国药集团化学试剂有限公司) 50 mg/L、谷氨酰胺(Gibco)200 mg/L( 用 NaHCO3调 pH 7.2 ~ 7.4)、双抗生素(100 U/ml青霉素和 100 μg/ml链霉素,Gibco)10 ml/L、10%(v/v)胎牛血清 FBS(Gibco)、用 0.22 µm 微孔滤膜过滤除菌,4 ℃保存;胰蛋白酶0.25%(w/v)Trypsin-EDTA(Gibco);荧光素钠(国药集团化学试剂有限公司);阿替洛尔(中国药品生物制品检定所);普萘洛尔(中国药品生物制品检定所);紫杉醇(本院药物制剂室);Rho123(美国Sigma公司);环孢素 A(美国Sigma公司,简称CsA);替硝唑(Sigma);双氯芬酸(中国药品生物制品检定所);MDCK-MDR1细胞系; T8由我院合成室提供,结构式见图1。试验用水为灭菌去离子水,其他试剂均为国产分析纯及以上规格。

图1 T8的结构式
1.1.2 实验仪器
细胞电阻仪(Millicell-ERS voltohmmeter,美国Millipore 公司);Millipore 插入式培养器(PCF 膜,膜孔径0.4 µm,直径12 mm,美国Millipore 公司);24孔培养板(美国Corning公司); 生物安全柜(美国Labconco公司);CO2恒温培养箱(美国Thermo Fisher Scientific公司);TS100 型倒置显微镜(日本尼康公司); CBS-47液氮罐; ZHWY-103B多振幅轨道式恒温培养振荡器(上海智城分析仪器制造有限公司); 酶标仪 (Thermo Varioskan Flash,美国Thermo Fisher Scientific公司);API4000 QTRAP 型串联质谱仪(美国 Applied Biosystem公司),配有电喷雾离子源(ESI)以及Analyst 1.5.1 数据处理软件;Waters Acquity UPLC 系统(美国 Waters 公司),包括四元输液泵,自动进样器。
1.2 方法
1.2.1 细胞培养
将需复苏的细胞移至含20 ml高糖DMEM细胞培养液的T-75组织培养瓶中置于37 ℃培养箱于5% CO2、饱和湿度的条件下培养,待细胞长满单层后进行传代点板,接种(1.5×105个细胞/ml)到转运系统(Millipore 插入式培养器和24孔培养板组成转运系统,见图2)的PCF膜的AP侧,每孔0.4 ml,以后每天换液培养至第4天进行实验。

图2 转运系统图示
1.2.2 MDCK-MDR1细胞模型的完整性考察
将MDCK-MDR1细胞培养至第4天,以荧光素钠和阿替洛尔作为吸收性差的检漏药物对细胞模型进行评价。转运实验方案为将荧光素钠(终浓度10 μmol/L)或阿替洛尔(终浓度1 μmol/L)分别从AP侧给药(接收侧加入空白Hanks溶液,BL侧0.6 ml),90 min后从BL侧取细胞通透液(n=3)。
1.2.3 评价T8是否是P-gp的底物
细胞培养至第4天进行转运实验。第一组,在转运系统两侧加入空白Hanks溶液(AP侧0.4 ml,BL侧0.6 ml),平衡10 min后轻轻吸出。转运实验方案为将T8(终浓度1 μmol/L)和普萘洛尔(终浓度5 μmol/L)合用,分别从AP侧和BL侧给药(接收侧加入空白Hanks溶液,AP侧0.4 ml,BL侧0.6 ml),90 min后分别从BL侧和AP侧取细胞通透液(n=3)。第二组:分别在AP侧和BL侧加入含CsA终浓度为10 μmol/L的Hanks溶液(AP侧0.4 ml,BL侧0.6 ml),平衡10 min后轻轻吸出。转运实验方案为将T8(终浓度1 μmol/L)和普萘洛尔(终浓度5 μmol/L)和P-gp抑制剂CsA(终浓度10 μmol/L)合用,分别从AP侧和BL侧给药(接收侧加入含CsA浓度为10 μmol/L的Hanks溶液,AP侧0.4 ml,BL侧0.6 ml),90 min后分别从BL侧和AP侧取细胞通透液(n=3)。以Rho123和紫杉醇为阳性对照(也合用普萘洛尔为内参物),方案为将上述转运方案中的T8(终浓度1 μmol/L)替换为 Rho123(终浓度 5 μmol/L)或紫杉醇(终浓度 5 μmol/L)。
1.2.4 评价T8是否是P-gp的抑制剂
细胞培养至第4天进行转运实验时,分别以Rho123和紫杉醇为底物、CsA为P-gp的阳性抑制剂。以Rho123为底物时,在转运系统两侧加入空白Hanks溶液(AP侧0.4 ml,BL侧0.6 ml),平衡10 min后轻轻吸出,第一组转运实验方案为将Rho123(终浓度5 μmol/L)和普萘洛尔(终浓度5 μmol/L)合用,分别从AP侧和BL侧给药(接收侧加入空白Hanks溶液,AP侧0.4 ml,BL侧0.6 ml),90 min后分别从BL侧和AP侧取细胞通透液(n=3)。第二组转运实验方案为将Rho123(终浓度5 μmol/L)和普萘洛尔(终浓度5 μmol/L)和CsA(终浓度10 μmol/L)合用,分别从AP侧和BL侧给药(接收侧加入含CsA终浓度为10 μmol/L的Hanks溶液,AP侧0.4 ml,BL侧0.6 ml),90 min后分别从BL侧和AP侧取细胞通透液(n=3)。第三组转运实验方案为将Rho123(终浓度5 μmol/L)和普萘洛尔(终浓度5 μmol/L)和T8(终浓度1 μmol/L)合用,分别从AP侧和BL侧给药(AP侧0.4 ml,BL侧0.6 ml),90 min后分别从BL侧和AP侧取细胞通透液(n=3)。第四组转运实验方案为将Rho123(终浓度5 μmol/L)和普萘洛尔(终浓度5 μmol/L)和 T8(终浓度 5 μmol/L)合用,分别从 AP侧和BL侧给药(AP侧0.4 ml,BL侧0.6 ml),90 min后分别从BL侧和AP侧取细胞通透液(n=3)。以紫杉醇为底物,方案为将上述转运方案中的Rho123(终浓度5 μmol/L)替换为紫杉醇(终浓度 5 μmol/L)。
1.2.5 样品处理方法
100 µl细胞通透液加入100 µl含内标替硝唑(0.1 μg/ml)的乙腈,混合10 min沉淀蛋白,离心(6 000 g,10 min)后取70 µl加入96孔板,用串联质谱仪对化合物T8和阳性对照紫杉醇、阿替洛尔和普萘洛尔进行定量测定。T8的内标为含0.5 μmol/L的双氯芬酸,阳性对照紫杉醇、阿替洛尔和普萘洛尔的内标为0.1 μg/ml的替硝唑。
1.2.6 样品测定方法
1)色谱条件 色谱柱 :BEH C18(1.7 µm,50 mm× 2.1 mm 内径,美国Waters 公司);流速:0.3 ml/min;柱温:30 ℃;自动进样器温度:4 ℃;进样量:5 µl。
2)质谱条件 离子源:电喷雾离子源(ESI),检测方式: T8和双氯芬酸为负离子检测,其余化合物为正离子检测;离子源温度(TEM): 400 ℃;雾化气(Gas1,N2)压力:50 psi;辅助气(Gas2,N2)压力:50 psi;气帘气(CUR)压力:10 psi;扫描方式为多重反应监测(MRM);碰撞气(CAD,N2)压力:中;用于定量分析的离子反应如表1。

表1 质谱条件
3) Rho123和荧光素钠测定 用Thermo Varioskan Flash 酶标仪测定Rho123和荧光素钠此类质谱响应差但有荧光吸收的物质。Rho123的激发波长为498 nm 发射波长为530 nm;荧光素钠的激发波长为491 nm,发射波长为514 nm。
1.2.7 数据分析
1)评价T8是否是P-gp的底物 表观透过系数Papp的计算公式如下[10]:

公式中:表观透过系数Papp(cm/s)反映药物在肠上皮细胞中药物的渗透能力;VR表示接收室的溶液体积(ml);A表示膜的面积(此时A为0.6 cm2);C0表示供试液中药物的起始浓度(μg/ml);dC/dt表示接收室在单位时间获得的药物浓度[μg/(ml·s)]。分别计算AP侧向BL 侧转运的Papp(AP-BL)和 BL 侧向 AP 侧转运的Papp(BL-AP)。外排比(Efflux Ratio)的计算公式如下:

MDCK-MDR1细胞实验中以校正外排比(Corrected Efflux Ratio,CER)表示P-gp外排能力:
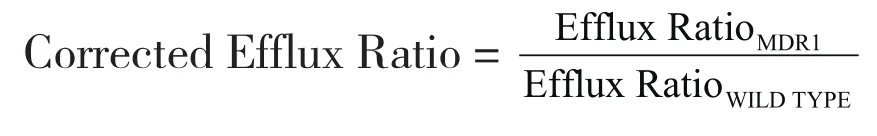
Efflux RatioMDR1为BL-AP以及AP-BL方向底物的表观透过系数比值;Efflux RatioWILDTYPE为抑制剂CsA存在条件下底物两个方向的表观透过系数比值。
2) 评价T8是否是P-gp的抑制剂 抑制率(Inhibition Degree)按下式计算[14-15]
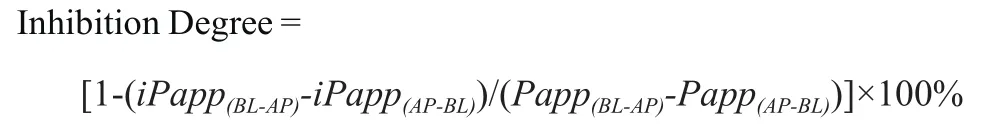
Papp(BL-AP)和Papp(AP-BL)分别为BL-AP以及AP-BL方向底物的表观透过系数。iPapp(BL-AP)和iPapp(AP-BL)分别为抑制剂存在条件下底物两个方向的表观透过系数。
2 实验结果
2.1 MDCK-MDR1细胞模型的完整性考察
当MDCK-MDR1细胞培养至第4天时,以荧光素钠和阿替洛尔作为吸收性差的检漏药物、普萘洛尔为阴性对照(确定不是P-gp底物)、Rho123和紫杉醇为阳性对照(确定是P-gp底物)合并给药,并且结合细胞的跨膜电阻和形态学指标来对MDCK-MDR1细胞模型进行评价。
1)光学显微镜观察结果 可见细胞生长均匀,边界清晰(图3)。
2)细胞的跨膜电阻(TEER值) 每天测电阻,电阻会呈现先上升后下降的趋势,在第4天做转运实验,Hanks溶液中的电阻约为 50~ 100 Ω·cm2。
3)检漏标记物 MDCK在Millicell PCF 膜上生长4 d后,AP侧到BL侧方向,10 μmol/L荧光素钠和1 μmol/L 的阿替洛尔的Papp分别为 9.79×10-7cm/s和8.81×10-7cm/s,满足实验要求,和文献报道一致[16],表明MDCK-MDR1细胞间隙建立,细胞模型建立成功。

图3 显微镜下MDCK 细胞形态(40×)
4)对照化合物 当 MDCK-MDR1细胞模型长至第4天时,以普萘洛尔为阴性对照(确定不是P-gp底物),实验结果数值接近1;以Rho123和紫杉醇为阳性对照(确定是P-gp底物),实验结果数值大于2;表明MDCKMDR1细胞模型建立成功。
2.2 评价T8是否是P-gp的底物实验结果
结果(表2)提示T8是高透过性化合物,T8的外排比为1.07,FDA规定外排比大于2即为P-gp的潜在底物[10],所以T8不是P-gp的潜在底物。

表2 T8的表观透过系数和校正外排比
2.3 评价T8是否是P-gp的抑制剂实验结果
分别以Rho123(表3)和紫杉醇(表4)为底物时,1 μmol/L和5 μmol/L的T8对这两个底物的转运没有影响,外排比基本没有改变,抑制率基本为0,因此T8不是P-gp的抑制剂。
3 讨论
MDCK-MDR1 细胞培养周期短,代与代之间均一性良好,并且获得了P-gp的高表达,因此是研究药物双向转运率、吸收转运机制、预测体内吸收和药物相互作用、新药设计、快速筛选及评价药物安全性的一个较为理想的体外模型[14]。本研究结果表明T8的转运不受P-gp外排的影响,但是T8的转运过程是否存在其他影响因子(如其他多药耐药性蛋白、ATP 酶以及细胞间隙等因素)尚需进一步的研究。

表3 以Rho123为底物的T8抑制率

表4 以紫杉醇为底物的T8抑制率
药物进出细胞的方式包括主动转运、被动转运、细胞旁路通过及胞吞。荧光素钠和阿替洛尔以细胞旁路通过的方式进入细胞,因此采用其来检测单层细胞的完整性,测定方法简单、快捷、可靠[16]。
本研究中选用普萘洛尔作为内参物与T8以及每个P-gp底物共同给药,目的是更好地监测MDCK细胞上P-gp的功能,其校正外排比基本都在1左右或低于1。有文献报道[17-18]普萘洛尔不受P-gp转运的影响,但可能对P-gp的功能有一定影响。我们的实验结果表明普萘洛尔不影响P-gp的功能,因为阳性药的结果都符合要求。
根据临床前动物实验,预测I期临床试验中最大给药剂量为4~8 mg,推测人体最大血药浓度0.5~1 μmol/L,因此底物实验中浓度设置为1 μmol/L,抑制剂实验中浓度设置为1 μmol/L 和 5 μmol/L。
总体结果表明T8既不是P-gp的底物也不是P-gp的抑制剂,因此在吸收、分布、代谢以及排泄阶段T8与P-gp的抑制剂和底物发生相互作用的可能性很小。
[1] 张品南, 陈艳梅.内风湿关节炎的研究进展[J]. 中华临床医师杂志, 2008, 11(1): 59-61.
[2] 刘春芳, 林娜.雷公藤甲素抗类风湿性关节炎机制研究进展[J]. 中国中药杂志, 2006, 31(19): 1575-1579.
[3] Zhou R, Zhang F, He PL,et al.(5R)-5-hydroxytriptolide(LLDT-8), a novel triptolide analog mediates immunosuppressive effectsin vitroandin vivo[J]. Int Immunopharmacol, 2005, 5 (13-14): 1895-1903.
[4] 刘瑶, 曾苏.MDCK-MDR1细胞模型及其在药物透过研究中的应用进展[J].药学学报, 2008, 43(6): 559-564.
[5] Polli JW, Wring SA, Humphreys JE,et al.Rational use ofin vitroP-glycoprotein assays in drug discovery [J]. J Pharmacol Exp Ther, 2001, 299(2) : 620-628.
[6] Simons K, Ikonen E. Functional rafts in cell membranes[J].Nature, 1997, 387(6633): 569-572.
[7] Luker GD, Pica CM, Kumar AS,et al.Effects of cholesterol and enantiomeric cholesterol on P-glycoprotein localization and function in low-density membrane domains[J].Biochemistry, 2000, 39(26): 7651-7661.
[8] Tang F, Horie K, Borchardt RT.Are MDCK cells transfected with the human MDR1 gene a good model of the human intestinal mucosa? [J]. Pharm Res, 2002, 19(6): 765-772.
[9] Gumbleton M, Audus KL.Progress and limitations in the use ofin vitrocell cultures to serve as a permeability screen for the blood-brain barrier[J]. J Pharm Sci, 2001, 90(11):1681-1698.
[10] Guidance for industry: drug interaction studies - study design, data analysis, implications for dosing, and labeling recommendations[EB/OL]. [2013-01-14]. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInfor mation/Guidances/ucm292362.pdf.
[11] Veronesi B.Characterization of the MDCK cell line for screening neurotoxicants[J]. Neurotoxicology, 1996, 17(2):433-443.
[12] Irvine JD, Takahashi L, Lockhart K,et al.MDCK ( Madin-Darby canine kidney) cells: a tool for membrane permeability screening[J]. J Pharm Sci, 1999, 88(1): 28-33.
[13] Pastan I, Gottesman MM, Ueda K,et al.A retrovirus carrying an MDR1 cDNA confers multidrug resistance and polarized expression of P-glycoprotein in MDCK cells[J].Proc Natl Acad Sci USA, 1988, 85(12): 4486-4490.
[14] Balimane PV, Patel K, Marino A,et al.Utility of 96 wellCaco-2 cell system for increased throughput of P-gp screening in drug discovery[J].Eur J Pharm Biopharm, 2004, 58(1):99-105.
[15] Kim RB, Wandel C, Leake B,et al.Interrelationship between substrates and inhibitors of human CYP3A and P-glycoprotein[J]. Pharm Res, 1999, 16(3): 408-414.
[16] Rusinko A, Hellberg MR, May JA,et al. Use of MDCK cell line to predict corneal penetration of drug.US 7297505[P].2005-10-27.
[17] Bachmakov I, Werner U, Endress B,et al.Characterization of beta-adrenoceptor antagonists as substrates and inhibitors of the drug transporter P-glycoprotein[J]. Fundam Clin Pharmacol, 2006, 20(3): 273-282.
[18] Collett A, Tanianis-Hughes J, Warhurst G. Rapid induction of P-glycoprotein expression by high permeability compounds in colonic cellsin vitro: a possible source of transporter mediated drug interactions? [J]. Biochem Pharmacol, 2004,68(4): 783-790.

