石煤酸浸提钒浸出液萃取试验研究*
王 一 张一敏 黄 晶 刘 涛 李 望 张国斌
(武汉科技大学资源与环境工程学院)
石煤是我国重要的含钒资源,钒在石煤中的赋存形式及价态变化多样[1],但大多以类质同象形式赋存于铝硅酸盐矿物晶格中,或以吸附形式存在于有机质或铝硅酸盐矿物中[2-3]。传统石煤提钒工艺流程为钠化焙烧—水浸—树脂吸附[4],此工艺在生产过程中若控制不当易产生废气污染,且钒的回收率不高。目前常用的石煤空白焙烧—直接酸浸工艺污染少且浸出率较高,但该工艺酸浸过程选择性差,强酸性条件下杂质元素亦进入溶液,导致酸浸液成分复杂、杂质含量较高,并且溶液的pH值也较低。目前还没有一种树脂可以在酸性环境中对钒进行吸附,所以采用离子树脂交换法难以实现酸浸液中钒的分离和回收。萃取法具有平衡速度快、分离效果好、处理能力大、金属回收率高、生产过程容易实现自动化控制等特点,因此被广泛用于金属的净化和富集[5-6]。
本试验以湖北某地含钒石煤为原料,用溶剂萃取法对石煤酸浸提钒浸出液(以下简称酸浸液)的净化富集进行研究。磷酸二异辛酯(P204)对V4+选择性好[7],因此,本试验以P204为萃取剂,对水相与有机相体积比、萃原液pH值、萃取时间,反萃水相与有机相体积比、反萃剂的浓度进行研究,并对酸浸液中Fe3+对钒萃取的影响进行研究。
1 试验原料及试验方法
1.1 试验原料及酸浸液的制备
1.1.1 试验原料
试验原料为湖北某地石煤,主要化学成分分析结果见表1,XRD图谱见图1。

表1 石煤原矿主要化学成分分析结果 %

图1 石煤原矿XRD分析结果
从表1可以看出,试验原料属低钒高钙石煤。
从图1可以看出,试验原料主要矿物组分为石英、白云母、方解石等。
1.1.2 酸浸液的制备
将原料破碎至3~0 mm,在KRY-10马弗炉中于800℃下焙烧60 min,焙烧后的熟样细磨至-74 μm占75%(称为焙烧粉料)。焙烧粉料按液固质量比1.5∶1加入体积浓度15%的H2SO4溶液和一定量的助浸剂,在95℃左右搅拌浸出6 h[8],经固液分离得到浸出液,浸出液中各主要金属离子的浓度见表2。

表2 酸浸液主要金属离子浓度分析结果 mg/L
从表2可以看出,酸浸液中除钒外还有大量的杂质离子,其中Fe3+对钒的后续萃取影响较大。
1.2 试验方法
酸浸液先用Na2SO3(用量与酸浸液中TFe的物质的量相同)还原Fe3+,用石灰乳调节pH值至一定值,抽滤出沉淀物,得萃原液。常温(25℃)下将萃原液与配制好的萃取剂(P204、TBP、磺化煤油质量比为20∶5∶75)按一定的相比混合,搅拌萃取一定时间,然后移至分液漏斗中静置一定时间,待油相与水相分层清晰后,分出水相(即萃余液)。如此反复萃取5次(即5级萃取),分析5级萃余液中钒的含量,按下式计算萃取率:

含钒4.5 g/L负载有机相和一定浓度的H2SO4按一定相比混合反应,移至分液漏斗中静置至有机相和水相分层清晰,分出水相(即反萃液),分析反萃液中钒的含量,按下式计算反萃率:

1.3 试验药剂及设备
萃取剂磷酸二异辛酯(P204)、协萃剂磷酸三丁酯(TBP)、CaO、硫酸均为化学纯,稀释剂磺化煤油为自制。
试验设备为国华磁力加热搅拌器,雷磁PHS-3CpH计,烧杯,分液漏斗。
2 试验结果与讨论
2.1 萃取过程水相与有机相相比试验
萃取是有机相或水相中的物质进入另一相的液液反应,不同的相比对萃取影响显著。萃取相比试验的萃原液pH=2,萃取反应时间为8 min,试验结果见图2、表3。
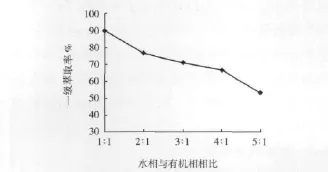
图2 一级萃取过程相比试验结果

表3 5级萃取过程相比试验结果 %
从图2、表3可以看出,水相与有机相相比从1∶1提高至5∶1,一级萃取率从90.12%显著下降至53.62%,表明有机相的不足将导致一级萃取率的显著下降;在5级萃取的情况下,相比提高至5∶1时,最终萃取率呈先慢后快的下降趋势,但均超过95%;在萃取剂总量相同的情况下,多级萃取的总萃取率高于一级萃取的萃取率。
萃取过程的相比太低,虽然可减少萃取级数,但单位有机相利用率不高,且对萃取设备体积和动力的要求高,因而投资和生产成本也高;相比太高,萃取所要求的级数也更高,流程也就更长。综合考虑,确定后续萃取试验水相与有机相相比为3∶1。
2.2 萃原液pH值试验
萃原液pH值试验的相比为3∶1,萃取反应时间为8 min,试验结果见图3。
从图3可以看出,萃原液pH值从1.2升高至2.4,一级萃取率从36.23%上升至76.30%,pH值较低时升速更显著,表明提高萃原液的pH值可以提高萃取率。
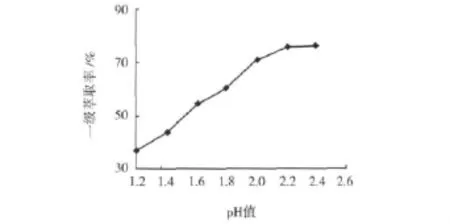
图3 萃原液pH值试验结果
进一步的研究表明:①石灰乳调节酸浸液的pH值时会产生大量沉淀,导致溶液中钒的损失,pH= 2.0时钒的损失为3%左右,pH=2.4时钒的损失快速升至20%左右。②pH值的上升会使Fe3+,Mg2+,Al3+等杂质离子与萃取剂的反应变得容易,从而大量进入有机相,最终导致萃取起不到富集、净化酸浸液的目的,严重时甚至使有机相因萃取了杂质离子而中毒,失去萃取能力。综合考虑,确定后续试验萃原液的pH=2。
2.3 萃取时间试验
萃取时间试验的相比为3∶1,萃原液pH=2,试验结果见图4。
从图4可以看出,随着萃取时间的延长,一级萃取率呈先上升后走平的趋势,8 min即达到高点,对应的一级萃取率为71.10%。萃取时间过长,一级萃取率不再上升的主要原因有:①萃取剂在优先萃取钒的同时也在缓慢萃取其他杂质离子,杂质离子的进入干扰了钒离子的继续萃取;②随着水相中钒离子浓度的下降、有机相中钒离子浓度的上升,钒离子进入有机相的速度与逆向运动速度逐步达到平衡,从而表现出萃取率不再上升。综合考虑,确定后续试验的萃取时间为8 min。

图4 萃取时间试验结果
2.4 酸浸液预处理对钒萃取的影响试验
酸浸液预处理对钒萃取影响试验先用Na2SO3对酸浸液中的Fe3+进行还原,还原试验的TFe与Na2SO3的物质的量之比为1∶1,还原前后酸浸液的主要金属离子的浓度见表4。

表4 酸浸液还原前后主要金属离子浓度对比 mg/L
从表4可以看出,酸浸液经预处理,Fe3+浓度大幅度下降、Fe2+浓度大幅度上升、Na+浓度明显上升,其他离子浓度没有变化。
用同样的方法将还原前后的酸浸液制成pH=2的萃原液,萃取试验的相比为3∶1,萃取时间为8 min,试验结果见表5。
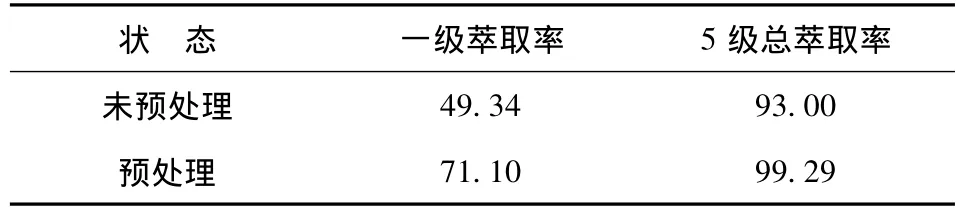
表5 酸浸液预处理对钒萃取率影响试验结果 %
从表5可以看出,酸浸液经预处理,钒的一级萃取率显著高于不对酸浸液进行预处理;经过预处理后,钒的5级总萃取率提高了6.29个百分点。因此,用Na2SO3对酸浸液进行预处理很有必要。
在酸性溶液中,钒以VO2+形式存在,而铁则大部分以Fe3+形式存在,性质相近,磷类萃取剂P204对VO2+和 Fe3+的萃取能力均极强,但不能萃取Fe2+,而Na2SO3可将溶液中的Fe3+还原成Fe2+,因此,用Na2SO3预处理酸浸液可改善萃取剂P204对钒的萃取,抑制铁离子进入有机相[9-13]。
2.5 反萃过程有机相与水相相比试验
反萃相比试验的反萃时间为10 min,反萃剂硫酸溶液的体积浓度为8%,试验结果见图5、表6。

图5 一级反萃过程相比试验结果

表6 8级反萃过程相比试验结果 %
从图5、表6可以看出,有机相与水相相比从4∶1提高至12∶1,一级萃取率从30.08%显著下降至15.13%,表明反萃剂的不足将导致一级萃取率的显著下降;随着相比从4∶1提高至12∶1,8级总萃取率呈先慢后快的下降趋势,但均超过94%;多级萃取可以显著提高总萃取率。
反萃相比太低,虽然可减少萃取级数,但单位反萃剂利用率不高,且对反萃设备体积和动力的要求高,因而投资和生产成本也高;反萃相比太高,反萃所要求的级数也更高,流程也就更长。综合考虑,确定后续反萃试验有机相与水相相比为10∶1。
2.6 反萃剂浓度试验
反萃剂浓度试验的反萃时间为10 min,有机相与水相相比为10∶1,试验结果见表7。

表7 反萃剂浓度试验结果
从表7可以看出,随着硫酸体积浓度的提高,一级反萃率明显上升;用较低浓度的反萃液达到相同的总反萃率所需的反萃级数较高。
进一步的研究表明,硫酸浓度过高,会增加后续调pH值所需的氨水的量,并且反萃剂中钒浓度过高(>100 g/L),在用NaClO3氧化沉钒过程中会出现水解沉钒的现象,影响钒的质量。因此,确定反萃剂硫酸溶液的体积浓度为8%,反萃级数为8级。
3 结论
(1)用Na2SO3对酸浸液进行预处理可以高效地将酸浸液中Fe3+还原成Fe2+,从而有效地减少Fe3+对V4+萃取的影响,提高相同萃取级数下的萃取率。
(2)试验确定的萃原液pH=2,萃取过程有机相与水相相比为3∶1,萃取时间为8 min,5级萃取的总萃取率为99.29%;反萃过程有机相与水相相比为10∶1,反萃剂硫酸溶液的体积浓度为8%,反萃级数为8级,反萃总萃取率为99.80%。
[1] Zhang Y M,Bao SX,Liu T,et al.The technology of extracting vanadium from stone coal in China:History,current status and future prospects[J].Hydrometallurgy,2011,109:116-124.
[2] 陈铁军,邱冠周,朱德庆.石煤循环氧化法提钒焙烧过程氧化机理研究[J].金属矿山,2008(6):62-66.
[3] 杨 东,张一敏,刘 涛,等.石煤焙砂浸出提钒水溶液循环利用研究[J].金属矿山,2009(6):77-79.
[4] 姬云波,童 雄.叶国华.提钒技术的研究现状和进展[J].国外金属矿选矿,2007(5):10-13.
[5] Chen X Y,Lan X Z,Zhang Q L,et al.Experimental study on leaching vanadium by high concentration sulfuric acid from stone coal[J].Transactions of NonferrousMetals Society of China,2010,20: 123-127.
[6] He D S,Feng Q M,Zhang G F,et al.An environmental-friendly technology of vanadium extraction from stone coal[J].Minerals Engineering,2001,20(11):1184-1186.
[7] 胡建锋,朱 云.P204萃取硫酸体系中钒的性能研究[J].稀有金属,2007,31(3):367-370.
[8] 杨 晓,张一敏,刘 涛,等.助浸剂CX对石煤酸浸提钒过程的影响[J].金属矿山,2012(3):86-89.
[9] 杨静翎,金 鑫.酸法提钒新工艺的研究[J].北京化工大学学报,2007,34(3):254-257.
[10] 曹耀华,高照国,刘红召,等.萃取法从含钒酸浸液中提取钒的研究[J].河南化工,2007,26(6):20-23.
[11] 田永淑,朱 靖.石煤灰渣中提取五氧化二钒的新工艺[J].矿产综合利用,2006(6):22-24.
[12] 鲁兆伶.用酸法从石煤中提取五氧化二钒的试验研究与工业实践[J].湿法冶金,2002,21(4):175-183.
[13] 刘旭娃,吴海鹰,戴子林,等.硫酸浸出钒矿的萃原液预处理对萃取的影响研究[J].矿冶工程,2006,26(5):65-67.

