CYP2C9和VKORC1基因多态性对华法林稳定剂量的影响
武建才,赵克斌,胡 敏
华法林是一种香豆素类口服抗凝药,具有抗凝和溶栓的双重作用。但由于华法林抗凝治疗窗窄,抗凝不当很容易导致出血或栓塞,甚至危及病人生命。因此,如何在临床上合理有效使用华法林长期以来一直是临床医生关注的重点和难点。近年来随着药物基因组学研究的不断深入,大量研究表明,CYP2C9和VKORC1基因多态性是造成个体间华法林稳定剂量差异的主要原因,故本研究旨在结合非遗传因素探讨山西地区汉族人群CYP2C9*3(1075A>C)和 VKORC1(-1639G>A)基因型分布特点及对华法林日均维持剂量的影响,从而辅助临床医生指导患者个体化华法林的使用。
1 资料与方法
1.1 研究对象 收集2012年1月——2012年7月到山西医科大学第一医院复查抗凝指标的服用华法林抗凝患者179例(病例组),其中男84例,女95例,年龄(53.93±12.12)岁,体重指数(BMI)22.61 kg/m2±3.40 kg/m2。对照组为同期到我院门诊健康体检者150名,男72名,女78名,年龄(52.98±13.20)岁,所有入选对象均来自山西地区的汉族居民,相互间无血缘关系及异族通婚史。入选标准:年龄≥18岁、稳定抗凝超过1个月、国际化标准比值(INR)1.7~3.0[1]。排除标准:肝肾及甲状腺功能不全、营养不良或怀孕者、服用可能与华法林有相互作用药物(如胺碘酮、维生素K抑制剂等)的患者、有凝血功能障碍、华法林过敏者。
1.2 试验方法
1.2.1 标本采集及处理 在受试者知情同意的前提下,采集服药后空腹12 h外周静脉血3 m L(枸橼酸钠抗凝),用于检测CYP2C9*3(1075A>C)和VKORC1(-1639 G>A)基因型,全血标本-20℃保存。同时采集患者的基本资料:年龄、性别、身高、体重、病因、伴随药物、使用华法林剂量及最近3次所测INR值等,计算BMI。INR值测定结果由山西医科大学第一医院检验科生化室提供。基因组DNA提取采用全血基因组DNA提取试剂盒(购自天根生化科技有限公司),将提取好的基因组DNA-20℃保存。
1.2.2 扩增阻滞突变体系-聚合酶链式反应技术(ARMS-PCR)法扩增 本研究所采用的ARMS-PCR引物和探针序列由北京鑫诺美迪基因检测技术有限公司提供,委托生物工程(上海)有限公司合成、纯化。采用25μL ARMS-PCR扩增反应体系:PCR反应液12.5μL,引物探针混合液6.5μL,超纯水4μL,基因组DNA 2μL。反应仪器:美国安捷伦 Mx3000荧光定量PCR仪。反应条件:95℃预变性3 min,94℃变性15 s,60℃退火延伸35 s,共40个循环。
1.3 统计学处理 所有统计数据均用SPSS 13.0统计软件分析,计数资料采用卡方检验,计量资料用均数±标准差(±s)表示,采用t检验或秩和检验,对患者和健康受试者的基因型频率比较采用Fish精确检验,P<0.05为差异有统计学意义。
2 结 果
2.1 入选患者基本特征(见表1)
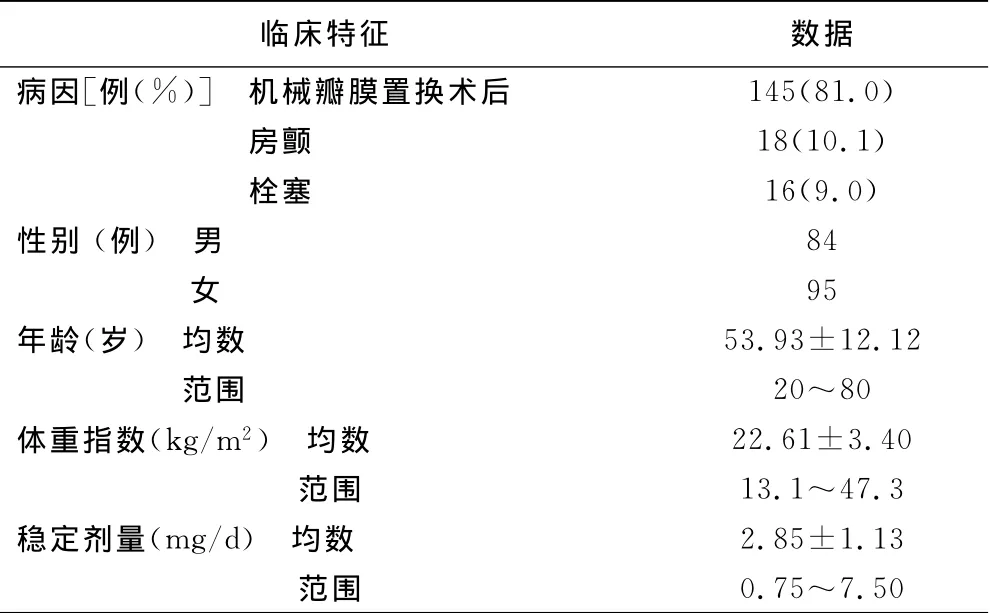
表1 入选患者基本临床特征
2.2 两组基因型及等位基因频率分布
2.2.1 CYP2C9*3(1075A>C)基因型及等位基因频率分布在入选的329例中,CYP2C9*3(1075A>C)AA型293例(89.1%),AC型33例(10.0%),AC型3例(0.9%),说明中国汉族人群中CYP2C9*3(1075A>C)以AA型为主。等位基因A和C的频率分别为94.1%和5.9%,说明在中国汉族人群中以等位基因A为主。两组间CYP2C9*3(1075A>C)基因型及等位基因频率分布比较差异无统计学意义(P>0.05),可认为正常人和患者之间SNP分布无差异。详见表2。
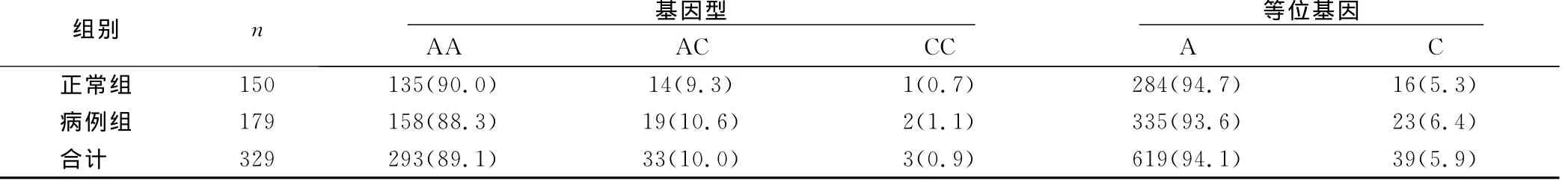
表2 CYP2C9*3(1075A>C)基因型及等位基因频率比较 例(%)
2.2.2 VKORC1(-1639 G>A)基因型及基因频率分布 在入选的329例中,VKORC1(-1639 G>A)AA型278例(84.5%),GA型51例(15.5%),未发现GG型,说明在中国汉族人群中VKORC1(-1639 G>A)基因以AA型分布为主。A和G的等位基因频率分别为92.3%和7.7%,说明在中国汉族人群中以等位基因A为主。两组间VKORCL(-1639G>A)基因及等位基因频率比较差异无统计学意义(P>0.05),可认为正常人和患者之间SNP分布无差异。详见表3。
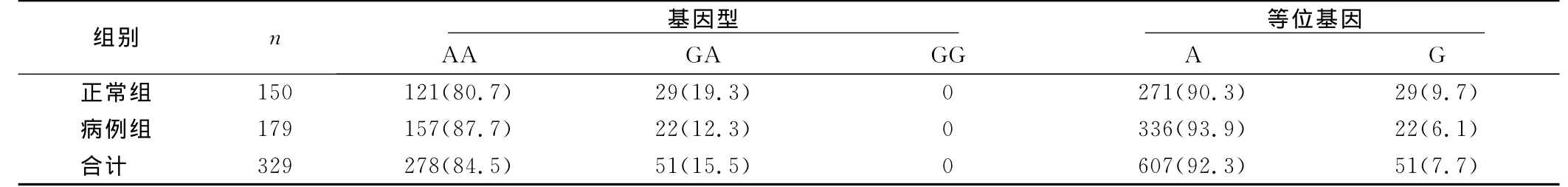
表3 VKORC1(-1639 G>A)基因型及等位基因频率比较 例(%)
2.3 年龄、性别、体重指数及基因多态性与华法林稳定剂量的关系 由于本研究中华法林日均稳定剂量不符合正态分布,所以对CYP2C9*3(1075A>C)、VKORC1(-1639G>A)和性别采用非参数检验,其Mann-Whitney U统计量分别为121 5,P<0.05;882.5,P<0.05;3 401.5,P>0.05。因此可以认为CYP2C9*3(1075A>C)和 VKORC1(-1639G>A)基因多态性与华法林稳定剂量差异有统计学意义,不同性别间华法林稳定剂量差异无统计学意义。将年龄和体重指数与华法林稳定剂量做相关性分析显示,年龄与华法林稳定剂量呈负相关(r=-0.186,P<0.05),体重指数与华法林稳定剂量无明显相关(r=-0.007,P>0.05)。
因为CYP2C9*3(1075A>C)CC型发现例数只有2例,为便于分析将其与AC型合并成一组,分析发现:CYP2C9*3(1075A>C)(AC+CC)型华法林日均稳定剂量(2.35±1.13)mg/d明显低于 AA型(2.92±1.11)mg/d(P<0.05),两组间年龄、性别、体重指数差异无统计学意义(P<0.05)。VKORC1(-1639G>A)AA型华法林稳定剂量(2.72±1.00)mg/d明显低于GA型(3.84±1.46)mg/d(P<0.05),两组间年龄、性别、体重指数差异无统计学意义(P<0.05)。不同基因型间华法林稳定剂量比较详见表4。
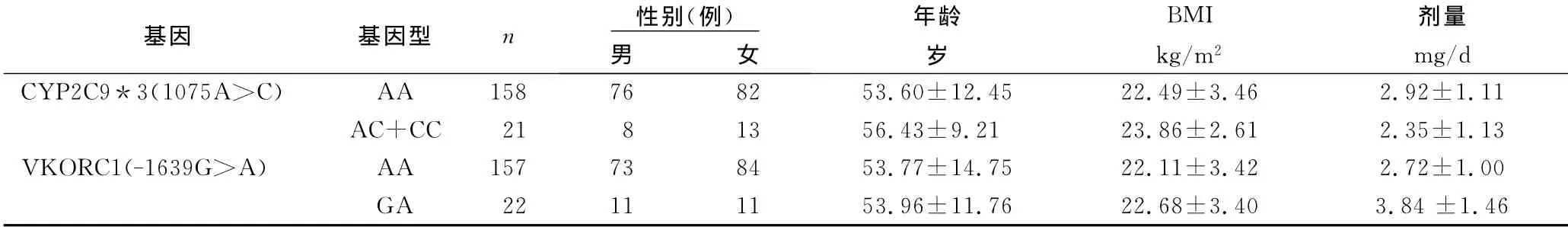
表4 不同基因型患者华法林日均稳定剂量比较
3 讨 论
华法林作为一线口服抗凝药,目前在临床上仍被广泛使用,研究表明,不同患者使用华法林的剂量可以相差20倍[2],造成华法林维持剂量差异的原因包括遗传因素和非遗传因素,近年来研究表明,VKORC1和CYP2C9基因多态性是影响华法林剂量个体差异的主要遗传因素,这两个基因可解释40%左右华法林的个体剂量差异[3]。故本研究结合非遗传因素(年龄、性别、BMI)探讨了山西地区汉族人群CYP2C9*3(1075A>C)和VKORC1(-1639G>A)基因多态性分布特点及对华法林稳定剂量的影响。
INR的目标值将直接决定着患者所需华法林的剂量,因我国采用INR监测抗凝效果比较晚,目前在华法林的抗凝强度、抗凝监测方面还不完善[4],本研究在综合相关文献的基础上将纳入患者的目标INR值定为1.7~3.0,且所有入选患者在服用华法林的过程中均未发生栓塞或出血等不良事件[5]。
本研究采用ARMS-PCR法对150名健康人群和179例服用华法林患者基因型检测发现,正常人和患者之间CYP2C9*3(1075A>C)和VKORC1(-1639G>A)的SNP分布无差异,与李胜军等[6]在江苏地区的研究结果一致。本研究结果显示,CYP2C9*3(1075A>C)基因及等位基因频率分布,与国内外报道基本一致,可以认为CYP2C9*3(1075A>C)基因及等位基因分布无明显的人种差异[7]。VKORC1(-1639G>A)基因及等位基因频率分布与国内马心超等[8]报道结果基本一致,而与国外 Geiser等[9]报道的结果相反,可见在不同种族间VKORC1(-1639 G>A)基因型分布存在人种差异,亚洲人群中AA型居多,而在白种人中GG型居多。
另外,本研究中入选的179例患者所服用的华法林稳定剂量从0.75 mg/d到7.4 mg/d不等,个体间剂量差异可达十余倍,进一步提示华法林稳定剂量个体差异较大。CYP2C9*3(1075A>C)(AC+CC)型华法林日均稳定剂量较AA型降低了19.5%,VKORC1(-1639G>A)AA型华法林稳定剂量较GA型降低了26.9%,与国内外文献报道基本一致[10],进一步提示CYP2C9*3(1075A>C)和 VKORC1(-1639G>A)的基因变异会导致个体间华法林稳定剂量的差异,而且进一步证明了VKORC1基因的变异造成个体间华法林稳定剂量差异的作用更大[11]。
在影响华法林维持剂量的非遗传因素中研究发现年龄与华法林日均稳定剂量呈负相关,与文献报道结果一致[12],其原因可能为随着年龄的增长,个体的肝肾功能及代谢能力降低,合成凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ能力减退,肝细胞色素P450酶含量及活性逐步下降,血浆蛋白结合率及华法林代谢清除率有所降低,从而导致了高龄患者所需华法林剂量的减少。性别和体重指数与华法林日均稳定剂量无明显相关,其原因可能是由于本研究所选样本量较小或所选样本单一有关,所以今后的研究需要加大样本量并拓宽入选人群进行研究。
综上所述,年龄以及CYP2C9*3(1075A>C)和VKORC1(-1639G>A)基因多态性对中国汉族人群华法林稳定剂量具有显著的影响,临床医生在用药之前参考这些变量可以指导患者个体化华法林的使用,对临床提高华法林的安全使用具有潜在的价值。
[1] Wen MS,Lee M,Chen JJ,et al.Prospective study of warfarin dosage requirements based on CYP2C9 and VKORC1 genotypes[J].Clin Pharmacol Ther,2008,84(1):83-89.
[2] 娄莹,刘红,韩璐璐,等.CYP2C9和VKORC1基因多态性对肺栓塞患者华法林初始抗凝疗效的影响[J].中国临床药理学杂志,2012,28(4):256-259.
[3] Yin T,Hanada H,Miyashita K,et al.No association between vitamin K epoxide reductase complex subunit 1-like 1(VKORC1L1)and the variability of warfarin dose requirement in a Japanese patient population[J].Thromb Res,2007,122(2):179-184.
[4] Cho HJ,On YK,Bang OK,et al.Development and comparison of a warfarin-dosing algorithms for Korean patients with atrial fibrillation[J].Clin Ther,2011,33(10):1371-1380.
[5] 谭胜蓝,彭娟,周新民,等.验证并比较华法林稳定剂量预测模型对中国心脏瓣膜置换术后患者预测准确性[J].临床药理学,2012,17(9):1026-1033.
[6] 李胜军,盛红专.CYP2C9和VKORC1基因多态性与华法林抗凝剂量的相关性研究[J].天津医药,2010,38(8):670-673.
[7] 霍梅,刘春,杨超,等.华法林抗凝治疗患者CYP2C9基因多态性的研究[J].现代预防医学,2008,35(11):2103-2105.
[8] 马心超,杨剑,黄晨蓉,等.江苏地区汉族人群中维生素K环氧化物还原酶亚单位1、细胞色素P4502C9的基因多态性[J].苏州大学学报(医学版),2009,29(2):279-282.
[9] Geisen C,Watzka M,Sittinger K,et al.VKORC1 haplotypes and their impact on the inter-individual and inter-ethnical variability of oral anticoagulation[J].Thromb Haemost,2005,94(4):773-779.
[10] Obayash IK,Nakamural K,Kawana J,et al.VKORC1 gene variations are the major contributors of variation in warfarin dose in Japanese patients[J].Clin Pharmacol Ther,2006,80(2):169-178.
[11] Schwarz UI,Ritchie MD,Yuki Bradford,et al.Genetic determinants of response to warfarin during initial anticoagulation[J].N Engl J Med,2008,358(10):999-1008.
[12] 都丽萍,梅丹,刘昌伟,等.CYP2C9及VKORC1基因多态性对华法林剂量和抗凝效果的影响[J].中国药学杂志,2010,45:1682-1683.

