埃他卡林对间歇性低氧暴露肺微动脉的选择性扩张作用*
黄景慧,韩文志,张雁芳,段瑞峰,邓浩浩,郭玉红,刘 卫,汪 海,2△
(1.军事医学科学院卫生学环境医学研究所心血管药物研究中心,北京100850;2.北京赛德维康医药研究院,北京100039)
慢性低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是一种持续低氧导致的肺动脉压力持久增高的慢性综合病症,最终可因右心室后负荷增加而导致右心衰竭。尽管HPH发病机制尚不清晰,但血管内皮细胞损伤在HPH发生、发展的过程中起着关键的作用。病理条件下,由于肺微动脉内皮细胞受损,血管舒张因子(nitricoxide,NO)和收缩因子内皮素-1(endothelin-1,ET-1)之间的平衡被打破,造成内皮细胞对血管平滑肌的调节紊乱,血管平滑肌异常增殖,引发管壁增厚,官腔狭窄等肺微动脉重构的病理改变[1]。目前,以改善肺阻力血管内皮损伤为靶点治疗肺动脉高压的药物虽然一定程度上改善了患者的生存质量,但因降压程度有限,对低氧暴露的肺阻力血管选择性差,不能逆转肺微动脉重构,临床应用受限。因此,研究靶向调控低氧暴露的肺微动脉,强效保护血管内皮活性的治疗药物意义重大。
钾离子通道开放剂是一类强效的血管扩张剂,在治疗HPH方面具有较好的研究基础[2]。埃他卡林(iptkalim,Ipt)是我室自行设计、合成的新型 KATP通道开放剂[3]。临床前的大量药理学研究表明埃他卡林降压作用平稳持久;能保护病理状态下心、肾、脑等重要靶器官损伤,逆转心血管重构,调节多种心血管危险因素所致的内皮细胞功能紊乱,具有强效内皮保护作用,其分子机制与其纠正内皮细胞NO和ET-1系统功能的失衡和激活Chemerin/ChemR23系统有关[4]。我室前期在ET-1诱导的大鼠肺动脉高压模型及模拟 HPH的常压低氧动物模型[5]上均发现,Ipt可以有效阻止肺动脉高压持续增高和逆转持续低氧所致的大鼠肺微动脉重构。本实验在此基础上,利用阻力血管张力研究平台[6],进一步探讨Ipt对 HPH及醋氮酰胺(acetazolamide,Acz)干预 HPH大鼠肺微动脉内皮活性及选择性扩张肺微动脉作用特征,为Ipt发展为新型治疗HPH的药物提供理论基础。
1 材料与方法
1.1 实验动物及分组
二级雄性SD大鼠,体重(200±20)g(军事医学科学院动物中心提供),分笼饲养,自由饮水、进食。随机分为3组:对照组(Control),低氧暴露组(Hypoxia)和低氧暴露+Acz干预组(灌胃给予Acz 80 mg/(kg·d))。
1.2 低氧处理
将间歇性低氧暴露组大鼠置于常压低氧舱内,低氧开始时,先向舱内充入氮气,降低舱内氧气含量,舱内氧含量由氧浓度监测仪(CYES-II;中国上海)监测,使之稳定于(10±0.5)%,低氧舱有小孔与外界相通,使氧舱大气压与外界一致。舱内CO2和水蒸气分别用钠石灰和无水氯化钙吸收。间断低氧(8 h/d,每周 6 d),持续 12周。
1.3 Ipt对间歇性低氧暴露预收缩肺动脉模型张力变化测定
将三组大鼠断颈处死后,迅速取出肺组织置于4℃的含Krebs-Ringer营养液的培养皿中,营养液组分(mmol/L):NaCl 118.3,KCl 4.7,CaCl22.5,KH2PO41.2,NaHCO325.0,MgSO41.2,EDTA 0.026,Glucose 11.1。固定分离肺组织 4~5级管径为(197±4)μm的微动脉,制备约2 mm的肺微动脉血管环,记录微动脉管径。将肺微动脉环悬挂于DMT610m微血管张力测定仪的37℃恒温浴槽内,持续通入95%O2和5%CO2混和气,通过Powerlab记录系统监测肺动脉环张力变化。在6 nmol/L内皮素-1(ET-1)预致血管收缩的条件下,选取张力大于3 mN活性良好的肺微动脉,累积性给予Ipt(军事医学科学院毒物药物研究所合成、提供,纯度>99.5%)。待每一次给药浓度的张力示数稳定后再给予下一浓度,观察不同浓度的药物对血管张力的影响并利用乙酰胆碱(ACh)考察肺动脉内皮活性。以ET-1诱发最大稳定收缩幅度为100%,药物诱发血管舒张的幅度与ET-1诱发最大稳定收缩幅度之间的比率为血管的舒张率。
1.4 统计学处理
实验数据用均数±标准差(¯x±s)表示。运用SPSS10.0统计学软件,组间比较采用单因素方差分析(ANOVA),再进行 q检验。
2 结果
2.1 间歇性低氧肺微动脉内皮活性
以6 nmol/L内皮素(ET-1)预收缩肺微动脉,模型稳定后以10μmol/L ACh检验间歇性低氧暴露肺微动脉内皮活性。结果显示:与对照组(control)舒张率(14.76±3.26)%对比,ACh对肺微动脉舒张率显著降低(P<0.01),仅为(4.63±1.82)%,ACh对80 mg/kg Acz干预组舒张率为(10.32±2.58)%,与低氧暴露组相比显著提高(P<0.05)。提示间歇性低氧暴露导致肺微动脉内皮活性受损,Acz能够改善间歇性低氧暴露状态肺微动脉内皮活性(图1)。
2.2 Ipt对间歇性低氧肺微动脉扩张作用影响特征
以6 nmol/L内皮素-1(ET-1)预收缩肺微动脉,模型稳定后,累积性加入Ipt。结果显示,Ipt对Control组肺动脉舒张作用较弱,最大舒张率为(10.03±1.17)%;Ipt对间歇性低氧暴露组肺动脉呈剂量依赖性舒张反应,最大舒张率为(24.93±4.34)%,与Control组相比有显著性差异(P<0.01);Ipt对 80 mg/kg Acz干预组肺动脉也呈剂量依赖性舒张反应,最大舒张率为(32.61±7.70)%,与 Control组相比有显著性差异(P<0.01);而间歇性低氧暴露组与80 mg/kg Acz干预组间无显著性差异(图2)。提示 Ipt对常压常氧状态的肺微动脉无明显舒张作用,而对低氧状态的大鼠肺微动脉更敏感,扩张作用更强。推测Ipt可能对低氧诱发的肺微动脉高压具有保护作用,80 mg/kg醋氮酰胺干预不影响Ipt对肺微动脉的扩张作用效果。
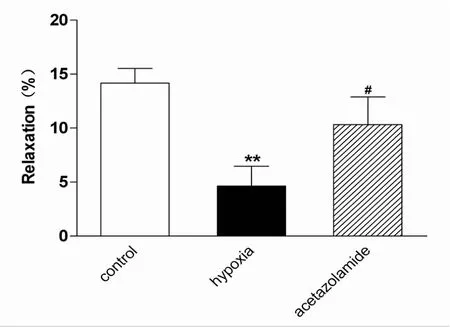
Fig.1 Acetycholine(ACh)causes vasodilatation in endotheliumintact pulmonary arterioles pre-contracted by 6 nmol/L endothelin-1(ET-1)from hypoxia,acetazolamide and control group(¯x±s,n=9)
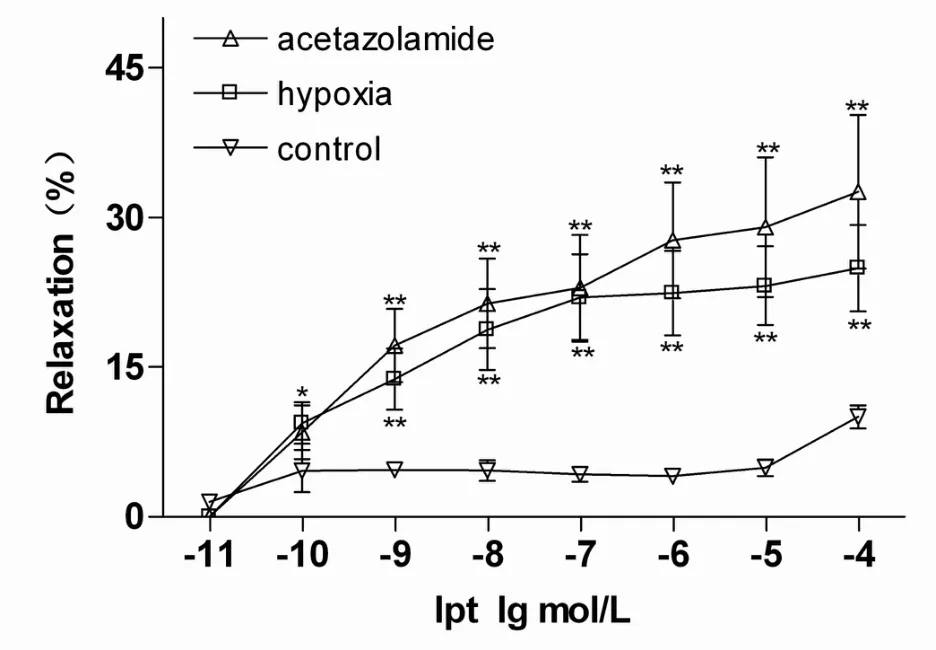
Fig.2 Concentration-response curves for iptakalim(Ipt)-induced dilatations in pulmonary arterioles pre-contracted by 6 nmol/L ET-1 from hypoxia,acetazolamide and control group(¯x±s,n=9)
3 讨论
常压低氧动物模型是研究HPH常用的模型系统,持续低氧导致大鼠肺微动脉内皮细胞受损,丧失产生血管活性物质的能力,血管舒张因子(NO)和收缩因子(ET-1)之间的平衡被打破,血管平滑肌异常增殖,引发血管重构及过度收缩,形成肺动脉高压。Acz是一种典型的磺胺类碳酸酐酶抑制剂,常用于急性高原病的治疗[7]。文献报道慢性给予Acz能够抑制血液中促红细胞生成素,降低红细胞比容,提高内皮细胞NO的生物利用度,促进低氧性肺动脉的舒张[8]。我们应用阻力血管张力研究平台,发现ACh对间歇性低氧暴露肺微动脉舒张作用显著降低,提示血管内皮活性受损是HPH发生发展过程中的重要标志。进一步在模拟HPH的80 mg/kg Acz 12周干预及单纯常压低氧动物模型上证明,Acz可以改善肺微动脉内皮活性。因此,寻找HPH状态下靶向肺微动脉改善内皮活性的药物具有非常重要的意义。Ipt是我国学者自行设计、合成的新型KATP通道开放剂,在有效降压的同时,研究发现能够逆转多种心血管危险因素所致的内皮细胞功能紊乱,具有强效内皮保护作用,其分子机制与其纠正内皮细胞NO和 ET-1系统功能的失衡和激活 Chemerin/ChemR23系统有关[4]。前期实验也表明,Ipt可以阻断ET-1诱导的肺动脉高压,逆转间歇性低氧所致的动物肺动脉高压增高和肺小动脉重构[5],提示Ipt可能成为通过改善内皮细胞功能治疗HPH的新型候选药物。
持续缺氧可减少肺阻力血管钾通道的开放,钾离子通道的关闭是HPH发生、发展的关键环节。目前,KATP通道被认为是研制治疗肺动脉高压药物的重要靶标[9]。KATP通道开放剂作为新一类降压药物,虽然在治疗HPH方面具有一定的疗效,然而以代表药物吡那地尔为例,对肺微动脉缺乏选择性,并且尚无通过改善血管内皮活性逆转间歇性低氧暴露肺微动脉重构的报道。Ipt是我国学者自行设计、合成的新型KATP通道开放剂,对病理状态的阻力血管具有高选择性调控作用[10],我们在间歇性低氧暴露的肺微动脉收缩模型上发现,Ipt对间歇性低氧暴露组及80 mg/kg Acz干预组肺微动脉呈剂量依赖性舒张反应,而对常压常氧肺微动脉无明显扩张作用,提示Ipt对间歇性低氧暴露及Acz干预状态下的内皮活性受损的肺微动脉起效浓度低,舒张作用强,具有明显的病理状态选择性,Acz干预并不影响Ipt对肺微动脉的选择性舒张作用效果。
综合本实验室现有研究结果和国内外的研究资料,Ipt高选择性扩张间歇性低氧暴露状态下内皮活性受损的肺微动脉,逆转低氧性肺动脉高压和肺血管病理性重构的机制可能在于:激活肺部阻力血管细胞膜KATP通道,引起细胞膜超极化,减少平滑肌细胞膜电压依赖性钙通道开放引起的胞内Ca2+增加,松弛血管平滑肌;通过纠正间歇性低氧导致的肺血管内皮细胞功能紊乱,拮抗ET-1等缩血管活性物质,促进血管舒张因子(NO)等物质的释放,间接舒张肺微动脉平滑肌,抑制肺血管重构,具体调控机制值得进一步研究。
间歇性低氧暴露导致肺微动脉内皮细胞功能受损,Ipt具有选择性调控低氧暴露状态下肺微动脉的作用特征;Acz可以显著改善低氧暴露所致的内皮细胞功能异常,但并不影响Ipt对低氧暴露肺微动脉的选择性扩张作用。因此,Ipt具有发展为新型肺动脉高压治疗药物的潜力。
[1] Michel RP,Langleben D,Dupuis J.The endothelin system in pulmonary hypertension[J].Can J Physiol Pharmacol,2003,81(6):542-554.
[2] Cole WC,Clément-Chomienne O.ATP-sensitive K+channels of vascular smooth muscle cells[J].J Cardiovasc Electrophysiol,2003,14(1):94-103.
[3] Wang H,Tang Y,Wang L,et al.ATP-sensitive potassium channel openers and 2,3-dimethyl-2-butylamine derivatives[J].Curr Med Chem,2007,14(2):133-155.
[4] Wang H,Long CL,Duan ZB,et al.A new ATP-sensitive potassium channel opener protects endothelial function in cultured aortic endothelial cells[J].Cardiovasc Res,2007,73(3):497-503.
[5] 解卫平,王 虹,汪 海,等.ATP敏感性钾通道开放剂埃他卡林对大鼠低氧性肺动脉高压的影响[J].中国应用生理学杂志,2003,19(1):4-6.
[6] Ko EA,Song MY,Donthamsetty R,et al.Tension measurement in isolated rat and mouse pulmonary artery[J].Drug Discov Today Dis Models,2010,7(3-4):123-130.
[7] Richalet JP,Rivera-Ch M,Maignan M,et al.Acetazolamide and Monge’s disease:efficiency and tolerance of 6-month treatment.[J].Am J Respir Crit Care Med,2008,177(12):1370-1376.
[8] Deem S,Swenson ER,Alberts MK,et al.Red blood cell augmentation of hypoxic pulmonary vasoconstriction:hematocrit dependence and the importance of nitric oxide[J].Am J Respir Crit Care Med,1998,157(4 Pt 1):1181-1186.
[9] Moudgil R,Michelakis ED,Archer SL.The role of k+channels in determining pulmonary vascular tone,oxygen sensing,cell proliferation,and apoptosis:implications in hypoxic pulmonary vasoconstriction and pulmonary arterial hypertension[J].Microcirculation,2006,13(8):615-632.
[10] Pan Z,Huang J,Cui W,et al.Targeting hypertension with a new adenosine triphosphate-sensitive potassium channel opener iptakalim[J].J Cardiovasc Pharmacol,2010,56(3):215-228.

