304L不锈钢钝化膜的半导体性能研究
张茂胜 ,王润生 ,王庭暄 ,赵森龙 ,王春光
(1. 新疆油田公司实验检测研究院,克拉玛依 834000; 2.石河子市天源燃气有限公司,石河子 832000;3.新疆亚中机电销售租赁股份有限公司,乌鲁木齐 830011; 4.克拉玛依普特龙科技有限公司,克拉玛依 834000)
前言
不锈钢材料在使用过程中,表面会生成一层致密的钝化膜而使其具有良好的耐腐蚀能力,常用不锈钢材料的耐蚀性能主要取决于钝化膜的性能。但这种钝化膜由于膜层很薄而在一些特定的环境中易产生点蚀、缝隙腐蚀而受到破坏,因此研究不锈钢的耐蚀机理以及点蚀发生的机制对于提高不锈钢材料的使用范围和价值具有十分重要的理论与工程意义。众所周知,金属的腐蚀是一个电化学过程,主要发生在金属与环境介质的界面上,通过电子与离子在膜中的传递和交换,使金属表面不断溶解,导致腐蚀的发生。对不锈钢而言,这种电子与离子迁移与交换需要透过金属表面的钝化膜层,材料耐腐蚀能力与钝化膜层的结构和电性能密切相关。这种钝化膜层呈半导体性质,其禁带宽度约为1~4eV[1],已有大量的研究对金属或合金钝化膜的电性能与进行了报道[2~3],但在钝化膜的电性能对材料的耐腐蚀性能影响方面机理模糊,在二者的相关性方面仍存在很大的争议,且多数研究都局限于中碱性溶液中所形成的钝化膜,对在酸性溶液中所形成的钝化膜研究则很少涉及。
本文应用电容测量法借助于Mott-Schottky曲线分析研究了304L不锈钢材料在硫酸介质中形成的钝化膜的半导体性能,同时对不同成膜条件对膜的半导体性能的影响进行了讨论。
1 试验
实验材料选用市售304L奥氏体不锈钢,其化学成分(质量百分数)为:C 0.045,Mn 0.035, Si 0.035,S 0.03, P 0.029, Cr 17.8, 9.5Ni,Fe余量。试样加工成10mm×10mm×3mm并用环氧树脂进行密封,工作面积为1cm2,采用水砂纸打磨工作面至2000#,丙酮除油,蒸馏水清洗,热风吹干后置于干燥皿中待用。
电化学实验为常用的三电极体系,采用铂金电极作辅助电极,选用饱和甘汞电极 (SCE)作为参比电极选用。电化学实验仪器为M273A恒电位仪和M5210锁相放大器。实验流程为:试样表面去氧化膜(工作电极预极化10分钟,极化电压-1.2V)→钝化膜制备(钝化区间内不同电位下对工作电极极化1小时)。动电位扫描速度为2mV/s,描范围为-0.4V~1.2V,Mott-Schottky曲线测试频率为1000Hz,实验用硫酸溶液的浓度分别为:0.5M、1M、2M、3M、4.5M。实验温度为20±2℃。
2 理论基础
众所周知,金属或合金表面的氧化物膜往往都具有半导体性质,通过分析这些氧化膜在腐蚀环境中的半导体特性,即可了解有关膜的腐蚀方面的信息。这些氧化膜有些呈p型半导体特征,有些呈n型半导体特征,无论是p型还是n型,都可以采用Mott-Schottky理论进行描述[4]。一般而言,钝化膜在腐蚀溶液中的空间电荷电容(C)分布正好与溶液电荷相反,其与电位(E)的关系可以由Mott-Schottky方程来描述:对于n型半导体膜,空间电荷电容(C)与电位(E)的关系如下:
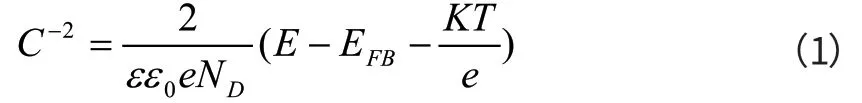
对于p型半导体膜:
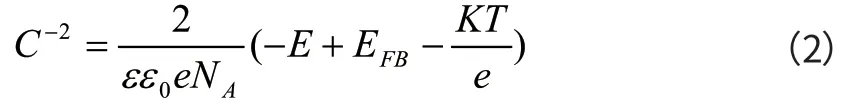
式中各物理量的含义如下:
ε为室温下钝化膜的介电常数(15.6[5]),ε0为真空电容率(8.85X10-12F·m-1);EFB为平带电位(V),ND/ NA分别为n型和p半导体施主浓度和受主浓度,T为绝对温度,K为玻尔兹曼常数。当采用Mott-Schottky方程进行计算时,如果忽略Hemholtz电容、表面电容等串联电容,则测试电容的C-2与电位E的关系就能较好地符合Mott-Schottky方程,进而由Mott-Schottky曲线中C-2与电位E直线的斜率求得施主密度ND,由直线的截距求得平带电位EFB。
3 结果与讨论
3.1 极化曲线
选用2M浓度的硫酸溶液测试了304L不锈钢的阳极极化曲线,如图1所示。由图1可以很清楚地看出,试样从a(-0.27V,vs. SCE)点到b(0.98V,vs. SCE)点之间均处于稳定钝化状态,其稳态钝化电流密度非常小,约为9.5E-6A·cm-2,说明不锈钢在2mol/L硫酸溶液中的耐腐蚀能力很强。这主要是因为不锈钢钝化膜中Cr在酸性介质中主要以Cr2O3,CrOH或Cr(OH)3等形式存在,氢氧基的存在使得铬、铁等以水化物的形式存在于膜中,当表面的钝化膜遭到破坏后,从基体迁移来的金属离子立即与氢氧基结合成水化物,新膜立即生成,这样一来不锈钢的钝化能力再进一步得到增强,耐腐蚀能力进一步提高。
3.2 溶液pH 值对钝化膜半导体性能的影响
研究表明[6],不锈钢产生的钝化膜由双层结构组成,其外层一般为不同价态的Fe的氧化物(Fe2O3、Fe3O4)和水化物(Fe(OH)3),呈n型半导体特性,内层为含不同价态Cr的氧化物(三价的Cr2O3和六价的CrO3),呈p型半导体特性。图2是0.7V下不同pH值溶液中极化1小时测得的钝化膜M-S曲线,我们可以将图2分成三个区:即曲线斜率为负的Ⅰ区,曲线斜率为正的Ⅱ区以及曲线斜率为负的Ⅲ区。Ⅰ区电位为-0.4V~0.16V,在此电位区间,Fe的氧化物空间电荷层处于富集状态,相当于导体,而Cr的氧化物空间电荷层则处于耗尽状态,为非导体,钝化膜就呈现出Cr氧化物的p型半导体特特征,因此电容受内层Cr的氧化物控制[3]。Ⅱ区电位为0.16V~0.74V,曲线斜率为正,在此电位区间内Fe和Cr的氧化物空间电荷层分布正好与I区比相反,此时Cr的氧化物处于富集状态,而Fe得氧化物部分电荷层则处于耗尽状态,随着扫描电位的正移,氧化物膜的剩余电荷与溶液电荷之间的距离随之增加,使得M-S曲线呈上升趋势。
从图2还可以明显看出,Ⅱ区直线段的斜率随pH值的升高而减小,表明施主密度也随pH值的升高而减小,这是由于在Ⅱ区电位区间内,外层的Fe氧化物和水化物随着溶液酸度增加,Fe氧化物和水化物有可能发生溶解而转变为高价氧化物和水化物,这样一来Fe氧化物空间电荷层中的过剩电荷将减少,使得膜的电容随溶液酸度的增加而增大;进入Ⅲ区,直线段的斜率不受pH值的影响,说明在此电位范围内膜的受主密度与溶液pH值无关,这与Montemor[7]等人的研究结果相一致,Montemor等研究了0.5M硫酸溶液中Cr表面的钝化膜,发现钝化区间内在较正的电位下所成膜的组成主要为CrOH,而与成膜时间及溶液pH值无关。
由上图还可以看出,在Ⅰ和Ⅲ区间内直线段在E轴上的截距不受溶液pH值的影响,而在Ⅱ区,pH值对截距(即平带电位EFB)有较大影响。溶液PH值和平带电位EFB之间存在如下关系[8]:
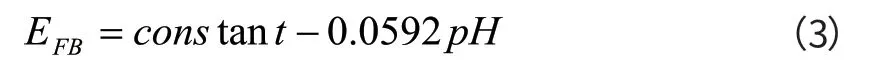
由公式(3)可以看出,膜的平带电位和溶液的pH值呈直线关系,其斜率为0.0592V/pH,图3给出了Ⅱ区直线段的平带电位EFB与溶液pH值之间的关系,由图3可以看出,平带电位和溶液pH值近似呈线性关系,其斜率为58.58mV/pH,这与由公式(3)计算所得的斜率值(59.2mV/pH)很接近。
3.3 成膜电位对钝化膜半导体性能的影响
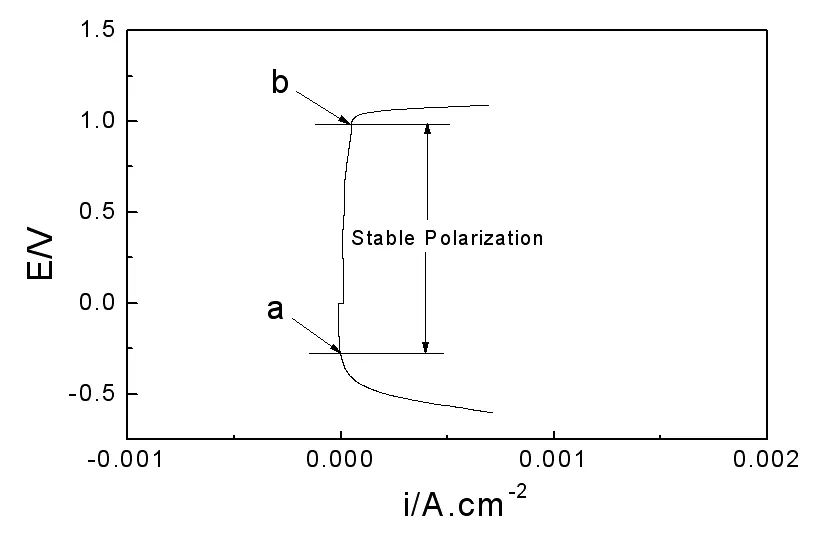
图1 不锈钢在2mol/L 硫酸溶液中的阳极极化曲线
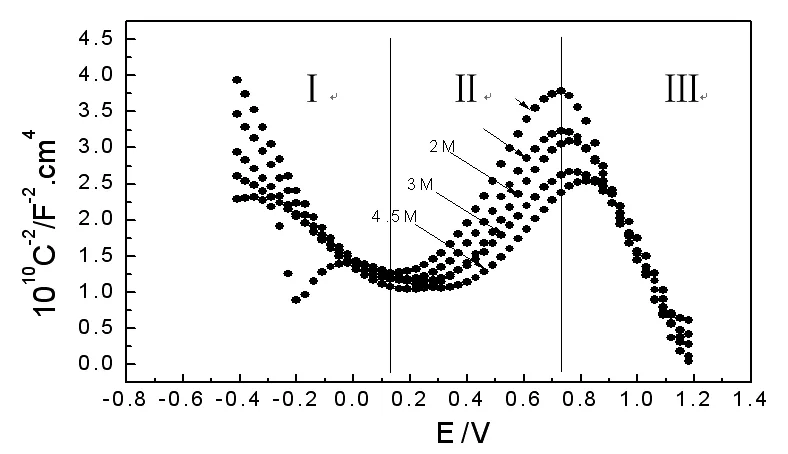
图2 0.7V 下2 小时不同pH 值下所成膜的Mott-Schottky 曲线
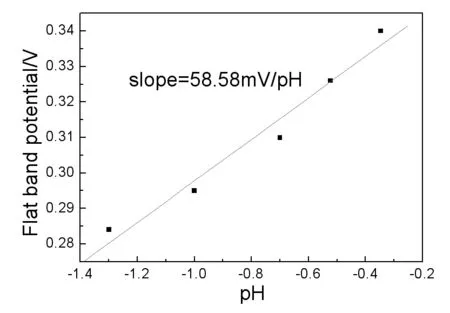
图3 平带电位与溶液pH 值的关系
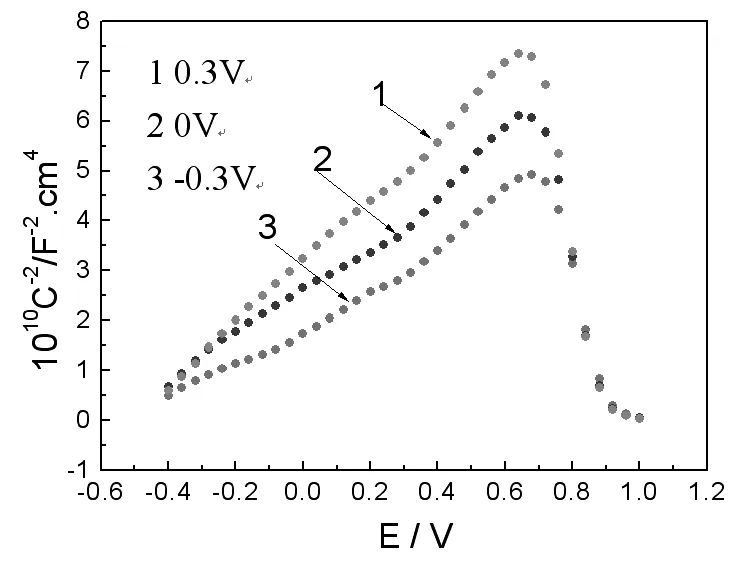
图4 成膜电位对Mott-Schottky 曲线的影响
图4为试样在钝化区间内不同电位下极化2小时、1KHz的测试频率下所得钝化膜的Mott-Schottky曲线,可以明显看出,在测试的电位范围内,随着成膜电位的增加两直线段的斜率增加,膜内的施主密度随成膜电位的增加而减小,膜层表面的空间电容变化较大,表明钝化膜的半导体性能有较大的差异。造成这种差异的根源与组成钝化膜的Fe、Cr氧化物的半导体性质密切相关。电位较低时,膜中二价铁离子含量较高;随着成膜电位的升高,Fe2+被氧化成Fe3+,钝化膜变得更致密,缺陷数量减少,进而使得施主密度降低,在M-S图上就表现为直线的斜率增加。此外,从图4还可以看出,随着成膜电位的升高,M-S图上的直线段斜率更趋一致,表明膜内的两施主密度减小,施主密度更加一致。
3 结论
304L不锈钢钝化膜在-0.4V~0.16V电位区间内呈p型半导体特性,在0.16V~0.74V 电位区间内呈n型半导体特性,在0.74V~1.2V电位范围内呈p型半导体特性;随着成膜电位的升高,膜内两施主密度减小,施主密度趋于一致;膜的平带电位和溶液的pH值之间具有一定的线性关系,拟合直线的斜率大约为58.58mV/pH。
[1]chultze J W, Lohrengel M M. Stability, reactivity and breakdown of passive films. Problems of recent and future research. Electrochim Acta, 2000, 45(15/16):2499.
[2]Carmezim M J, SimÕes A M, Montemor M F, Cunha Belo M Da, Corrosion Sci. 47(2005)581.
[3]Hakiki N E, Cunha Belo M D, Simoes A M P, et al.Semiconducting properties of passive films formed on stainless steels [J]. J.Electrochem. Soc., 1998,145(11):3821.
[4]Rata A D, Chezan A R, Presura C, Hibma T, Applied Surface Science 532-535(2003)341.
[5]Sikora J, Sikora E, Macdonald D D. Electrochimca Acta[J],2000, 45:1875.
[6]D-S Kong, S-H Chen, C Wang, W Yang. A study of the passive films on chromium by capacitance measurement. Corrosion Science, 2003, 45:747.
[7]Montemor M F, Ferreira M G S, Hakiki N E, et al. Chemical composition and electronic structure of the oxide films formed on 316L stainless steel and nickel based alloys in high temperature aqueous environments [J]. Corrosion Science,2000,42:1635.
[8]Morrison S R. Electrochemistry at Semiconductor and Oxidized Metal Electrodes. Trans. Wu H H. Beijing: Science Press,1988.

