猪巴氏杆菌病的诊断和治疗
高君石
(江苏省常熟市海虞动物防疫站,江苏常熟 215500)
猪巴氏杆菌病的诊断和治疗
高君石
(江苏省常熟市海虞动物防疫站,江苏常熟 215500)
猪巴氏杆菌病也称猪肺疫,主要由多杀性巴氏杆菌引起,是一种急性、败血性传染病。病猪常表现为咽喉部急性肿胀或纤维素性胸膜肺炎症状,多因饲养管理不当造成。通过发病情况、临床症状、病料涂片染色、镜检、细菌分离培养、生化实验或动物实验等结果而确诊。本文通过江苏省常熟市某猪场的实际案例,介绍了该病的具体诊断方法及相关治疗手段。
猪巴氏杆菌;细菌培养;药敏试验;治疗
猪巴氏杆菌病主要由多杀性巴氏杆菌 (Pastenrella multocida) 而引起,是一种急性、败血性传染病,也称猪肺疫或猪出血性败血症。该病的主要特征为败血症,咽喉部急性肿胀或表现为纤维素性胸膜肺炎症状。猪巴氏杆菌病主要由B型菌株引起,呈散发性发生,多因饲养管理不当,环境寄生虫和其他细菌诱因等引发复合感染而发病,我国将其列为二类动物疫病。
多杀性巴氏杆菌为细小球杆菌,宽0.25~0.4 μm,长0.5~1.5 μm。单个存在,有时成双排列。革兰氏染色为阴性。本菌最适生长温度为37℃,pH 7.2~7.4。添加血液或血清时,则生长良好。在血液琼脂平板上培养,形成湿润、光滑、边缘整齐的圆形露珠样灰白色小菌落,有荧光,不溶血。在肉汤中培养呈均匀一致的中等度浑浊,有黏性沉淀物,培养久时,表面形成菌膜。在麦康凯和含有胆盐的培养基上不生长。本菌可分解葡萄糖、果糖、蔗糖、甘露醇和半乳糖,产酸不产气。对乳糖、鼠李糖、杨苷、菊糖、肌醇不发酵[1]。
一般情况下,不同畜禽间不容易相互感染多杀性巴氏杆菌。健康猪上呼吸道中常带有此菌,但多半为弱毒或无毒的类型。由于猪群拥挤、圈舍潮湿、卫生条件差、通风不良、寒冷、闷热、阴雨连绵、气候骤变、长期营养不良、处于半饥饿、寄生虫病、长途运输等不良因素,降低了猪体的抵抗力,或发生某种传染病时,病菌乘机侵入机体内繁殖,而增强毒力,引起发病。这种以内源性感染为主的猪肺疫,成散发性发生。在自然条件下很少能传染另外的健康猪。当然,由于细菌通过发病猪体增强毒力后,仍可传染另外的健康猪,因此,不能忽视健康猪在传染来源上的作用。本病大多发生于中、小猪,成年猪患病较少。
江苏省常熟市某猪场一栋育肥舍猪只精神沉郁,厌食,有高热等现象,送检2头病重猪只至兽医工作站实验室检查,经发病情况、临床症状、病料的涂片染色、镜检、细菌的分离培养、生化实验及动物实验,诊断为猪巴氏杆菌病。通过药敏试验发现,病菌对氟苯尼考、恩诺沙星、环丙沙星敏感,对多数药物耐药。选择高敏药物治疗病猪,病情很快得到控制。
1 材料与方法
1.1 材料
1.1.1 病料
将两头送检病猪处死,剖检,无菌采取血液、肺脏、肝脏等作为病原分离材料,根据需要剪取适当大小的组织块,盛于无菌容器内,在4℃条件下暂时存放,备用。
1.1.2 培养基
改良马丁氏琼脂(牛肉汤500 mL,改良猪胃消化液500mL,氯化纳2.5 g,琼脂20 g,pH 7.4~7.6,灭菌30~40分钟)。麦康凯琼脂(蛋白胨17 g,猪胆盐5 g,氯化钠5 g,琼脂17 g,乳糖10 g,蒸馏水100 mL,0.01%结晶紫水溶液10 mL,0.5%中性红水溶液5 mL,pH 7.3~7.4),购于杭州微生物试剂有限公司。马丁氏肉汤(牛肉汤500 mL,猪胃消化液500 mL,氯化钠2.5 g,pH 7.2~7.6)。鲜血琼脂(每100 mL改良马丁氏琼脂加入家兔鲜血10 mL)。
1.1.3 革兰氏染色液
草酸铵结晶紫染液,A液:结晶紫2 g,95%乙醇20 mL;B液:卢戈碘液(碘片1 g,碘化钾2 g,蒸馏水300 mL,先将碘化钾溶解于少量水中,再将碘片溶碎在碘化钾溶液中,待碘全部溶解后,加足水份即成);95%的乙醇溶液;番红复染液(番红2.5 g,乙醇100 mL,取上述配好的番红乙醇液10 mL与80 mL蒸馏水混匀即成)[2]。
1.1.4 生化发酵管
包括葡萄糖、半乳糖、蔗糖、甘露醇等发酵用的小试管,购于北京索莱宝科技有限公司。
1.1.5 药敏纸片
包括阿莫西林、链霉素、卡那霉素、庆大霉素、环丙沙星等纸片,购于哈尔滨华通医疗设备公司。
1.1.6 实验动物
20~25 g健康小白鼠4只。
1.2 方法
1.2.1 细菌的分离
先用烧灼灭菌的手术刀片烧烙组织表面,然后在烧烙处用刚才的手术刀片切开组织,用灭菌的接种环在切开组织内挑取部分组织,分别划线接种于改良马丁氏琼脂平皿、麦康凯琼脂平皿、鲜血琼脂平皿;组织制成悬液接种于马丁氏肉汤小管培养基。采用连续划线法:右手持接种环,通过火焰灭菌,冷却后,在切开的组织内稍用力接触,左手持起培养基平板,先将环上组织涂于琼脂平板一角,然后用接种环自该部位开始,向左向右并逐渐向下移动,连续划成若干条分散的平行线,划线完毕后平皿倒置,36~37℃培养18~24小时。
1.2.2 细菌的纯培养
取出上述接种的鲜血琼脂平皿,选择典型的灰白色菌落做纯培养。用烧灼灭菌的接种环小心挑取单个菌落,移种于鲜血琼脂平板;用接种环先将培养物涂布在平板第一区并作数次划线,再在二、三、四区依次用接种环划线;每划一个区域,应将接种环烧灼一次,待冷却后再划下一个区域,每一区域的划线应接触上一区域的接种线2~3次,使菌量逐渐减少,以形成单个菌落;划线完毕后倒置,37℃恒温需氧培养18~24小时后,于4℃条件下存放。
1.2.3 革兰氏染色镜检
用接种环挑取一环生理盐水于洁净玻片上,再用接种环挑取少量纯培养的细菌于玻片上的生理盐水混合,并均匀涂布于玻片上,自然干燥用火焰固定;在玻片上滴加草酸铵结晶紫染色液,作用1~3分钟,水洗;加卢戈碘液于玻片上媒染,作用1分钟,水洗;再加95%的酒精脱色,作用15~30秒,水洗;加番红复染液复染1分钟,水洗,自然干燥后镜检[2]。
1.2.4 生化实验
进行糖(苷、醇)类发酵实验,实验方法与结果判定方法如下:无菌操作,用接种针取纯培养的待检菌接种于各糖类微量发酵管,倒置37℃温箱内培养18~24小时后观察结果。如细菌能分解此种糖类产酸,则指示剂呈酸性变化,发酵管中颜色发生改变;不分解此种糖类,则无颜色变化;产气可使倒置的小管内出现气泡。
1.2.5 药敏实验
将含有定量抗菌药物的纸片贴在已接种待菌的琼脂平板上,纸片中所含的药物吸取琼脂中的水分,溶解后不断地向纸片周围区域扩散,形成递减的浓度梯度,在纸片周围抑菌浓度范围内细菌生长被抑制,从而产生透明的抑菌圈。抑菌圈的大小反映检测菌对测定药物的敏感程度[3]。
具体操作与结果判定方法如下:①于纯培养平皿上,挑取单个菌落均匀涂布于鲜血琼脂平板内;②用无菌小镊子夹取各种药敏纸片,平贴于琼脂表面,各距离要相等,每张纸片的间距不小于24 mm,纸片的中心距平板的边缘不小于15 mm,然后倒置于37℃培养24小时;③平板取出后,仔细观察药敏纸片周围有无抑菌圈形成,根据抑菌圈直径的大小可判定菌株的各药敏纸片的敏感性。
1.2.6 动物实验
将病料研磨成糊状,加10倍灭菌生理盐水稀释成悬液,用此悬液皮下注射3只小白鼠,每只0.2 mL,并观察结果。
2 结果
2.1 细菌分离结果
培养18~24小时后,改良马丁氏琼脂平皿生长纯粹的培养物,有圆形、灰白色、湿润的露珠状菌落。马丁肉汤培养物生长开始轻度混浊,4~6小时后液体清亮,管底出现粘稠沉淀,震摇后不分散,表面形成菌环。鲜血琼脂平皿上长出单个菌落,菌落周围不溶血,肉眼观察为光滑圆整、半透明、灰白色。麦康凯琼脂平皿上不生长。
2.2 革兰氏镜检结果
镜检看见两端钝圆浓染的革兰氏阴性球杆状菌,初步确定为巴氏杆菌。
2.3 糖 (苷、醇)类发酵实验结果
3个平行实验的结果见表1。
2.4 药敏结果
药敏结果见表2。
2.5 动物实验结果
接种的3只小白鼠均在24~48小时内死亡,对照小白鼠在2~3天内无
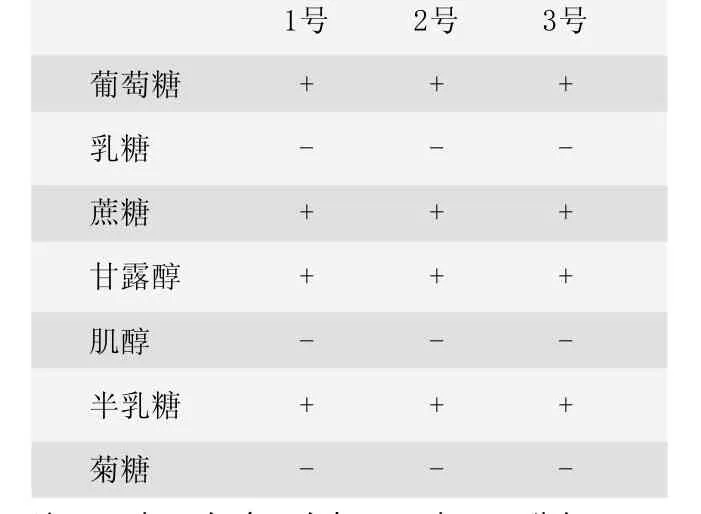
表1 糖 (苷、醇)类发酵实验结果
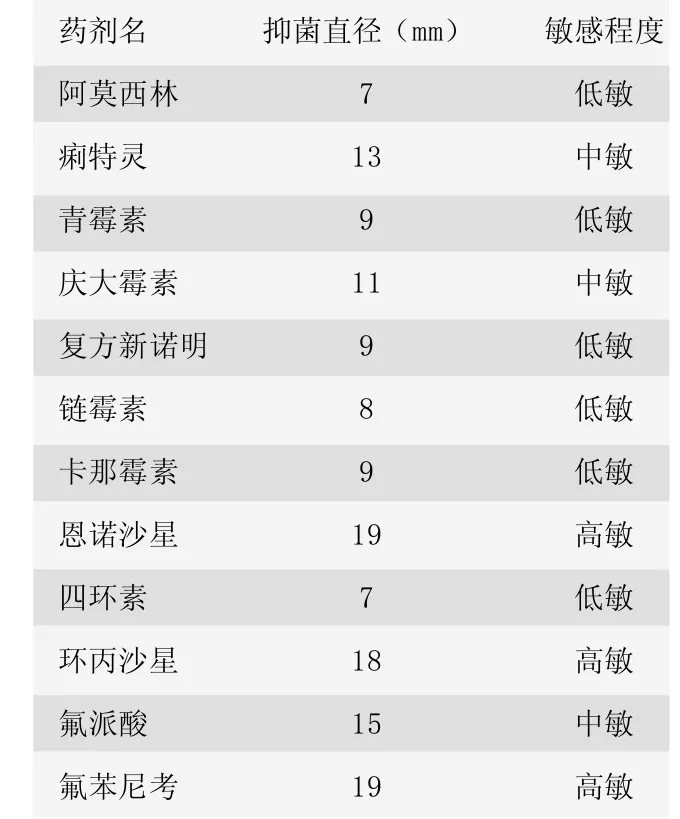
表2 药敏结果
明显变化,剖检取3只死亡小白鼠的肝组织分别做涂片,按上述方法进行革兰氏染色,镜检下发现大量两端钝圆革兰氏阴性的细小球杆菌。
3 诊断
根据流行病学、临床症状、实验室诊断等综合分析,确诊为猪巴氏杆菌病。
4 治疗
隔离发病猪只,进行专人饲养,全场用10%的石灰乳或3%的氢氧化钠进行消毒。
对发病猪采用高敏药物,选用氟苯尼考注射液或恩诺沙星注射液进行治疗。部分病猪肌肉注射氟苯尼考注射液,按每公斤体重10~20 mg,隔48小时一次;另一部分肌肉注射恩诺沙星注射液,按每公斤体重2.5 mg,每日1~2次。对少数高热病猪肌肉注射10%安乃近注射液,每次每头5~10mL。
在未发病猪群的饲料中添加环丙沙星(每50 kg水中添加30 g,每日两次)、氟苯尼考(每1 000 kg饲料中添加200~300 g,每日两次)等药物混饮、混饲。
加强饲养管理,连续用药,对环境差的育肥猪舍进行整顿,注意保温与通风,增强猪体抵抗力。
三周后育肥猪舍病情已基本稳定,没有新的病例发生,大部分猪的精神与进食恢复正常,少数病猪仍有慢性呼吸道感染症状。随后进行全群免疫,皮下注射猪肺疫氢氧化铝菌苗(5 mL/头)。直至所有育肥猪成熟上市,该场未发生相同病例。
5 分析
由于巴氏杆菌为条件性致病菌,所以猪群拥挤、卫生条件差、通风不良、寒冷、气温骤变等因素都可导致猪群机体抵抗力下降,病原菌侵入机体几率加大。此次发病可能是一栋育肥猪舍环境简陋,导致猪群抵抗力下降而传染给另外的猪群。
对于此病猪场应及早发现,及早治疗,以免引起继发感染,引发其他呼吸道疾病,造成较大的经济损失[4]。
治疗猪肺疫的药物常常花费很高,且效果不佳。因而预防本病尤为重要,应从加强饲养管理,改善饲养环境和减少细菌传播等方面入手。主要有以下几点:做好早期断奶和隔离;做好圈舍消毒和清洁卫生工作,可选用烧碱、生石灰、百毒杀等消毒药物,消除降低猪抵抗力的因素,防止疾病发生;加强场内人员管理,各个舍的饲养员不准互串岗位,兽医人员分岗位管理;尽量减少混群和分群及猪群的密度;病死后猪的尸体消毒后妥善处理;猪场不应从外地盲目引进生猪,对引进的生猪应进行7~15天的隔离观察,待稳定后要及时进行猪肺疫单苗的免疫。
每年春秋两季定期用猪肺疫疫苗进行免疫接种。方法有三:一是用猪肺疫氢氧化铝疫苗5 mL/头进行皮下注射,14天后产生免疫力,免疫期为6个月,半月内禁用抗生素;二是口服猪肺疫弱毒冻干菌苗,7天后产生免疫力,免疫期为6个月,1周内禁用抗生素;三是注射猪肺疫免疫血清,使用预防注射量,即仔猪20mL/头,中猪30 mL/头,大猪40 mL/头[4]。
本次试验中药敏试验结果表明,巴氏杆菌对阿莫西林、青霉素、复方新诺名、链霉素、卡那霉素、四环素低度敏感,对恩诺沙星、环丙沙星、氟苯尼考高度敏感。通过药物试验筛选经济、疗效好、高敏的药物进行治疗,既可以取得良好的治疗效果,又可为该病的治疗提供参考依据。
[1]赵占民.动物传染病学.北京:中国农业科技出版社,1996:193-196
[2]孙彬,徐益斌,徐连均.雏鸡沙门氏菌的分离、鉴定以及药敏试验.北京农业,2008, 30:32-34.
[3]李沂轩.阴道加德纳菌与细菌性阴道病相关性研究:[硕士论文].天津:天津医科大学,2006.
[4]陶春中,霍文明.猪肺疫的诊断与治疗.动物科学与动物医学,2005,22(1): 52-53.
S858.28
B
1673-4645(2013)06-0046-03
2013-01-23

