云南烟草中烟草花叶病毒株系比较与分析
秦西云,卢训,方琦,尹跃艳,丁铭, 张仲凯
1云南省农业科学院生物技术与种质资源研究所,云南省农业生物技术重点实验室,农业部西南农业基因资源与种质创制重点实验室,昆明市学云路9号 650223;
2云南省烟草农业科学研究院,昆明市圆通街33号 650031
烟草花叶病毒(Tobacco mosaic virus,TMV)是烟草花叶病毒属的代表种,该病毒具有较广的寄主范围,可侵染包括30个科的310多种植物[1]。TMV基因组全长6395nt,为单链正义RNA,基因组共编码4个ORF[2],其中外壳蛋白基因(coat- protein,CP)是病毒分类相关基因[3]。在不同的寄主上TMV有许多株系,在我国主要有TMV-U1、TMV-U2、番茄株系、车前草株系、豆类株系、葫芦科株系和兰花株系;烟草上的株系主要有TMV-OM、TMV-U1、TMVVulgare、TMVRS、TMVC、TMVN、TMVY[4]。
云南烟草常年种植面积保持在35万公顷(云南省烟草专卖局;http://www.yn-tobacco.com/templates/ycgsww/gongsijieshao/gongsijieshao.htm)左右,是云南的主要农业支柱产业之一。近年来,随着烟草漂浮育苗技术的普遍应用,由TMV引起的花叶病在烟草上发生严重,对烟叶品质及产量均造成较大影响。本研究通过采集云南烟草种植区的TMV病样,对云南不同地区的TMV外壳蛋白基因进行了比较,为TMV的防控及快速检测方法的研究提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试样品
供试样品分别于2010至2011年度采集自云南不同烟草种植区(表1),样品症状表现为花叶、叶片邹缩、植株矮化等症状。
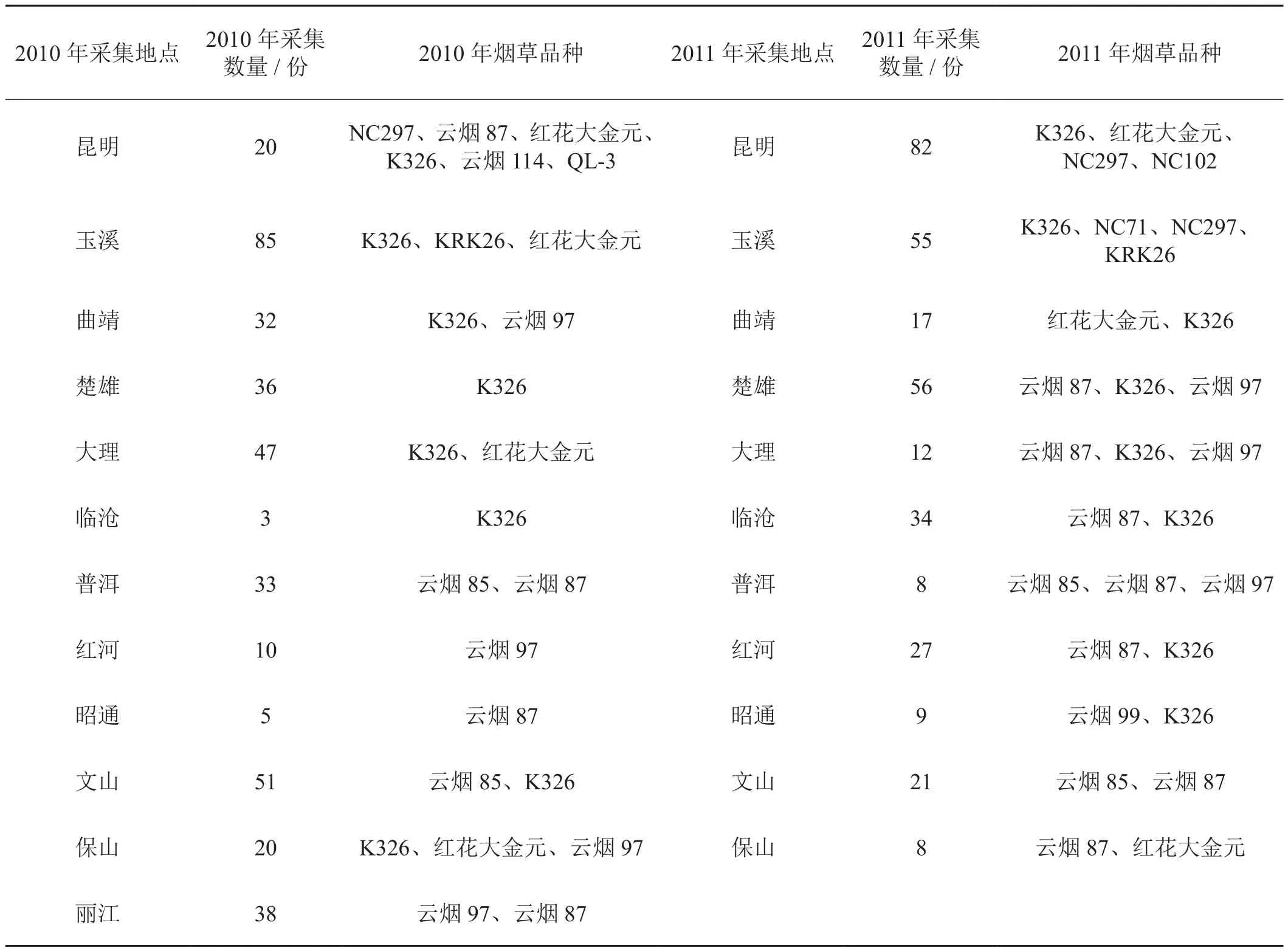
表1 样品采集信息表
1.1.2 抗体
TMV单克隆抗体由周雪平教授惠赠,TMV多克隆抗体为本实验室制备,羊抗鼠酶标抗购自美国Sigma公司。
1.1.3 引物及其他试剂
根据已报道的序列(福建分离物,登录号:AF395127;山西分离物,登录号:JF920727),设计并合成扩增TMVcp基因全序列引物,引物序列为:TMV-CPR:AAGCTTTCAAGTTGCAGGACCAGA(划 线 处 为HindⅢ 酶 切 位 点) ,TMV-CPF:GGATCCATGTCTTACARTATCAC (划线处为BamHI酶切位点)。反转录试剂盒和pGEM-T Easy载体购自Promega公司,DNA聚合酶购自TaKaRa,其余试剂为国产分析纯。
1.2 方法
1.2.1 TAS-ELISA
在酶标板中加入经包被缓冲液(Na2CO31.59 g、NaHCO32.93 g溶于1 L蒸馏水,调pH至9.6)稀释的TMV多抗血清100 μL/孔,37 ℃培育2.5 h-3 h或4 ℃过夜;用加0.5%吐温20的磷酸缓冲液(PBST,Nacl 8.0g、KH2PO40.2g、Na2HPO4· 2H2O 2.9g、Kcl 0.2g溶于1 L蒸馏水,调pH至7.4)洗涤三次。再加入经PBST稀释的样品材料粗汁液100 μL/孔,每个样品设置3个重复,同时设置阳性、阴性和空白对照。同样37 ℃培育2.5 h-3 h或4 ℃过夜;PBST洗涤3次。每孔加封闭液(2%牛血清白蛋白)200 μL。37℃培育0.5 h或4 ℃过夜。之后加入100 μL/孔的经PBST稀释的TMV单克隆抗体,37 ℃培育2.5 h-3 h或4 ℃过夜。PBST洗板三次,加入100 μL/孔的经PBST稀释的羊抗鼠酶标抗体,37 ℃培育2.5 h-3 h或4℃过夜。PBST洗板三次后加入显色底物室温显色。405 nm 读取OD值,样品OD值的平均值与阴性对照OD值的平均值的比值≥2.0定义为阳性,否则为阴性。
1.2.2 IC-RT-PCR
TAS-ELISA检测为阳性的样品,经三次单枯斑摩擦接种心叶烟(Nicotiana Glutinosa)获取纯化单斑分离物。取纯化后单枯斑加入50 μL无TMV污染的双蒸水,充分研磨后,5000 rpm 离心5 min,取上清进行免疫捕捉反转录聚合酶链式反应(ICRT-PCR),方法参考尚海丽[5]等。即TMV多抗血清经包被缓冲液稀释1000倍后取50 μL包被PCR管,4℃孵育过夜。弃去包被液,PBST洗涤3次后加入50 μL单枯斑研磨上清液,每个样品设置3个重复,同时以感病样品和健康样品做为阳性和阴性对照,37 ℃培育2 h,PBST洗涤3次后用20 μL双蒸水洗涤1次,取最后一次洗涤加入12.5 μL双蒸水和1 μL TMV-CPR,70 ℃,10 min后冰浴5 min,再加入4 μL M-MLV RT 5×反应缓冲液、1 μL 10mM dNTP、1 μL M-MLV反转录酶和0.5 μL RNA酶抑制剂混匀,42 ℃反应90 min。再取5 μL反转录产物进行PCR反应:94 ℃ 2 min,94 ℃1 min,45 ℃ 30 s,72 ℃ 1 min,30 个循环后;72℃ 10 min,4 ℃结束反应,扩增产物克隆后,每个分离物挑取5个阳性克隆进行双向测序。
2 结果与分析
2.1 TAS-ELISA结果
2010至2011年度共采集花叶样品710份,其中2010年采集380份,检出TMV阳性样品349份,阳性检出率为92%;2011年采集样品330份,检出TMV阳性样品197份,阳性检出率为50.6%。
2.2 IC-RT-PCR扩增TMV cp基因全序列
采用TMVcp基因特异性引物对采自云南不同烟区的38个TMV病样进行IC-RT-PCR扩增,得到约500 bp的片段,经克隆、测序表明,每个分离物的3个阳性克隆序列一致,片段大小480 bp,含有完整的TMVcp基因序列。采用DNAMAN 7.0对获得序列进行拼接比对,云南38个TMV分离物核苷酸相似性在95%~100%之间,氨基酸同源性在97.5%~100%之间。
2.3 云南TMV烟草分离物序列比较
采用MEGA4.0最大简约法(maximum parsimony,MP)构建了云南38个TMV分离物cp基因的系统进化树(图1),发现38个分离物在系统进化树中分为明显的4个分支;其中沧源分离物(yunnancangyuan)和镇雄分离物(yunnan-zhenxiong)各为一支。其余36个分离物分别聚为两个分支,各分支中都有部分分离物完全一致,也有部分分离物之间存在一定差异。
采用DNAMAN Version 7.0对获得的38个TMV分离物外壳蛋白氨基酸进行比较(表2)发现,在38个分离物的氨基酸序列中,有10个氨基酸位点的差异;据此差异可将38个分离物分成12组不同的氨基酸序列(表3)。对这12组序列进行比较显示,差异最大的分离物为昆明宜良分离物(Yunnan-kunming-yiliang)和耿马分离物(Yunnangengma),它们都有3个氨基酸位点与其它分离物不同;其次是昌宁分离物(Yunnan-changning)有两个氨基酸的变异,其余分离物只有一个氨基酸的变异;从氨基酸变异位点比较,变异最多的位点为外壳蛋白氨基酸序列的第13位,有6个分离物在该位为酪氨酸,其余分离物均为苯丙氨酸,其次是第4位,有4个分离物的该位氨基酸为天冬酰胺,其余分离物为丝氨酸。

图1 云南不同地区的38个TMV分离物cp基因系统进化树

表2 云南TMV分离物外壳蛋白基因氨基酸序列差异

表3 38个分离物分成 12组不同的氨基酸序列
蛋白质抗原的决定簇可以由相邻顺序排列的氨基酸残基构成,亦可由空间相互靠近的若干氨基酸残基构成[6];但不管是哪种,只有分布于蛋白质的表面才不需要通过变性来改变蛋白质的构象而使其暴露出来,这一点对植物病毒的外壳蛋白至关重要。驱使蛋白质折叠的主要动力来自为使暴露于溶剂中的疏水基团降低至最少程度的需要,但同时需要保持处于伸展状态的多肽链和周围水分子之间形成的氢键相互作用的有利能量状态,为满足这一条件,多肽链将发生折叠使多数疏水基团避开与溶剂水接触[7],即在空间结构上使亲水基团分布于外表面。基于以上两点,采用ProtScale程序对以上12组氨基酸序列分别绘制蛋白质的亲疏水性序列普发现,在氨基酸第100位点以前所有序列普都一样,在氨基酸第100位点以后可分成两类,即耿马分离物、镇康分离物、富民分离物、晋宁分离物、元江分离物为一类(图2A),腾冲分离物、昌宁分离物、嵩明分离物、昆明宜良分离物、砚山分离物、临翔分离物和安宁分离物为另一类(图2B)。

图2 蛋白子亲疏水性序列谱
再利用Swiss-Model Workspace的Alignment Mode分别对昆明宜良分离物和镇康分离物进行蛋白质结构的同源性建模(图3),发现两个分离物建模的基本模型均为3kmlK(3.01A),且与模型的同一性分别为97.802%和98.901%。
2. 4 云南TMV烟草分离物与不同寄主TMV分离物cp基因的比较
将云南获得的38个TMV分离物与已报道的TMV分离物进行比较发现,38个分离物与TMV-U1株系同源性最高,在97.1%-99.6%之间,而与TMV中国株系同源性仅为74%。系统进化树结果也显示38个TMV云南烟草分离物与TMV-U1株系、TMV福建分离物(TMV-Fujian-017、TMV-Fujian-152、TMV-Fujian)聚为一支(图4)。

图3 TMV外壳蛋白质的同源性建模比较图
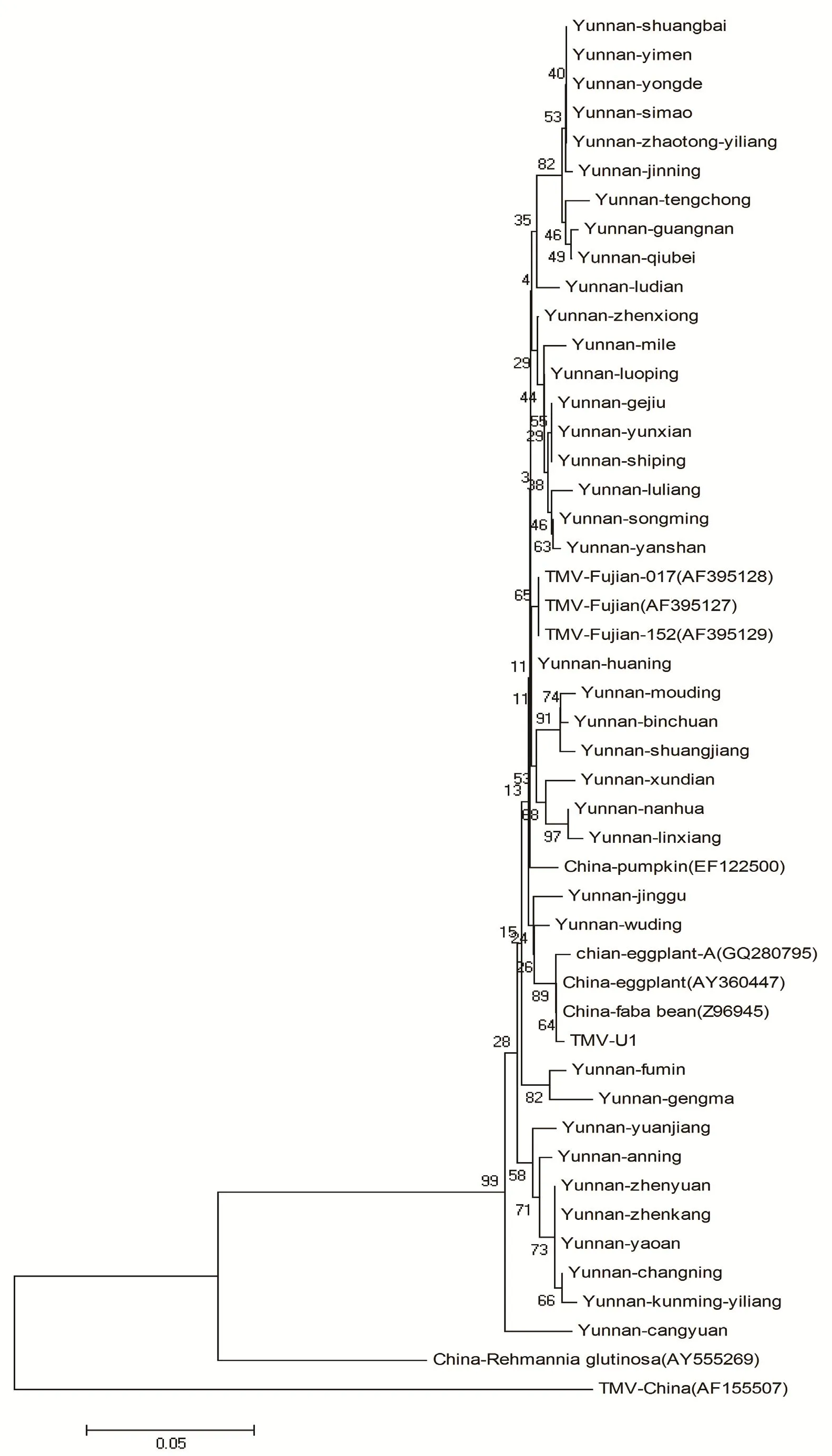
图4 根据中国不同TMV分离物构建的系统进化树
3 讨论
目前,TMV株系划分的方法有三种,一是传统的生物学方法,它根据病毒在寄主植物上的症状和病毒的寄主范围来划分株系[4]。二是血清学方法,张成良等[8]就报道过单克隆抗体划分TMV株系的方法。三是核酸序列相似性分析法,雷彩燕[4]又指出核苷酸同源性虽然是进行株系划分的有效依据,但对于TMV株系间核苷酸序列或氨基酸序列同源性低于多少为不同的株系没有统一标准。丁铭等[9]报道了云南五个分离物与TMV-U1株CP核苷酸和氨基酸序列同源性分别达94.5%和97.5%以上,从而将云南五个分离物归属为TMV-U1株。
本研究通过对云南38个TMV烟草分离物的cp基因进行比较发现,38个分离物的核苷酸序列相似性在95%~100%之间,氨基酸同源性在97.5%~100%之间;比较38个TMV分离物与已报道的TMV分离物发现,云南38个分离物与TMV-U1株系同源性最高,达到97.1%-99.6%,系统进化关系也显示云南不同分离物与TMV-U1株系、TMV福建分离物聚为一支。根据丁铭等[9]的划分标准,本研究的38个分离物归属为TMV-U1株系,但云南38个分离物间也存在一定差异。这一研究结果与谢扬军[10]和宋丽云[11]的一致,宋丽云的研究结果显示TMV的种群遗传结构相对比较稳定,基因组序列变异较少,而谢扬军解释各分离物之间的差异,是由于TMV主要以点突变的方式来适应不同的生态环境带来的选择压力而造成的。
以38个分离物在氨基酸序列上的差异将其分成12组;再分别绘制12组蛋白质亲疏水性序列普,发现12组序列普分成两类;又分类进行蛋白质结构的同源性建模,结果显示,两类蛋白质建模的基本模型均为3kmlK(3.01A),且与模型的同一性分别为97.802%和98.901%,因此可判断两类蛋白质为同一空间结构的蛋白。据此可推断,云南各地烟草上TMV的外壳蛋白在空间结构上一致,其免疫原特性没有差异,可通过制备一个分离物的特异性抗体用于不同区域病毒的检测。
[1]张仲凯, 李毅. 云南植物病毒[M].北京:科学出版社,2001:34-34.
[2]洪健, 李德葆, 周雪平. 植物病毒分类图谱[M]. 北京:科学出版社. 2001:189-193.
[3]M H V van Regenmortel, C M Fauquet, D H L Bishop.Virus Taxonomy seventh Roport of the International Committee on Taxonomy of Viruses[M]. California USA: A Harcourt Science and Technology company, 2000: 892-892.
[4]雷彩燕, 王振跃, 张振臣. 烟草花叶病毒株系研究进展[J].河南农业科学,2005(12):14-16.
[5]尚海丽, 周雪平, 吴建祥. 免疫斑点法和免疫捕获RTPCR检测黄瓜绿斑驳花叶病毒[J]. 浙江大学学报(农业与生命科学版), 2010, 36(5): 485-490.
[6]董志伟, 王琰. 抗体工程[M]. 北京: 北京医科大学出版社, 2002:15-17.
[7]沈同, 王镜岩. 生物化学(上)[M]. 北京:高等教育出版社, 2000:145-145.
[8]张成良, 张作芳, 阙晓枫,等. 应用单克隆抗体对烟草花叶病毒抗原决定簇及其抗原型的分析研究[J]. 病毒学杂志, 1986, 1(2): 32-37.
[9]丁铭, 方琦, 张丽珍,等. 云南五个不同地区烟草花叶病毒外壳蛋白基因的序列比较[J]. 中国病毒学, 2004, 19(1): 76-78.
[10]谢扬军. 烟草普通花叶病毒株系分化研究[M]. 中国农业科学院硕士学位论文,2009.
[11]宋丽云. 我国烟草TMV和CMV种群结构遗传分析[M].中国农业科学院硕士学位论文,2012.

