生物有机肥对烟株和土壤酶活性以及烟草超微结构的影响
刘艳霞,李想,蔡刘体,兰黔贵,石俊雄
贵州烟草科学研究院,土肥植保研究中心,贵州贵阳云潭北路,550000
近年来,随着科技进步和人们环保意识的加强,对烟草青枯病进行生物防控越来越引起科研工作者的高度重视[1-2]。生物防控主要通过接种拮抗菌、施用有机肥或使用含有拮抗菌的生物有机肥等措施调节土壤微生态环境、改善土壤生物活性、抑制病原菌的生长或提高植物自身抗性,从而抑制土传病害的发生[3-5]。植物抗性酶活性的高低是作物系统抗性强弱的重要指标,它的诱导产生是植物重要的生理生化抗性机制之一[6-7]。Jetiyanon[8]研究表明作物体内超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的增加是由于根际复合菌剂的诱导作用所致,而在Zhao等[9]的研究中,施用生物有机肥后,甜瓜叶片的POD和SOD的活性都比对照降低。生物有机肥能够直接为土壤微生物提供有机能源,通过改善作物营养和根际土壤环境促进微生物的繁衍并延缓土壤微生物的衰减速率,使其长时间保持旺盛的生命活力,并能够激活脲酶、蔗糖酶、磷酸酶、过氧化氢酶等土壤有益酶的生物活性,进而防控病害的发生[10]。另外,植株在逆境中的形态结构和生理都会发生变化[11]。当烤烟受到烟草花叶病毒侵染后,由于烟株不能及时清除活性氧,引起质膜伤害,最终导致超微结构破坏[12]。但对于烟草超微结构变化的研究多集中在水分协迫[13]或调制过程中[14],对于青枯病和生物有机肥引起的维管束变化报道甚少。本试验以烟草青枯病拮抗菌发酵的生物有机肥BOF为生防材料,检验其在烟草连作土壤上对烟草青枯病的防治效果, 并从其对烟株抗性产生和阻止青枯病在维管束中的毒害两方面阐述拮抗微生物有机肥料的防控机理,进而为防控烟草青枯病的研究提供理论基础。
1 材料与方法
1.1 供试材料
烟草种子采用易感青枯病品种MS云烟87。
拮抗菌采用本实验室筛选的L-25(短短芽孢杆菌,Brevibacillus brevis,中国微生物菌种保藏管理委员会普通微生物中心保藏(CGMCC No.3175))和L-9(娄彻氏链霉菌,Streptomyces rochei),两株拮抗菌均分离自安徽省健康烟草根际土壤;有机肥载体为菜粕酶解的氨基酸有机肥与牛粪以1:1(质量比)混合,含有机质33.8%、氨基酸4.3%、N 4.20%、P2O52.26%、K2O 1.08%,由江苏省固体有机废弃物资源化高技术研究重点实验室提供。
1.2 抑制烟草青枯病型生物有机肥的制备
将拮抗菌L-25接种于牛肉膏蛋白胨液体培养基,L-9接种于高氏一号液体培养基, 30 ℃、170 rpm振荡48 h。发酵液6000×g离心10 min,收集菌体。按5%接种量将菌体接种于灭菌后的有机肥载体。调节有机肥含水量为40%,发酵5-6天。发酵结束后,通过稀释平板梯度计数[15]和荧光定量PCR测定L-25生物有机肥有效活菌数及拮抗菌数量(表1)。L-9计数采用娄彻氏链霉菌选择性培养基:在高氏一号培养基的基础上加入5 μg·mL-1的苯唑西啉(Oxacillin)、30 μg·mL-1的头孢噻肟(Cefotaxime sodium salt)、50 μg·mL-1的 氨 曲 南(Aztreonam)、200 μg·mL-1的诺氟沙星(Nor fl oxacin)和20 μg·mL-1的哌拉西林(Piperacillin),作为拮抗菌L-9选择性培养基。
每克样品的菌数=同一稀释度几次重复的菌落平均数×10×稀释倍数
荧光定量PCR方法测定肥料中短短芽孢杆菌L-25数量。拮抗菌数量为L-9和L-25数量之和。
土壤或肥料总DNA采用Soil DNA Isolation Kit(Omega) 提取,以样品DNA作为扩增模板,用拮抗菌L-25(Brevibacillus brevis)的特异性引物Bre-F:AGACCGGGATAACATAGGGAAACTTAT, Bre-R:GGCATGCTGATCCGCG ATTACTA GC[16]。在荧光定 量PCR仪(StepOne Plus Real-time PCR System,ABI)上进行扩增反应,反应结束后确认扩增曲线和融解曲线,记录每个样品的Ct值,并将Ct值代入标准曲线方程,计算出样品模板的初始基因拷贝数,最终换算出每克干土的茄科劳尔氏菌或短短芽孢杆菌的基因拷贝数。
L-25与L-9分别二次发酵的生物有机肥以1:1(w:w)混合后制成的生物有机肥称为BOF。

表1 拮抗菌二次发酵前后微生物数量 (cfu·g-1)
1.3 田间试验处理
2009和2010年田间试验均在安徽省宣城市黄渡乡柏枧村中洪组进行,试验田前作烟草青枯病发病率接近60%,试验设置两个处理,每处理四个区组,每区组120株烟株。对照处理ACK只施用烟草专用复合肥 975 kg·hm-2(N:P2O5:K2O=10:15:25),BOF 处 理ABOF在施用817.5 kg·hm-2烟草专用复合肥基础上加施375 kg hm-2的BOF,两处理氮磷钾量相同,磷钾不足部分用过磷酸钙和硫酸钾补齐。试验田土壤理化指标:有机质 24.2 g·kg-1,全氮 1.32 g·kg-1,碱解氮143 g·kg-1,速效磷 10.17 g·kg-1,有效钾 95. 2 g·kg-1,土壤pH 6.8。田间管理按照当地烟田生产实施。
1.4 田间试验病害调查及烟株相关性状测量
1.4.1 田间试验病害调查
分别在烟草移栽后50天和105天按YC/T 40-1996调查青枯病发病率及病情指数。
1.4.2 烟草产量测定
烟草移栽后约60-70天,叶片开始自下而上逐渐成熟,根据烟叶成熟情况由下至上分次采收并放于烤房中烘烤,烘烤后计算其产量。
1.4.3 酶活的测定分析
于移栽后50天和105天分别采集试验区烟叶、烟根及土壤样品;对于烟叶和烟株根系样品采用愈创木酚测定法测定过氧化物酶(POD)[17];过氧化氢紫外分光光度法测定过氧化氢酶(CAT)[18];氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)[19];邻苯二酚法测定多酚氧化酶(PPO)[20];对于土壤样品采用分光光度法测定过氧化氢酶(CAT),邻苯三酚比色法测定多酚氧化酶(PPO),修改后的邻苯三酚比色法测定过氧化物酶(POD)[21-22]。苯酚钠比色法测定脲酶(Urease)活性[22]。
1.4.4 烟株内部结构的观察
在扬州大学分析测试中心周卫东老师协助下,分别对田间试验中健康烟株、发病烟株和生物有机肥处理中未发病烟株进行茎部和根部的扫描电镜(SEM)观测。对发病烟株和健康烟株的茎基部进行X射线能量色散谱分析。
1.5 数据处理
试验数据采用Microsoft Excel 2003处理,显著性分析采用SPSS Base Ver.13.0统计软件 (SPSS, IL,Chicago, USA)进行, LSD、Duncan 新复极差进行多重比较(P≤0.05)。
2 结果
2.1 青枯病的防控效果和产量
安徽试验点两年试验结果表明:与对照相比,施用生物有机肥后烟草青枯病的发病率和病情指数显著降低(图1)。第1年和第2年CK处理移栽50天后的发病率分别为26.1%和23.9%,病情指数分别为17.4和18.2,两年间都无显著差异。而 BOF处理第1年和第2年的发病率分别为6.9%和1.0%,病情指数分别为3.0和0.7,两年间存在显著差异。同一处理第2年的发病率和病情指数都显著低于第1年。第1年的防控效果达到75.2%,而第2年防控效果达到95.4%,比第1年高14.6%。各处理105天的发病率和病情指数均高于50天,BOF处理50天对烟草青枯病的防控效果好于105天,说明生物有机肥具有延缓发病时间和前期减轻发病的作用。
两年田间试验都表明:施用混合生物有机肥后可以显著地增加烟叶的产量。BOF处理与CK处理相比,第1年增产2.4倍,第2年增产2.6倍,CK处理两年间产量无显著差异,BOF处理第2年产量显著高于第1年产量,比第1年增加11.9%。
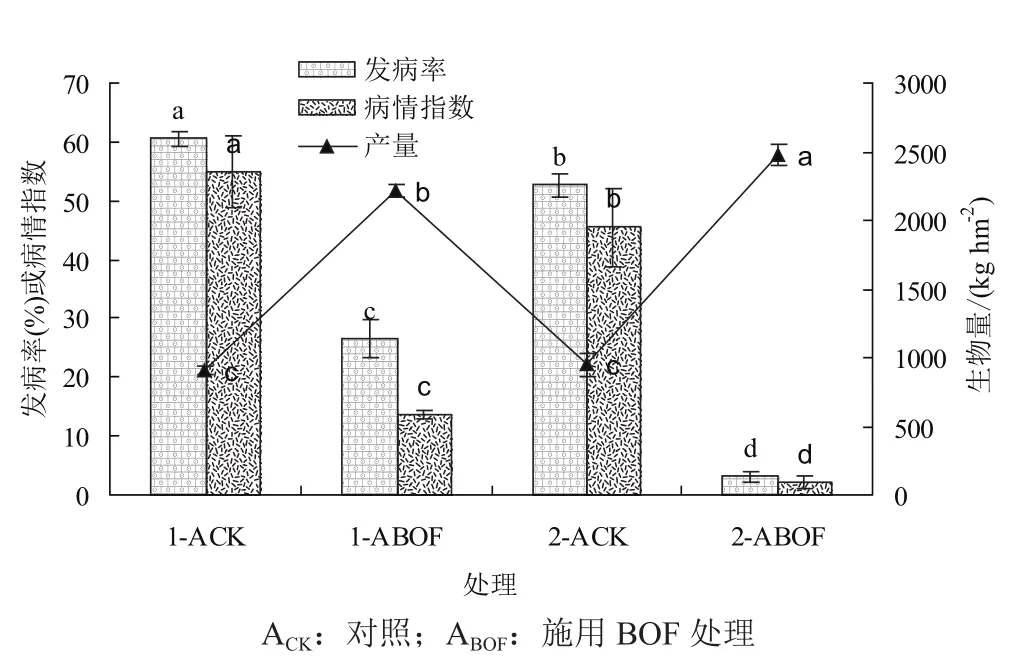
图1 大田试验小区产量和105天防控效果
2.2 烟株抗性酶活性
从表2、表3可以看出:对照与BOF处理相比,叶片和根系的抗性酶过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和多酚氧化酶(PPO)活性都随发病率增高而变大,即与对照相比,施入生物有机肥后叶片和根系的抗性酶活都显著降低了(p≤0.05)。其中,叶片的POD、CAT和SOD与发病率呈显著相关(p≤0.05),根系CAT和PPO与发病率呈显著相关(p≤0.05),SOD与发病率呈极显著相关(p≤0.01)。
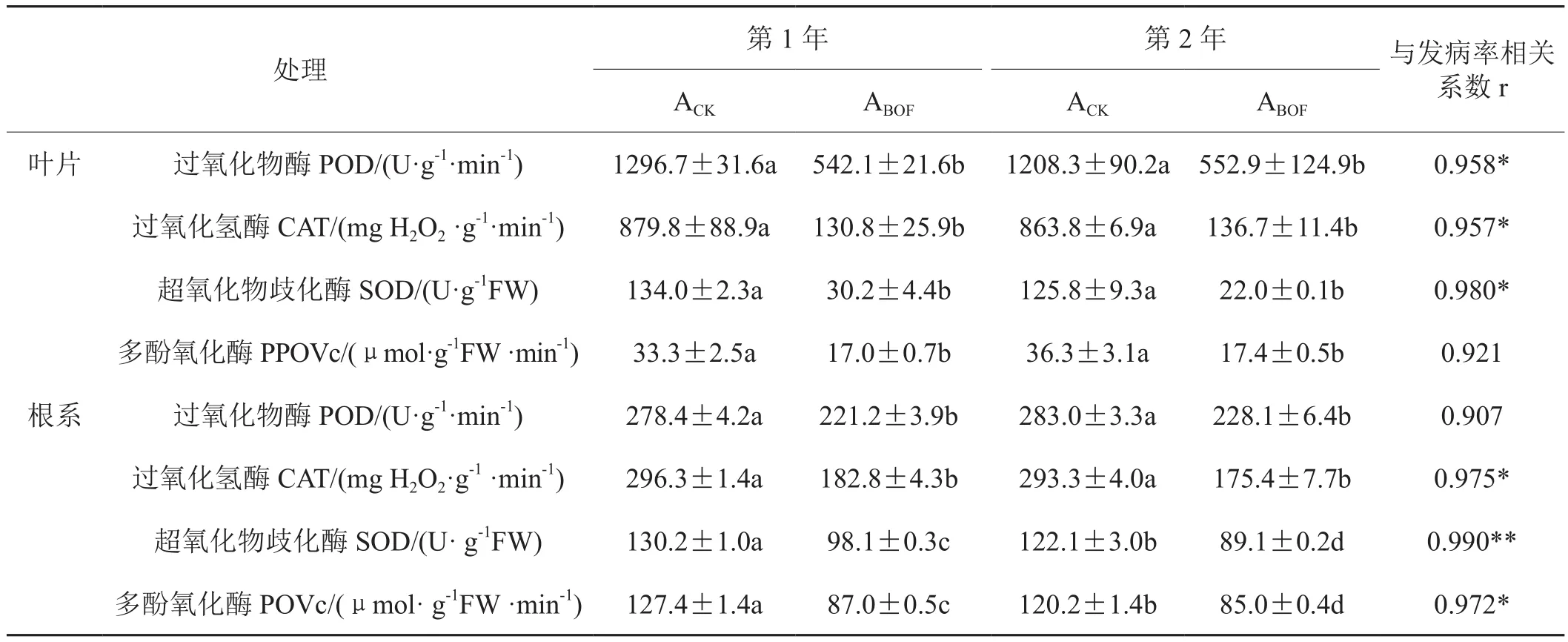
表2 田间试验植株抗性酶活性(50天)
由于在移栽后105天时烟株的中下部烟叶已经开始落黄,烟草的生长也进入衰退期,叶片和根系活力都大大下降(表3),叶片和根系酶活都小于移栽后50天测得的叶片和根系酶活。105天时对照处理和生
物有机肥处理间各酶活差异也小于50天,但仍呈现出生物有机肥处理各种抗性酶活性都显著小于对照处理的特征。根系SOD和PPO与发病率呈显著相关性(p≤0.05)。
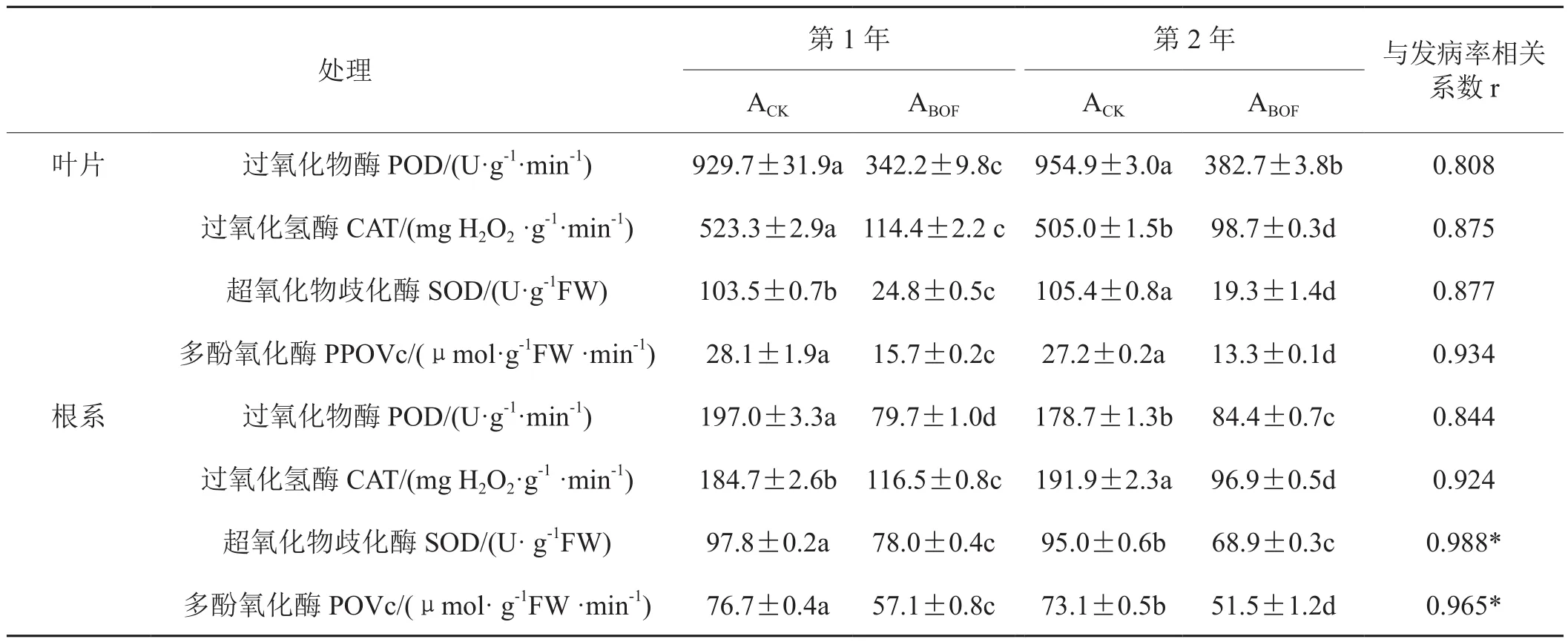
表3 田间试验植株抗性酶活性(105天)
2.3 土壤酶活性
对照与施加生物有机肥处理50天的土壤过氧化氢酶、过氧化物酶、多酚氧化酶以及脲酶活性都高于105天(表4)。从两个测定时间都可以看出,与对照处理相比,施用生物有机肥后过氧化氢酶、过氧化物酶、多酚氧化酶和脲酶活性都显著增强。移栽后50天和105天土壤除多酚氧化酶与发病率无显著相关性,其它各类氧化还原酶活及脲酶与发病率都呈显著负相关性。
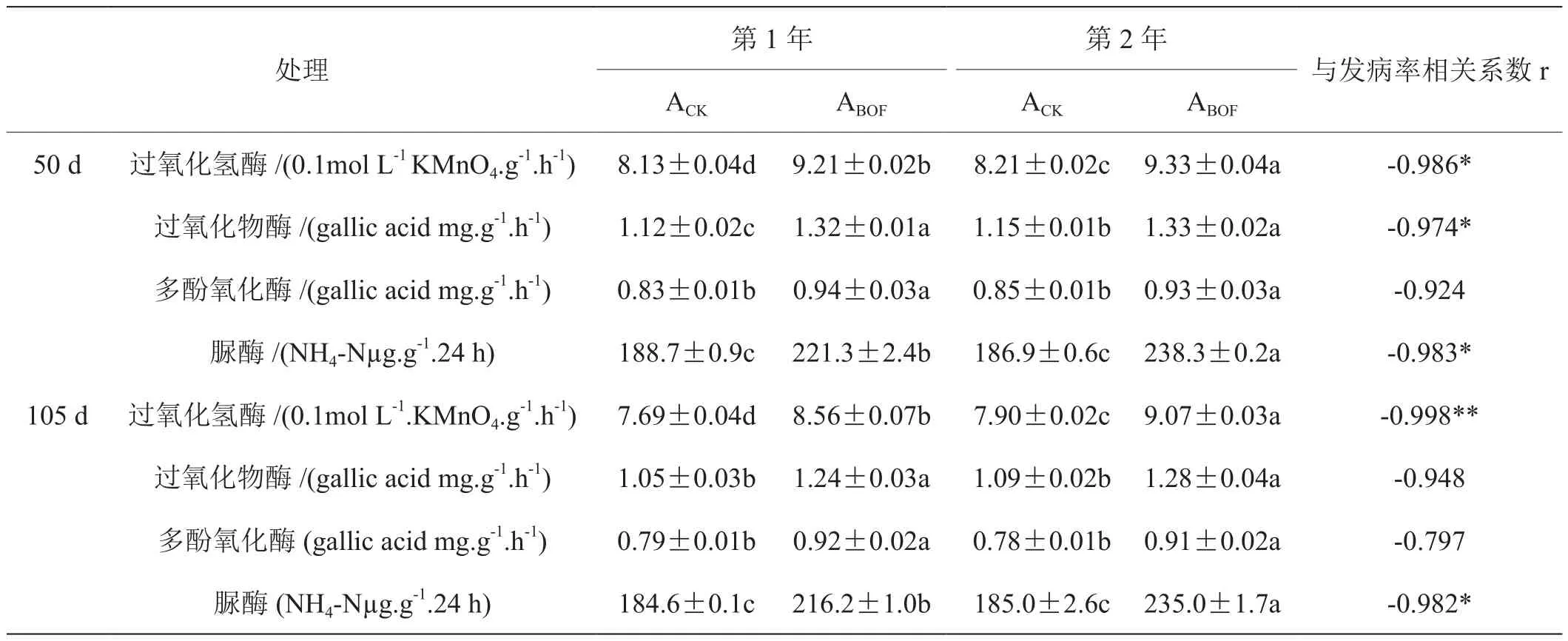
表4 田间试验土壤酶活性
2.4 烟株维管束变化
烟株生理系统对施入拮抗菌或发病时的响应不只是表现在叶片和根抗性酶的变化,还体现在植物体内维管束的变化。在扫描电镜下,健康烟株的维管束呈现标准圆柱形,且导管通畅,管中无异物(图2 A,D)。而被青枯病病原菌侵染发病的烟株,维管束变形导致畸形,维管束导管中间有粘液状的物质,堵塞了大部分维管束(图2 B,E)。而在BOF处理中未发病的烟株,在扫描电镜下发现,一小部分的维管束导管中有粘液状的物质,维管束较对照稍有变形,不再是圆柱形,但与发病烟株相比,粘液状物质较少,大部分导管未被堵塞,导管变形不严重(图2 C,F)。

图2 扫描电镜下烟草茎基部的维管束
从维管束组织的能谱图中可以看出(图3),健康植株中氧和碳的量最高,另外钾、磷和钙也有相对较小量的存在。而对照小区的病株中钾和钙的含量相对较高,氧和碳含量与对照较为相似。最为不同的是,在BOF处理未发病烟株中的钾和钙的含量相对较高,甚至钾、钙及磷的含量高过氧和碳。
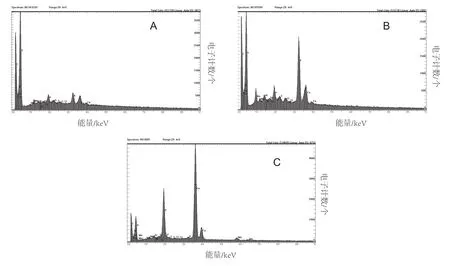
图3 对不同处理下木质部组织及使维管束变形的未知物质进行能谱分析
3 讨论
近年来研究表明,将有机肥与功能微生物(生防菌、促生菌等)相结合制成微生物有机肥后施用,对各种土传病害具有较好的防控效果[23-25]。生物有机肥在防控香蕉枯萎病[26-27],黄瓜枯萎病[28-29],甜瓜枯萎病[9],西瓜枯萎病[30],棉花黄萎病[31],烟草黑胫病[32]等都有成功的报道。生物有机肥的使用不但提高了土壤中有机质含量从而促进土壤有益微生物的生长繁殖,抑制病原菌数量[33-34],并且促进作物系统获得抗病性(SAR),提高自身免疫能力并促进作物生长,有效地防控田间的病害。
植物防御酶与植物抗性关系密切[35],它的诱导产生是植物重要的生理生化抗性机制之一,因此,植物防御酶与病害发病率间存在着一定的相关关系[36]。Goldstein等[37]证明,在田间施用堆肥和堆肥发酵液可以激活植物的许多抗病基因。植株受到拮抗菌的影响产生自体抗性还表现在系统抗性酶的变化上。一般情况下,当植株受到损伤、病原菌侵染或是温度胁迫等,植物抗性酶活就会升高[38]。吴洪生等[39]发现植株叶片的抗性酶与植物对病原菌侵染的响应间有着显著的相关性,施用BOF后可以有效增加西瓜植株抗性酶活,从而提高对病原菌的免疫抗性,发病率相应减少。罗佳等[40]研究表明,育苗和移栽后都加入生物有机肥后,棉花黄萎病防治率大大增高,植株体内的过氧化氢酶、苯丙氨酸解氨酶和多酚氧化酶的活性都比对照增加了。本试验中通过测定烟株旺长期和成熟期内叶片、根系及土壤各种抗性酶的变化反映烟株对病原菌做出的响应。生物有机肥处理的叶片和根系抗性酶活都显著小于对照处理,此结果与肖相政等[41]关于番茄施用生物有机肥后叶片的PPO和POD缓慢增加的结论相反。而在Zhao et al.[9]的研究中,施用生物有机肥后,甜瓜叶片的POD和SOD的活性都比对照降低,与本文结果相同,这可能由于BOF对烟株和病原菌产生的双重作用导致:BOF一方面可以向烟株提供营养,增强烟株的抗逆性和免疫能力,减少烟株因受到侵害而作出的系统抗性反应;另一方面BOF中的拮抗菌可以较好地抑制病原菌的数量,减少由外界损伤而对烟株造成的诱导效应。
土壤的过氧化氢酶和过氧化物酶广泛存在于土壤和生物体内,能有效防止土壤代谢过程中产生的过氧化物对生物体造成的毒害,其活性与土壤呼吸强度和土壤微生物活动相关,在一定程度上反映了土壤微生物学过程的强度,可以表征土壤总的生物学活性和肥力状况[42],而多酚氧化酶的活性,与土壤腐殖化程度是呈负相关[22]。脲酶是一种酰胺酶,能酶促有机物质分子中肽键的水解,它能专性水解尿素。已经有研究证明,土壤的脲酶活性,与土壤的微生物数量、有机物质含量、全氮和速效氮含量呈正相关[43]。人们常用土壤的脲酶活性表征土壤的氮素状况[22]。本试验中生物有机肥处理土壤的三种抗性酶活和脲酶活性都显著高于对照,表明施用生物有机肥后土壤的生物活性和腐殖化程度增强,土壤氮营养水平增强,土壤趋向健康方向发展。
有相关报道表明,青枯病的主要发病机制就是菌体从植物根茎的伤口和次生根的根冠部位侵入,继而穿过根冠和主根表皮形成的鞘,同时引起相邻的薄壁组织的细胞壁膨胀。青枯菌侵入皮层后在细胞间隙繁殖,然后再侵入邻近的皮层细胞。侵入植物体的青枯菌先破坏细胞间的中胶层,使寄主植物的细胞壁解体,质壁分离,细胞器变形,形成空腔。青枯菌还可以从植物的受伤部位侵入,直接进入导管繁殖。青枯菌在导管生长时可以产生大量胞外多糖,胞外多糖影响和阻碍植物体内的水分运输,特别是易于对叶柄结和小叶处较小孔径的导管穿孔板造成堵塞,因而引起植株萎蔫。同时,青枯菌还向细胞外分泌多种细胞壁降解酶(例如果胶酶和纤维素酶),这些细胞壁降解酶可能也在破坏导管组织引起植株枯萎死亡方面有重要作用[44,45]。用扫描电镜结合能谱仪分析技术能够较准确地观测并分析出植物组织超微结构的变化特征及各种元素在植物体内的含量、分布、存在状态和其对植物生长发育造成的生理生化改变等[46]。目前已经有研究表明,当烤烟受到烟草花叶病毒侵染后叶片中超微结构会产生变化,叶绿体结构受到严重破坏,被膜及类囊体膜破坏,基质外流,基本上未见到有完整被膜的叶绿体及其内的基粒结构[12]。李海燕等[47]研究表明,在根茎性病害辣椒疫霉菌作用下,辣椒叶片组织的超微结构发生显著变化。玉米受到茎腐病影响,玉米根细胞壁被降解,玉米胚根细胞膜及亚细胞器结构也被损伤[48]。本文通过对植株的根部和叶片进行扫描电镜观察后发现,被茄科劳尔氏菌侵染的烟株导管中布满粘性物质,堵塞维管束,可能影响水分的运输,从而引起烟株青枯病的发生。而且导管严重变形,而健康对照烟株的导管束生长正常。从能谱图中可以看出,被病原菌侵染的烟株中的K和Ca含量较高,这可能是由于植物抗病性在病原菌侵染条件下受到刺激而变化,Liu et al.[49]的研究也得到类似结果,同时刘淑欣等[50]的研究中同样发现,叶片中随着磷钾养分含量的增加,葡萄植株抗性增强,叶片发病率显著减小,这与本试验中的生物有机肥处理维管束中的P、K含量升高结果一致。
4 结论
抑制烟草青枯病生物有机肥的施用可以诱导并促进烟草在土传病害环境胁迫下产生系统抗性,也可以促进土壤生物活性的提高,一定程度减少烟草维管束变形和木质部堵塞情况的发生,进而达到对烟草青枯病的有效防控。
[1]罗宽, 王庄. 利用拮抗的Pseudomonas spp.和无致病力的P. solanacearum防治青枯病的研究[J]. 植物病理学报,1983, 13: 51-56.
[2]郑继法, 张建华, 许永玉, 等. 利用无毒产细菌素菌株防治烟草细菌性青枯病[J]. 中国烟草, 1994(3): 21-24.
[3]Abawi G S, Widmer T L. Impact of soil health management practices on soilborne pathogens, nematodes and root diseases of vegetable crops[J]. Applied Soil Ecology, 2000,15: 37-47.
[4]蔡燕飞, 廖宗文, 章家恩. 生态有机肥对土壤微生物多样性和番茄青枯病的影响[J]. 应用生态学报, 2003, 14:349-353.
[5]李胜华, 谷丽萍, 刘可星, 等. 有机肥配施对番茄土传病害的防治及土壤微生物多样性的调控[J]. 植物营养与肥料学报, 2009, 15: 965-969.
[6]Zhou T, Paulitz T C. Induced resistance in the biological control of Pythium aphanidermatum by Pseudomonas spp. on cucumber[J]. Journal of Phytopathology, 1994, 142: 51-63.
[7]Van Peer R, Niemann G J, Schippers B. Induced resistance and phytoalexin accumulation in biological control of Fusarium silt of carnation by Pseudomonas sp. Strain WCS417r[J]. Phytopathology, 1991, 81: 728-733.
[8]Jetiyanon K. Defensive-related enzyme response in plants treated with a mixture of Bacillus strains (IN937a and IN937b) against different pathogens[J]. Biological Control,2007, 42: 178-185.
[9]Zhao Qingyun, Dong Caixia, Yang Xingming, et al. Biocontrol of Fusarium wilt disease for Cucumis melo melon using bioorganic fertilized[J]. Appl Soil Ecol, 2011, 47: 67-75.
[10]王鹏. 有机生物活性肥料对土壤肥力、微生物及酶活性的影响[J]. 安徽农学通报, 2006, 12: 114-115.
[11]周革, 倪福太, 张立娟. 植物在逆境中的形态结构及生理变化[J]. 吉林师范大学学报:自然科学版, 2004(2):64-67.
[12] 刘国顺, 张彩霞, 王婵娟, 等. 受烤烟花叶病病毒侵染后叶中保护酶活性和超微结构的变化[J]. 植物生理学通讯,2009, 45: 459-463.
[13] 张华, 赵百东, 冀浩, 等. 水分协迫对烤烟腺毛超微结构的影响[J]. 中国烟草学报, 2008, 14(5): 45-47.
[14] 时向东, 蔡恒, 王德华, 等. 香料烟叶片发育和调制过程中细胞超微结构的变化[J]. 中国烟草学报, 2008, 14(5):48-52.
[15] 赵斌, 何绍江. 稀释平板测数法[M]. 北京: 科学出版社,2002: 69-72.
[16]Shida Osamu, Takagi Hiroaki, Kadowaki Kiyoshi, et al.Proposal for two new genera, Brevibacillus gen.nov. and Aneurinibacillus gen.nov.[J]. Int J System Bacteriol, 1996,46: 939-946.
[17]巩普遍. 过氧化物酶活性的测定[M]. 高等教育出版社,2000: 164-165.
[18] 杨兰芳, 庞静, 彭小兰, 等. 紫外分光光度法测定植物过氧化氢酶活性[J]. 现代农业科技, 2009, 20: 364-366.
[19] 陈翠莲. 氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活力[M]// 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 167-169.
[20] 萧浪涛, 王三根. 多酚氧化酶活性测定[M]. 北京:中国农业出版社, 2005: 85-87.
[21] 关松荫. 氧化还原酶[M]. 北京: 农业出版社, 1986: 320-330.
[22] 周礼恺, 张志明. 土壤酶活性的测定方法[J]. 土壤通报,1980, 5: 37-39.
[23]Hoitink H A J, Boehm M J. Biocontrol within the context of soil microbial communities: a substrate-dependent phenomenon[J]. AnnRevPhytopathol, 1999, 37: 427-446.
[24]刘爱华, 徐保民, 陈燕. 不同配方施肥及微生物菌肥对大蒜重茬病防治效果[J]. 山东农业科学, 2009, 6: 91-92.
[25]Trillas M Isabel, Casanova Eva, Cotxarrera Lurdes.Composts from agricultural waste and the Trichoderma asperellum strain T-34 suppress Rhizoctonia solani in cucumber seedlings[J]. Biological Control, 2006, 39: 32-38.
[26]Zhang Nan, Wu Kai, He Xin, et al. A new bioorganic fertilizer cna effectivily control banana wilt by strong colonization with Bacillus subtilis N11[J]. Plant Soil, 2011, 344: 87-97.
[27] 何欣, 郝文雅, 杨兴明, 等. 生物有机肥对香蕉植株生长和香蕉枯萎病防治的研究[J]. 植物营养与肥料学报,2010, 16: 978-985.
[28]Zhang Shusheng, Raza Waseem, Yang Xingming, et al.Control of Fusarium wilt disease of cucumber plants with the application of a bioorganic fertilizer[J]. Bio Fertil Soils,2008, 44: 1073-1080.
[29]Cao Yun, Zhang Zhenhua, Ling Ning, et al. Bacillus subtilis SQR9 can control Fusarium wilt in cucumber by colonizing plant roots[J]. Bio Fertil Soils, 2011, 47: 495-506.
[30] 凌宁, 王秋君, 杨兴明, 等. 根际施用微生物有机肥防治连任西瓜枯萎病研究[J]. 植物营养与肥料学报, 2009,15: 1136-1141.
[31] 张慧, 杨兴明, 冉炜, 等. 土传棉花黄萎病拮抗菌的筛选及其生物效应[J]. 土壤学报, 2008, 45: 1095-1101.
[32]Ren Xiaoli, Zhang Nan, Cao Minghui, et al. Biological control of tobacco black shank and colonization of tobacco roots by a Paenibacillus polymyxa strain C5[J]. Bio Fertil Soils, 2012, 48: 613-620.
[33]Gary D B, Mary K T, Julie E J. Interactions bewteen crop residue and soil organic matter quality and the functional diversity of soil microbial communities[J]. Soil Biol Biochem, 2002, 34: 1073-1082.
[34]Tajul M D I, Koki T. Suppression of bacterial wilt of tomato by Ralstonia solanacearum by incorporation of composts in soil and possible mechanisms[J]. Microb Ecol, 2004, 19:53-60.
[35] 宋瑞芳, 丁永尔, 宫长荣, 等. 烟草抗病性与防御酶活性间的关系研究进展[J]. 中国农学通报, 2007, 23: 309-314.
[36] 贺字典, 高增贵, 庄敬华, 等. 玉米丝黑穗病菌对寄主防御相关酶活性的影响[J]. 玉米科学, 2006, 14: 150-151.
[37]Goldstein Jerome. Compost suppresses disease in the lab and on the fi elds[J]. Bio Cycle, 1998, 11: 62-64.
[38]Garcia-Limones C, Harvas A, Navas-Cortes J A, et al.Introduction of an antioxidant enzyme system and other oxidative stress markers associated with compatible and incompatible interactions between chickpea(Cicer arietinum L.) and Fusarium oxysporum f.sp.ciceris[J]. Physiological and Molecular Plant Pathology, 2002, 61: 325-337.
[39]Wu Hongsheng, Yang Xingming, Fan Jiaqin, et al.Suppression of Fusarium wilt of watermelon by a bioorganic fertilizer containing combinations of antagonistic microorganisms[J]. BioControl, 2009, 54: 287-300.
[40] 罗佳, 赵爽, 袁玉娟, 等. 施用微生物有机肥对棉花抗性病相关酶活性的影响[J]. 南京农业大学学报, 2011, 34:89-93.
[41]肖相政, 刘可星, 廖宗文. 生物有机肥对番茄青枯病的防效研究及机理初探[J]. 农业环境科学学报, 2009, 28:2368-2373.
[42]魏媛. 退化喀斯特植被恢复过程中土壤生物学特性研究-以贵州花江地区为例[D]. 南京: 南京林业大学, 2008.
[43] 李琰琰, 刘国顺, 向金友, 等. 氮营养水平对植烟土壤养分含量及土壤酶活性的影响[J]. 中国烟草学报, 2011,17: 39-43.
[44]Genin S, Boucher C. Ralstonia solanacearum: secrets of a major pathogen unveiled by analysis of its genome[J]. Mol Plant Pathol, 2002, 3: 111-118.
[45]李林章, 谢从华, 柳俊. 茄科雷尔氏菌(Ralstonia solanacearum)分子生物学基础及其致病机制[J]. 中国马铃薯, 2005, 19: 290-294.
[46]刘敏, 周世恭. 稀土元素镧在植物细胞生理研究中应用的进展[J]. 植物学通报, 1995(2): 32-37.
[47]李海燕, 肖淑琴, 刘惕若. 辣椒疫霉菌粗毒素对叶片组织超微结构的影响[J]. 园艺学报, 2005, 32: 713-715.
[48] 高洪敏, 宁家林, 于兵, 等. 玉米茎腐病菌致病因子对玉米超微结构的影响[J]. 玉米科学, 2006, 14: 147-149.
[49]Liu Xiaoyang, He Ping, Jin Jiyun. Advances in effect of potassium nutrition on plant disease resistance and its mechanism[J]. Plant Nutr Fertil Sci, 2006, 12: 445-450.
[50]刘淑欣, 熊德中, 冯国文. 磷钾营养与葡萄产量、品质及抗病性的关系[J]. 福建农学院学报:自然科学版,1993, 22: 203-207.

