苗期大豆对土壤水分和空气湿度变化的生理生化响应
楼靓珺,宋新山,赵晓祥
(东华大学环境科学与工程学院,上海 201620)
作为重要的油脂类作物,大豆(Glycinemax)是人类日常生活中最主要的食物之一,是我国草地农业生态系统中重要的传统生产植物。大豆根系不发达,对土壤缺水极其敏感,苗期的大豆对干旱的生理响应更为敏感[1]。我国干旱频发,东北地区春夏旱以及南方的伏旱、秋旱发生时,大豆通常处于苗期[2]。短时期或轻度干旱对壮苗及提高其抗旱能力有一定的积极作用,但是干旱程度过重会对大豆的后期生长造成伤害[3-4]。干旱可以分为土壤干旱和大气干旱,而土壤缺水和大气干燥都会对大豆造成生理危害、萎蔫甚至死亡。干旱胁迫下植物细胞的膜脂过氧化加剧,细胞渗透压发生变化(如可溶性糖、游离脯氨酸等含量发生变化),而保护酶(如SOD、POD及CAT等)系统会通过调节酶活性来清除自由基抵御氧化伤害。
目前,全球自然灾害频发,“温室效应”使全球水循环加速,水汽流动会改变局部地区的正常气候,并影响大气相对湿度水平,继而影响植物的生长和生理代谢活动[5-6]。植物通过根系和叶片吸收水分,土壤干旱会迫使植物从大气中摄入更多的水汽来保障正常生理需要。但是,有关空气湿度对大豆生长和生理变化影响的报道甚少[7-8],有研究发现,增加空气湿度可影响叶片气孔的开闭,缓解光合“午休”现象[9],减弱土壤干旱及高温对作物的伤害[10]。本研究以大豆为试验材料,在苗期进行不同梯度土壤水分和空气湿度处理,旨在研究大豆叶片的生理生化指标对两者互作的响应,探讨能否通过提高空气湿度改变土壤干旱对大豆苗期生长的抑制,以及两者是否存在协同作用。
1 材料与方法
1.1试验材料 2011年9月在人工气候箱里控制温湿度条件下培育大豆,供试大豆品种为“豫豆19”,从河南省农业科学院种子公司购买大豆种子。筛选颗粒圆润、大小和色泽均匀、种皮完整、无明显裂痕和斑点的大豆种子播种到装有混合土(粘壤土与沙土体积比为2∶1)的塑料盆(内径22 cm,高度25 cm)内,每盆6~7穴,每穴3粒,穴深3~5 cm。在萌芽期保证土壤田间持水量不低于75%。播种后的盆栽置于人工气候箱(昼夜温度25 ℃/20 ℃,光照时间12 h·d-1,空气相对湿度水平按处理要求控制)中培养,不定期轮换各盆位置,避免光照对植株的影响。播种10 d后每盆留下长势基本一致的大豆苗10株,每天定时测定土壤含水量,并及时补给水分,清除盆内杂草。
1.2试验设计 空气湿度设3个梯度[11-12],分别为低湿35%~45%(L)、中湿55%~65%(M)和高湿85%~95%(H),各处理设3个重复,每重复种植4盆,每湿度条件共计12盆。土壤水分胁迫处理设4个梯度:对照组(C1)为田间最大持水量(MFC)的80%~85%,轻度干旱组(C2)为MFC的70%~75%,中度干旱(C3)为MFC的55%~60%,重度干旱(C4)为MFC的35%~40%。
1.3测定指标及方法 叶片相对含水量(LRWC)参照邹琦[13]的方法测定:
叶片相对含水量=(鲜质量-烘干质量)/(饱水质量-烘干质量)×100%。
可溶性糖含量采用蒽酮比色法测定[14];游离脯氨酸含量采用酸性茚三酮法测定[14];丙二醛(MDA)含量采用硫代巴比妥酸法测定[15];超氧化物歧化酶(SOD)活性采用NBT光化还原法测定[16-17];过氧化物酶(POD)活性采用愈创木酚比色法测定[16-17]。
1.4数据处理 试验数据采用3个重复的平均值±标准差(Mean±SE),用Excel软件进行数据汇总分析,用SPSS 13.0软件进行统计相关性分析,用Origin软件进行绘图。
2 结果与分析
2.1空气湿度对大豆叶片丙二醛含量的影响 C3和C4处理组在低湿(L)环境下的MDA含量比C2组分别高55%和134%(图1)。当提高空气相对湿度至M水平时,C3和C4的MDA含量与湿度为L时相比分别显著减小了13.9%和30.9%(P<0.05)。当空气湿度继续提高至H水平时,4组MDA含量也都有不同程度的下降,C4显著下降36%(P<0.05)。干旱处理由5 d(图1A)增加至10 d时(图1B),MDA含量随着干旱时间延长小幅上升。
2.2空气湿度对大豆叶片相对含水率的影响 随着土壤干旱程度加剧,叶片LRWC降低(图2)。增加空气湿度后叶片LRWC提高,且重度干旱C4组对空气湿度的响应显著优于对照组(P<0.05)。干旱5 d后,C4的高湿处理比中、低湿度处理分别高5.1%、17.9%(图2A);干旱10 d后,C4的高湿处理比中、低湿度处理分别高7.9%、19.7%(图2B)。比较干旱处理5和10 d可以看出,随着干旱时间延长,叶片LRWC降低。轻度和中度干旱(C2、C3)有所下降,幅度最大为C2-L组合,下降4.7%。对于重度干旱C4组尤其是低湿(L)下叶片LRWC显著降低了7.9%,高湿(H)下延长干旱时间,叶片LRWC下降5%。

图1 土壤水分和空气相对湿度对干旱5 d(A)和干旱10 d(B)的大豆MDA含量的影响Fig.1 Influence of soil moisture and air humidity changes for 5 d(A)and 10 d(B) on MDA content

图2 土壤水分和空气相对湿度对干旱5 d(A)和干旱10 d(B)的大豆LRWC的影响Fig.2 Influence of soil moisture and air humidity changes for 5 d(A) and 10 d(B) on LRWC
2.3空气湿度和土壤水分胁迫对大豆细胞渗透压的影响
2.3.1可溶性糖含量的变化 随着土壤水分胁迫程度加深和干旱时间的延长,大豆的可溶性糖含量增加(图3)。低湿环境下,C4处理5 d,可溶性糖增加量比C1、C2以及C3分别提高33.8%、33.3%以及24.9%。L湿度下,C3和C4从干旱5 d到干旱10 d可溶性糖含量增加22.9%和19.9%;H湿度时增加10.8%和26.9%。空气湿度上升,可缓解植物干旱压力,使可溶性糖含量降低,对中、重度干旱更加显著(P<0.05)。干旱5 d(图3A)C4的高湿处理比中、低湿度处理的可溶性糖含量分别低28.7%和74.6%,干旱10 d(图3B)时分别低29.3%和64.9%。

图3 土壤水分和空气相 地湿度对干旱5 d(A)和干旱10 d(B)的大豆叶片可溶性糖含量的影响Fig.3 Influence of soil moisture and air humidity changes for 5 d(A) and 10 d(B)on soluble sugar content
2.3.2游离脯氨酸含量的变化 随着干旱程度加深,脯氨酸含量上升(图4)。提高空气湿度及延长干旱时间,可使游离脯氨酸含量降低。高湿处理下的叶片游离脯氨酸含量显著低于低湿处理(P<0.05),5 d干旱处理(图4A)的C4高湿处理比低湿低33.6%。
2.4空气相对湿度对大豆叶片SOD活性的影响 随干旱胁迫加剧及时间增加,大豆叶片SOD活性下降(图5)。但是C3-M组合SOD活性比C2-M的高,可能是此时C3-M的·O2-等活性氧自由基积累反馈导致的。提高空气湿度能显著增强叶片SOD酶活性(P<0.05)。低湿环境下干旱胁迫增加的前3个阶段SOD含量小幅的先降后升(图5A);在C4严重缺水时与C2相比下降68%。当空气湿度上升为M,C1、C2、C3和C4胁迫处理的SOD含量都有所上升,分别为31.6%、11.6%、31.5%和49.8%。随着干旱时间延长至10 d(图5B),活性氧积累,SOD活性降低。其中延长干旱时间对高湿处理下C4的SOD活性影响最大,从70.5 U·g-1降低到53.6 U·g-1。低湿条件下C1组SOD活性下降,提高空气湿度至H使其活性显著提高62.8%(P<0.05)。
2.5POD活性与空气相对湿度的关系 在空气相对湿度较低条件下,大豆叶片POD活性在土壤干旱胁迫加剧情况下加强,随着空气湿度改变,POD变化显著(P<0.05)(图6)。低湿下干旱5 d(图6A),C4处理比C1的POD活性增加34.2%,高湿处理增加10.6%。增加干旱时间(图6B),POD活性上升。湿度越低,干旱胁迫越强,干旱时间越长,POD活性就越高。

图4 土壤水分和空气相对湿度对干旱5 d(A)和干旱10 d(B)的大豆对叶片游离脯氨酸含量的影响Fig.4 Influence of soil moisture and air humidity changes for 5 d(A) and 10 d(B) on free proline content
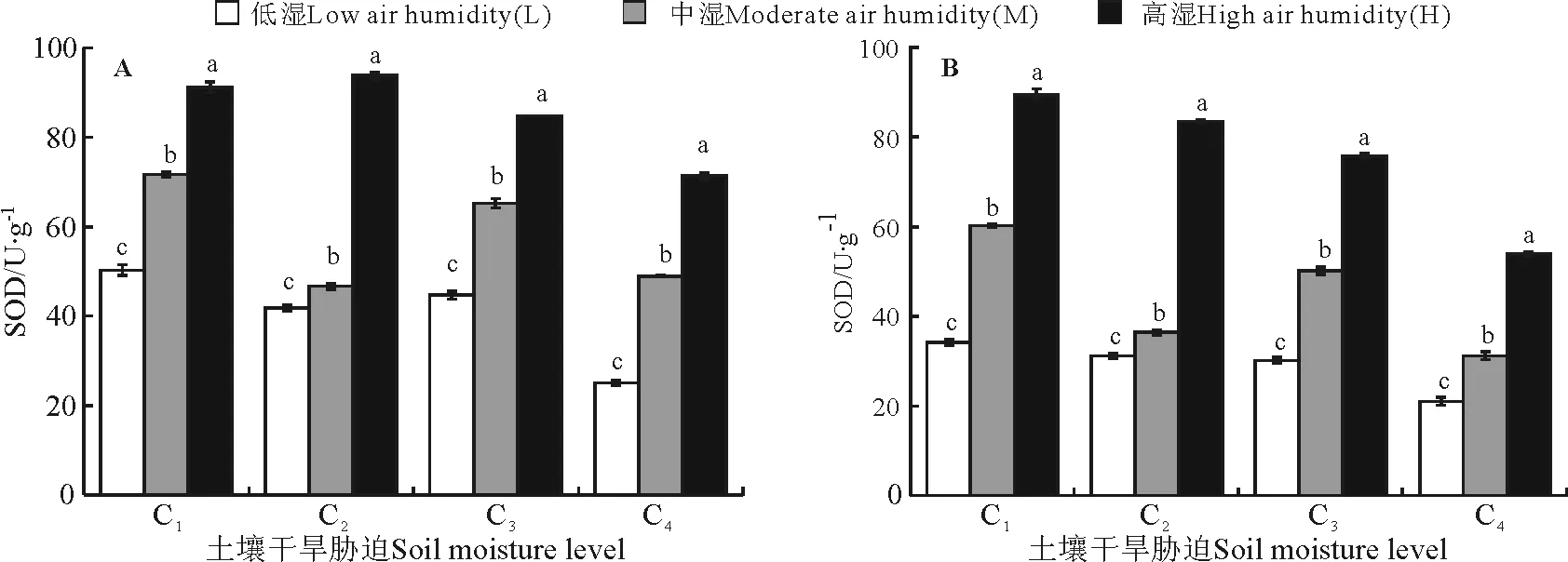
图5 土壤水分和空气相对湿度变化对干旱5 d(A)和干旱10 d(B)的大豆SOD活性的影响Fig.5 Influence of soil moisture and air humidity changes for 5 d(A) and 10 d(B) on SOD activity
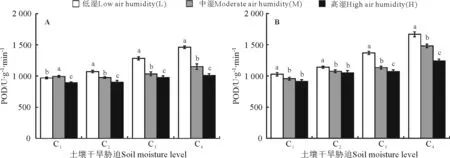
图6 土壤水分和空气相对湿度变化对干旱5 d(A)和干旱10 d(B)的大豆POD的影响Fig.6 Influence of soil moisture and air humidity changes for 5 d(A) and 10 d(B) on POD activity
3 讨论与结论
在受到干旱、盐碱等逆境胁迫时,植物细胞膜会发生膜脂过氧化作用。MDA作为细胞膜脂过氧化作用的主要产物之一,其含量增加说明细胞膜脂过氧化加剧,植物遭受逆境伤害严重[18-19]。干旱胁迫程度加重会造成植物萎蔫度和细胞膜通透度不断升高,同等干旱胁迫下空气湿度高的作物细胞膜透性较高[20-21]。本研究结果表明,随着干旱胁迫程度的加剧和干旱时间的延长,大豆幼苗的生长发育受害严重。轻度干旱与对照组植物性状差异不明显。
土壤环境处于轻度或中度干旱而空气湿度高时,植物可以通过叶片气孔吸收水汽来补充水分,减弱土壤缺水造成的伤害。即提高空气湿度在一定程度上可以减轻豆苗干旱损伤。当土壤缺水严重时,大豆幼苗萎蔫,生长受阻,仅靠增加空气湿度方式收效甚微,提高空气湿度对改善性状效果不明显,不能缓解土壤干旱危机。
本研究中,随着土壤干旱程度加剧,大豆MDA含量增加,这说明细胞膜脂过氧化加剧,重度干旱下植物生理性状变化表现更加明显。同时,可溶性糖和脯氨酸含量的上升也表明植物已经开始对干旱做出应激反应。提高空气湿度能减缓MDA的积累速率,改善土壤缺水对植物细胞膜脂过氧化危害,对高湿环境严重缺水组的减缓作用尤其明显。延长干旱时间会增加MDA的积累,但空气湿度对MDA积累的影响更大。当干旱胁迫加剧时,植物体会产生一系列应激反应,通过可溶性糖、游离脯氨酸等的积累来减弱植物的干旱危机。随着干旱时间的延长,可溶性糖含量上升。随着空气湿度的升高,叶片细胞的可溶性糖和游离脯氨酸等小分子物质的积累减少,说明一定程度上减轻了干旱危机。这样有利于植物在干旱条件下吸收水分,保证细胞不缺水,提高抗胁迫能力。李明等[22]的研究认为干旱胁迫会改变植物细胞膜的渗透势,导致膜脂过氧化,引起MDA含量增加,与本研究得到的结果一致。
在遇到逆境胁迫(如干旱、高温、盐碱、水涝、冻害和环境污染等)时,植物体内活性氧大量积累[23],破坏了原本的平衡体系,导致细胞内氨基酸、蛋白质、膜脂类和DNA氧化发生改变,造成生长发育受阻[24-25]。本研究表明,植物叶片SOD活性与植物水分状况有关,植物水分亏缺会导致SOD活性下降。随着干旱时间延长和干旱程度加深,SOD活性减弱,POD活性升高,而提高空气湿度能增强SOD活性,清除更多的超氧阴离子,同时生成的H2O2可通过POD进一步分解利用。此外,随空气湿度的提高,抗氧化酶系中SOD活性增加,POD活性下降,两者含量一上一下共同保证整个抗氧化酶系的动态平衡。
植物或通过叶片从空气摄入水分,或根系吸收土壤水分。若某条途径受阻,为了保证植物体内水分供应,势必会增加另一途径摄入的水分量。本研究发现,两条途径有主次之分,土壤水分状态直接影响植物体的生长情况,单单提高空气湿度对改善植物干旱损伤的效果不是很大。当土壤干旱时,提高大气相对湿度并不能弥补土壤水分亏缺造成的伤害,但能在一定程度上减弱这种伤害。需要及时掌握土壤水分变化,在农业生产上采取适当的灌溉措施保证作物的正常生长和产量。
[1] 张恒月,郭屹立,王磊,等.干旱和复水对大豆叶片光合生理特性及产量的影响[J].河南大学学报(自然科学版),2009(2):183-188.
[2] 莫红,翟兴礼.干旱胁迫对大豆苗期生理生化特性的影响[J].湖北农业科学,2007,46(1):45-48.
[3] 王春艳,庞艳梅,李茂松,等.干旱胁迫对大豆苗期生长发育和生理生态特征的影响[J].生物技术进展,2011,1(4):282-288.
[4] 黄占斌,山仑.不同供水作物水分利用效率和光合速率日变化的时段性及其机理研究[J].华北农学报,1999,14(1):47-52.
[5] 黄迪,张佳宝,张丛志,等.不同大气湿度与氮肥水平对夏玉米苗期水分利用效率的影响[J].玉米科学,2012,20(1):123-127.
[6] 翟盘茂,周琴芳.中国大气水分气候变化研究[J].应用气象学报,1997,8(3):342-351.
[7] 刘建福,倪书邦,蒋建国.空气湿度对澳洲坚果授粉受精能力和生理特性的影响[J].热带作物学报,2002,23(2):48-53.
[8] 王艳芳,李亚灵,温祥珍.高温条件下空气湿度对番茄光合作用及生理性状的影响[J].安徽农业科学,2010,38(8):3967-3968,3981.
[9] 许大全.光合作用“午睡”现象的生理生态[J].植物生理学通讯,1990(6):5-11.
[10] 曹晋军,温祥珍,李亚灵.空气相对湿度变化对温室番茄植株糖代谢的影响[J].山西农业大学学报(自然科学版),2011,31(3):235-238.
[11] 王斌,赵慧娟,巨波,等.高温高湿对沼泽小叶桦光合和生理特征的影响及其恢复效应[J].中国农学通报,2011,27(28):47-52.
[12] 张宇,宋敏丽,李利平.亚高温下不同空气湿度对番茄光合作用和物质积累的影响[J].生态学杂志,2012,31(2):342-347.
[13] 邹琦.植物生理学试验指导[M].北京:中国农业出版社,2000:11-12.
[14] 王学奎.植物生理生化实验原理和技术[M].第二版.北京:高等教育出版社,2006.
[15] Bird B R.Determination of malondialdehyde in biological materials by high-pressure liquid chromatography[J].Analytical Biochemistry,1983,128:240-244.
[16] Manoranjan K,Dinabandhu M.Catalase,peroxidase,and polyphenoloxidase activities during rice leaf senescence[J].Plant Physiology,1976,57:315-319.
[17] Garcia-Limones C,Hervas A,Navas-Cortes J A,etal.Induction of an antioxidant enzyme system and other oxidative stress markers associated with compatible and incompatible interactions between chickpea (CicerarietinumL.) andFusariumoxysporumf.sp.ciceris[J].Physiological and Molecular Plant Pathology,2002,61(6):25-337.
[18] 曹慧.水分胁迫诱导苹果属植物叶片衰老机理的研究[D].北京:中国农业大学,2003.
[19] 沈成国.植物衰老生理与分子生物学[M].北京:中国农业出版社,2001:10-15.
[20] Bewley J D.Physiological aspects of desiccation tolerance[J].Annual Review of Plant Physiolgy,1979,30:195-238.
[21] Marcum K B.Cell memebrane thermostability and whole-plant heat tolerance of Kentucky Bluegrass[J].Crop Science,1998,38(4):1214-1218.
[22] 李明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,2002,22(4):503-507.
[23] 田再明,龚学臣,王丁,等.植物对干旱胁迫生理反应的研究进展[J].安徽农业科学,2011,39(26):16475-16477.
[24] Ogawa K,Iwabuchi M.A mechanism for promoting the germination ofZinniaelegansseeds by hydrogen peroxide[J].Plant Cell Physiology,2001,42:286-291.
[25] Hernandes-Jimenez M J,Mercedes L M,De Felipe M R.Antioxidants defense and damage in senescing lupine nodules[J].Plant Physiology and Biochemistry,2002,40:645-657.

