防治烟草黑胫病有益内生细菌的筛选及其抑菌作用
陈泽斌,夏振远,雷丽萍,陈海如
1云南省烟草农业科学研究院,玉溪,653100;2昆明学院农学院,云南,昆明,650214;3云南农业大学植物保护学院,昆明,650201
烟草黑胫病(P. parasiticavar.nicotianae)是1896年Breda de Haan在印尼爪哇烟草上发现的一类土传真菌病害,烟农俗称“黑根”、“黑秆疯”。多发生于成株期,也有少数苗床期发生[1]。该病是烟草的毁灭性病害,现已遍布世界各产烟国。在我国,除较冷的黑龙江省外,其他各产烟省均有不同程度的发生,且危害较为普遍和严重,发病率一般在10%-15%,年均经济损失达1亿元人民币以上[2]。近年来,研发安全、有效的拮抗微生物制剂已备受关注。以往报道的防治烟草黑胫病菌的拮抗微生物主要是从根围分离的真菌、细菌,但定殖差,防效不稳定[3]。植物内生细菌大量存在于健康和患病的植物组织中[4,5]。其作为新的生防因子防治植物病害已成为近10年微生物学研究的一大热点,内生细菌能很好地分布于植株体内,防效比附生菌更稳定持久[6-7]。国内外有关研究报道不断增加,其中关于内生细菌对宿主植物的抗病促生作用更是人们关注的热点问题。王万能等[8]研究表明,内生细菌不仅对烟草黑胫病菌有直接拮抗作用,而且具有诱导抗病作用,用菌液处理植株后,POD,PPO和PAL酶活性上升变化明显。陈博[9]从巴西香蕉中分离到一株能够明显抑制尖孢镰刀菌的内生类芽孢杆菌,该菌株不仅能够抑制香蕉枯萎病的发生,同时能显著促进香蕉苗生根,促生效果与植物生长素IAA相似。杨友才等[10]研究表明,内生细菌发酵液能有效杀死根结线虫二龄幼虫,抑制并减少根结线虫的侵入,使移栽的烟苗能迅速返苗,增强烟株的抗性,并防治根结线虫的侵染。祈之秋等[11]研究表明,内生细菌可通过分泌抗菌物质,来抑制病菌菌丝的生长和分生孢子萌发,防治或减轻病害发生。因而植物内生细菌是具有病菌拮抗作用和病害生物控制潜力的重要微生物资源。显示出了内生细菌作为对环境无公害的生物农药开发应用的良好前景。
鉴于云南生态多样性,生物多样性,微生物种类较多,烟草种植面积较大。为此,笔者对云南省各烟区大量采样,从烟草的不同组织中分离出多种内生细菌,筛选出有效的黑胫病拮抗菌株并对其促生作用进行研究,对于挖掘和利用有益的防病促生细菌具有一定的理论和实践意义。
1 材料和方法
1.1 供试烟草样品和病原物
针对云南不同烟区、不同生长期的叶及成熟期的根、茎进行采样。采样时选择生长性状良好、无病虫害症状的健康植株。样品从植株分离后装于密封的塑料袋中,冷藏箱中低温保鲜,在24h之内进行处理。烟草黑胫病菌162及烤烟红花大金元种子由云南省烟草农业科学研究院提供。
1.2 培养基及主要试剂
内生细菌分离和培养用改良的NA[12]、液体培养用LB[12],烟草黑胫病菌的培养用CA[12]。内生细菌DNA提取、16SrDNA片段扩增、Marker、dNTPs、Buffer等试剂为宝生物工程(大连)产品;其余试剂均为国产分析纯。
1.3 烟草内生细菌的分离和拮抗菌的筛选
[13]的方法进行烟草内生细菌的分离和纯化。烟草黑胫病菌拮抗内生细菌的筛选和发酵滤液拮抗作用测定按照参考文献[14]进行。
1.4 拮抗菌株对盆栽烟草黑胫病的防治效果测定
1.4.1 接种体的制备及接种方法
按参考文献[14]方法进行。
1.4.2 发病调查与病情数据统计
根据培养液滤液抑菌活性测定结果,选择抑菌活性均达显著水平的8个菌株进行了温室盆栽试验,试验共9个处理,每处理10株。接种14d后调查发病情况。烟草黑胫病分级标准参照中华人民共和国烟草行业标准(GB/T 23222-2008)规定执行。
1.4.3 拮抗细菌培养液灌根对烟草苗期生长的影响
以盆栽试验中灌根后且在接种黑胫病菌之前的烟株为观测样本,每处理随机选择4株,分别测量其株高、最大叶长、最大叶宽、茎围。对各处理的促生效果采用DPS数据处理系统7.05版进行Duncan新复极差法进行方差分析。
1.5 菌株wy11的16S rDNA鉴定
细菌基因组DNA的提取用TaKaRa MiniBEST Bacterial Genomic DNA Extraction Kit,方法参见试剂盒说明书。PCR扩增选用引物F27/R1492[15],常规条件扩增[16],扩增产物经TaKaRa Agarose Gel DNA Puri fication Kit回收后,连接于载体pMD18-T Vector,转入感受态细胞E.coli DH5α,挑取白色菌落以M13F/M13R为引物进行菌落PCR鉴定。阳性克隆委托上海英骏生物技术有限公司进行序列测定,将测得的16S rDNA 全序列用EzTaxon server (http://www.eztaxon.org/)进行同源性搜索[17],并用DNAstar软件,将该序列与已报道的芽孢杆菌菌株的16S rDNA全序列进行同源性比较,并建立系统发育树。
2 结果与分析
2.1 烟草内生细菌的平板抑制作用测定
从不同地区、不同生长期和不同器官的烟样中一共分离纯化出127株内生细菌。从中筛选出对烟草黑胫病菌有较强拮抗作用的菌株12个(表1),它们的抑菌带清晰透明,宽度均达到5mm以上(图1)。对病原菌的扩展具有明显的抑制作用,表现在菌落边缘和抑菌带接触部位的菌丝溶解,整个菌落的生长明显受到抑制。培养液滤液抑菌活性测定结果表明(表1),除了cg16、cj22、wy3、wy5对烟草黑胫病菌抑菌活性与对照无显著差异外,其余8个菌株的抑菌活性均达显著水平,其中wy2、wy11、wy4培养滤液的抗菌活性最强(>30%),菌丝在其无菌滤液培养基上生长缓慢,挑取菌丝在光学显微镜下观察发现,黑胫病菌菌丝形态与对照有明显差异,处理后的菌丝形态开始变化,一些菌丝颜色加深,扭曲变形,不规则分支(图2A);部分菌丝变得透明干瘪,中空干枯,且出现部分消融,失去生活能力(图2B);许多菌丝细胞出现膨大空泡呈结节状,凸起变形,细胞膨大部分胞壁破损,原生质外渗(图2C)。对照菌丝则生长旺盛,菌丝密集饱满。将异常菌丝转接到CA培养基培养,以正常黑胫病菌菌丝为对照,异常菌丝几乎不能生长。说明这3株菌在生长代谢过程中产生了具有抑菌活性的次生代谢物质,抗生是其抗菌的重要机制,这尚有待于进一步研究。cg16、cj22、wy3、wy5的培养滤液抑菌活性最小,说明这4株细菌的抗菌机制不是拮抗物质的抑菌作用。

表1 拮抗内生细菌及其发酵滤液对烟草黑胫病菌菌丝生长的抑制效果

图2 培养液滤液对烟草黑胫病菌菌丝形态的影响(10×40)
2.2 拮抗内生细菌对烟草黑胫病的盆栽防治效果测定
选 择 cg24、cj27、cj17、cj20、wy2、wy11、wy4、wy16共8个烟草内生细菌进行温室盆栽防效验,病情调查结果表明(表2),在接种烟草黑胫病菌后第14天,各处理均不同程度地发病,对照大部分萎蔫,表现出烟草黑胫病的典型症状。除菌株cj27外,其它7株内生细菌菌液浇灌处理均显示出一定的防病效果,防治效果为6.5%-51.7%。其中以wy11表现突出,防效为51.7%,明显高于其他菌株。经拮抗细菌wy11处理的烟株,叶色正常,烟株生长发育正常,而对照烟株叶片枯黄,烟株的生长发育受到严重影响。
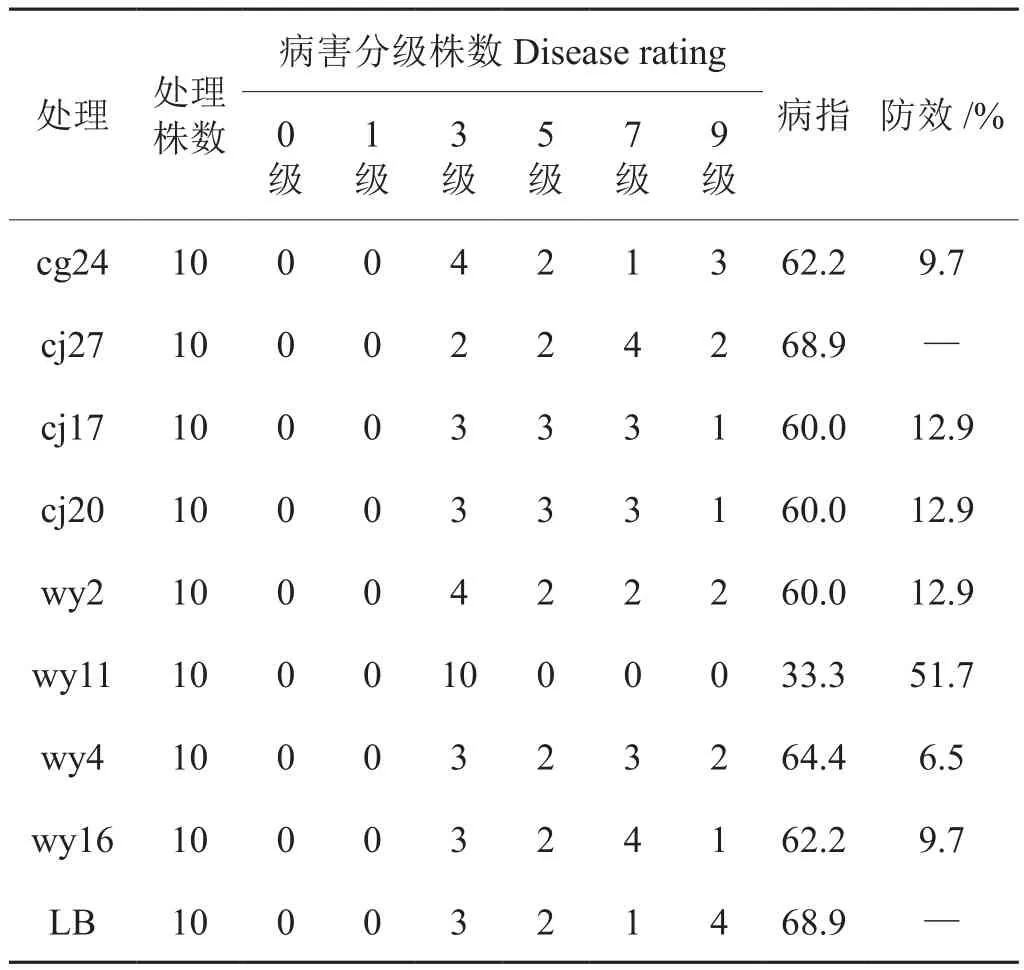
表2 内生细菌对烟草黑胫病温室防治效果
2.3 拮抗细菌培养液灌根对烟株生长的影响
盆栽试验中观察各菌株对烟草植株的生长情况表明(表3),与LB对照相比,8株拮抗内生菌发酵液对烟草植株的生长均有不同程度的影响,其中cj17和wy11对烟株有较好的促生效果。主要表现在对茎围、叶长、叶宽等地上部分生物量的增加。从内生细菌对烟株株高的影响来看,菌株cj17处理与对照达到显著性差异,有明显的促生作用;cj17、wy11、wy4处理的烟株茎围与对照达到显著性差异,能增加烟株的茎围;cj17和wy11处理的烟株叶长和叶宽与对照达到显著性差异,使叶长、叶宽增加;菌株cj17和wy11处理的烟株单叶面积与对照达到显著性差异,增加幅度分别为30.5%和34.6%。可见,cj17和wy11菌株的代谢产物中存在某些能够促进寄主植物生长的物质。证明菌株wy11除了具有一定的防病作用以外,还具有一定的促生作用。

表3 内生细菌发酵液灌根对烟株生长的影响
2.4 菌株wy11的16S rDNA鉴定
测序结果表明菌株wy11的16S rDNA全序列长度为1514bp,将测得的16S rDNA全序列用EzTaxon server (http://www.eztaxon.org/)进行同源性搜索[17],与其同源性最高的菌为解淀粉芽孢杆菌相似性为99%。在Ribosomal Database数据库中选取9株属于Bacillus属的不同种的芽孢杆菌模式菌株构建系统发育树查看属种间的遗传进化关系(图3),从系统发育树看,wy11与B.amyloliquefaciens(AB255669)处于同一分支,说明两者的遗传进化关系最近,因此将菌株wy11鉴定为B. amyloliquefaciens。

图3 菌株wy11的16S rDNA全序列系统发育树
3 结论与讨论
目前的植物病害生防菌绝大多数是从土壤或植物根际土壤中分离筛选得到,但由于这些土壤微生物易受外界条件的影响,在与土壤习居微生物的竞争中不易长期定殖生存并占优势,因而极大的影响了它们的实际防病效果。近年来的研究表明,植物内生菌是很好的生防资源,因为内生菌能够系统的分布于植物组织内部,环境变化对其影响较小,相对于其它生防因子而言更具优势。因此,内生生防菌的筛选与应用成为了近年来植物病害生物防治研究的热点,并取得了很大进展。
针对烟草生产中危害最严重的病害之一烟草黑胫病开展防病内生细菌的筛选,获得了一株有一定防病效果的内生细菌wy11。试验中发现,一些菌株在平板对峙试验中有较好的抑菌活性,但其代谢产物却没有表现出相应的活性,说明其抗菌的机制可能是占据生态位或营养竞争,而不是分泌抗菌活性物质。在研究拮抗内生细菌发酵液灌根对烟株生长的影响试验时,考虑到LB培养基中可能含有一些生长促进因子,进行了LB培养基对照试验。结果发现wy11和cj17对烟株的茎围、最大叶长、叶宽具有一定的促生作用。这与文献报道的植物内生细菌可以产生某些促生物质,并直接促进植物生长的结论一致[18]。
筛选到的拮抗内生细菌虽然在平板对峙培养中表现出明显的拮抗作用,但在对烟草黑胫病的盆栽防治试验中效果却不尽人意,防效最高为51.7%,可能是由于不同菌株在自然土壤环境中对烟株的侵入定殖能力、自身的增殖能力和存活能力不同所致。David[19]认为离体条件下内生菌抑制病原菌的能力与其在活体上抑制病原菌所致病害的能力不存在正相关关系,筛选到的菌株可能无用,而一些有用的菌株也可能因此被丢弃。因此抑菌带的宽度并不代表盆栽防效的大小,室内筛选必须与盆栽防治效果测定相结合。
通过16S rDNA序列比对将防病促生内生细菌wy11鉴定为解淀粉芽孢杆菌。B. amyloliquefaciens是一类重要的生防细菌,是芽孢杆菌属(Bacillus)中研究程度仅次于枯草芽孢杆菌的革兰氏阳性生防菌。可以刺激植物生长和产生次生代谢产物抑制多种植物病原物。而且芽孢杆菌对外界环境的耐受力强,能产生耐热抗逆的芽孢,这有利于生防菌剂的生产、剂型加工及在环境中存活、定殖与繁殖[20]。菌株wy11在烟草防病促生方面具有潜在的应用价值,本试验只完成了前期的研究工作,其防病促生机理,实用发酵条件和大田应用效果等还需进一步研究。
参考文献
[1]Van Breda De Haan. De Bibiziekte in de Delitabak veroorzaakt doorPhytophthora nicotianae.Mded[J]. Slands Plentuim, 1896,15:1-107.
[2]孔凡玉, 朱贤朝, 石金开, 等. 我国烟草侵染性病害发生趋势及防治对策[J]. 中国烟草科学, 1995(1):31-34.
[3]方敦煌, 顾金刚, 李江涛, 等. 烟草黑胫病菌的拮抗根际细菌的筛选[J]. 云南农业大学学报, 2001, 16 : 93-95.
[4]Misaghi I J, Donndelinger C R. Endophytic bacteria in symptom free cotton plants [J]. Phytopathology, 1990,80(9):808-811.
[5]Andrews J H. Biological control in the phyllosphere [J].Annual Review of Phytopathology, 1992, 30:603-635.
[6]杨梅莲, 孙皖朗, 宋未. 植物内生细菌的研究[J]. 微生物学通报, 1998, 25 (4) : 224-227.
[7]刘云霞. 植物内生细菌的研究与应用[J]. 植物保护,1994, 20 (5) : 30-32.
[8]王万能, 肖崇刚, 杨水英, 等. 烟草内生细菌118菌株对烟草抗性相关酶的诱导作用研究[J]. 广西农业科学,2004, 35(3):216-217.
[9]陈博, 朱军, 孙前光, 等. 一株抗香蕉枯萎病内生细菌的分离鉴定及其抗病促生作用[J]. 微生物学通报, 2011,38(2):199-205.
[10]杨友才, 黄晓辉, 龚理, 等. 烟草内生菌对烟草根结线虫病的防治效果[J]. 生态学杂志, 2009, 28(11):2269-2272.
[11]祈之秋, 李兴海, 王英姿, 等. 辣椒根腐病内生拮抗细菌筛选及菌株HJ33-7的鉴定和抗菌活性[J]. 中国生物防治学报, 2011, 27(1):93-98.
[12]方中达. 植病研究方法[M]. 北京: 中国农业出版社,1998.
[13]陈泽斌, 夏振远, 雷丽萍, 等. 烟草可培养内生细菌的分离及多样性分析[J].微生物学通报, 2011, 38(9):1347-1354.
[14]陈泽斌, 夏振远, 雷丽萍, 等. 烟草黑胫病拮抗内生细菌的分离、鉴定及防效测定[J]. 中国烟草学报, 2011,17(6): 21-27.
[15]Devereux R, Hines M E, Stahl D A. S Cycling:Characterization of Natural Communities of Sulfate-Reducing Bacteria by 16S rRNA Sequence Comparisons [J].Microb Ecol, 1996, 32(3):283-292.
[16]Sambrook J. Molecular Cloning[M]. New York: Cold Spring Harbor Laboratory Press, 1989.
[17]Chun J, Lee J H, Jung Y, et al. EzTaxon: a web-based tool for the identi fication of prokaryotes based on 16S ribosomal RNA gene sequences [J]. IJSEM, 2007, 57:2259-2261.
[18]Andrew J H. Biological control in the phyllosphere[J]. Ann Rev Phytopathol,1992, 30:603-635.
[19]刘凤英, 王淼, 孙勇娜, 等. 小麦纹枯病生防活性内生细菌筛选[J]. 安徽农业科学, 2009, 37(7): 3057-3058.
[20]Monica L E, Elizabeth A D J, William E B J, et al. Viability and stability of biological control Agents on cotton and snap bean seeds [J]. Pest Manag Sci,2001, 57:695-706.

