云南省烟草品种脉带花叶病的症状与抗性
刘勇,杨华兵,李梅云,李永平
云南省烟草农业科学研究院/中国烟草育种研究南方中心,玉溪 653100
烟草脉带花叶病毒(Tobacco vein banding mosaic virus,TVBMV)为马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Potyvirus)。病毒粒体为弯曲线状,以蚜虫非持久性传播为主。1964年Chin首次报道了TVBMV在台湾的发生情况[1],受TVBMV侵染的烟草叶片表现花叶、脉带(沿叶脉的带状绿岛)及坏死斑症状[1]。称为脉带花叶病。1989年-1991年我国主产烟省(区)烟草侵染性病害普查中,在福建、广东和山东发现TVBMV,为偶发病害[2]。福建省在1987年-1991年的烟草病害调查中,TVBMV平均检出率为1.38%[3]。1998年张仲凯等报道了TVBMV在云南的发生[4]。因为TVBMV在田间引起和马铃薯Y病毒(Potato virus Y, PVY)相似的症状,云南省烟草生产上常将TVBMV与PVY引起的病害统称为“烟草脉斑病”[5]。因此,TVBMV在我国烟草上的危害在很大程度上被低估[6,7]。
1992年Reddick等首次报道了TVBMV在北美烟草上的发生,在田纳西州采集的70个白肋烟病毒病样品中,发现16%的样品感染TVBMV[8]。1994年Reddick的研究小组和Chang同时分别报道了北美Tennessee分离物[9]和台湾分离物[7]基因组3’-端核苷酸的序列,从分子水平明确TVBMV为马铃薯Y病毒属的一个确定种。2004年-2006年,Tian等[6]在我国的山东、河南、安徽、云南等地检测到12个TVBMV分离物,检出率约占总病毒病样品数的30%。刘勇等在云南省烟草主产区,检测得到20个TVBMV分离物,并通过测定CP和HC-Pro基因序列,了解云南省烟草上TVBMV的遗传多样性。
多年来,病毒病造成的损失居全国烟草侵染性病害的首位。烟草病毒病的种类有20多种,近5年来,云南省烟草主栽品种有云烟85、云烟87、云烟97、K326、红花大金元、TN86、巴斯玛1号等。由于TVBMV寄主范围较广、蚜虫传播效率高、缺少有效的防治药剂,生产上防治困难[1,2]。选育与种植抗病品种是防治病害的经济有效措施。由于TVBMV在烟草上的危害被低估,且未列入我国烟草品种抗性鉴定的病害名单之中,迄今为止未见我国烟草品种对TVBMV抗性评价报道。本文采用人工接种方法研究了我国20个烟草品种的TVBMV症状与抗性。
1 材料与方法
1.1 材料
供试烟草品种共20份(表1),由云南省烟草农业科学研究院(中国烟草育种研究南方中心)提供。包括云南省主栽的烤烟品种、新引进的烤烟品种、香料烟和白肋烟品种。在云南省烟草农业科学研究院研和实验基地的防虫大棚内进行人工接种抗性鉴定。
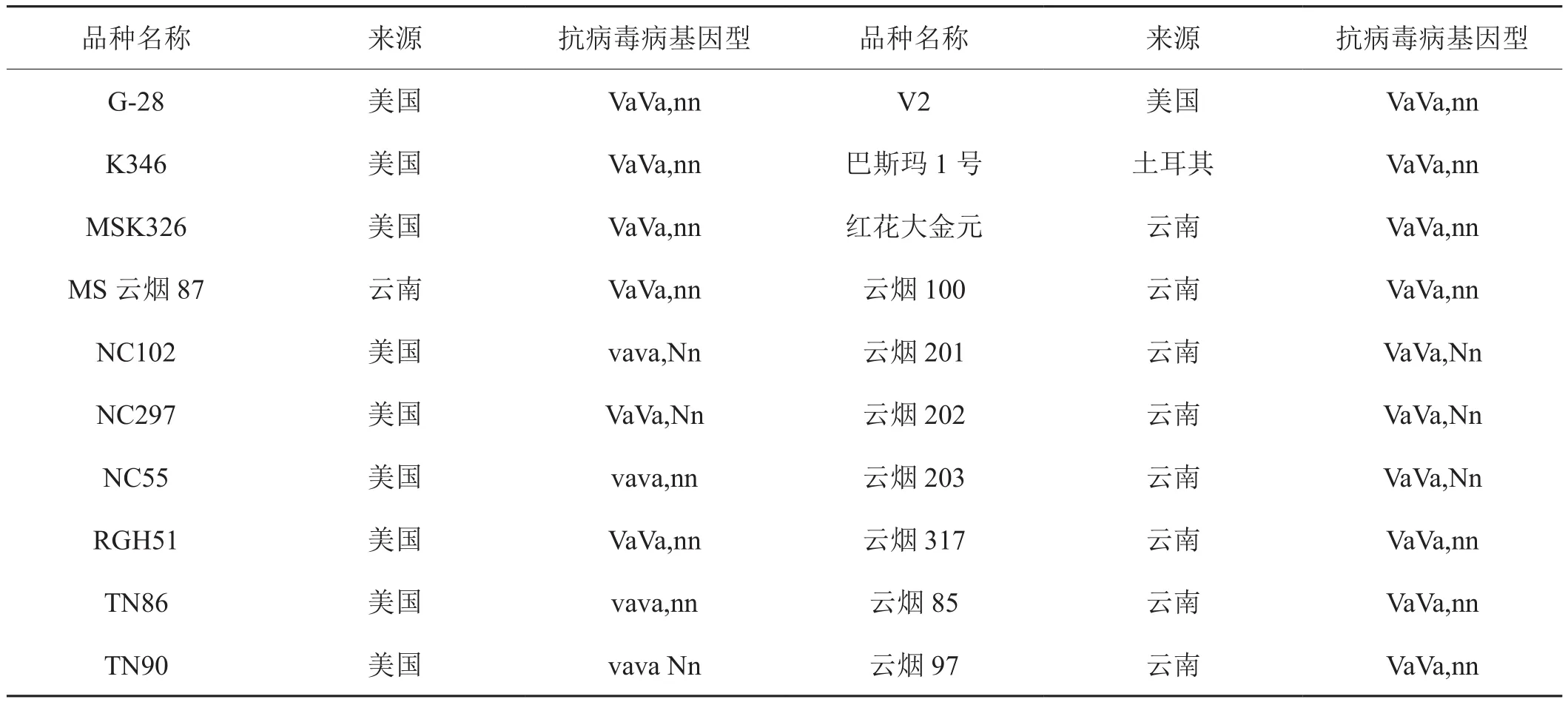
表1 供试烟草品种来源和已知病毒病抗病基因型
1.2 病毒株系
TVBMV病毒分离物YN-3,为云南省烟草农业科学研究院分离保存。在接种前30 d左右在心叶烟(Nicotiana glutinosa)或枯斑三生烟(N.tobacumvar Samsun NN)上繁殖备用。待接种时用免疫检测试纸条检测验证未被其他病毒污染。
1.3 试验方法
塑料防虫大棚内进行,时间为2011年7~9月份。按常规方法漂浮育苗。烤烟品种烟苗5~6片叶时,用直径20 cm一次性塑料花盆移栽。每份材料19株,重复3次。成活后,采用高压喷枪摩擦接种。方法为:采集TVBMV新鲜病叶,在无菌研钵中,用接种缓冲液(0.01 mol/L pH 7.0 磷酸盐缓冲液+0.4% 亚硫酸钠)研磨,双层纱布过滤后,调整接种液的浓度为1∶100(重量体积比)。接种前在病毒汁液中加入1%200目化学纯二氧化硅,高压喷枪喷射压力设定为1kg/cm2。喷口距接种物约20 cm,每株喷射接种时间约为0.5 s。接种后立即用喷壶喷少量井水,提高接种效率。
1.4 病情调查
烟苗接种后,每7 d左右调查发病情况,连续调查3~4次,或调查至最感病品种病情指数达到80左右。病害严重度分级参照国家标准《烟草病虫害分级及调查方法》(GB/T 23222-2008)[15],根据TVBMV症状稍加修改。0级:全株无病;1级:心叶脉明或轻微花叶;3级:上部≤1/3叶片花叶、脉带或坏死线纹;5级:1/3~1/2叶片花叶、脉带或坏死线纹;7级:1/2~2/3叶片花叶,或脉带、坏死线纹;9级:2/3以上叶片花叶,脉带或坏死线纹。逐株调查发病情况。
1.5 数据处理与抗性评价
根据调查数据,分别计算发病率、病情指数。参照国家标准《烟草品种抗病性鉴定》(GB/T 23224-2008)[16],以感病品种发病最先达到感病(病情指数不低于60)的调查数据为依据,进行品种抗病性评价。品种抗病性评价标准如下:高抗(HR):病情指数为0;抗病(R):病情指数为0.1~20;中抗(MR):病情指数为20.1~40;中感(MS): 病情指数为40.1~60;感病(S): 病情指数为60.1~80;高感(HS): 病情指数为80.1~100。
2 结果与分析
2.1 烟草品种接种TVBMV的症状特征
试验期间塑料大棚白天平均气温26℃,夜晚平均气温19℃。高压喷枪摩擦接种TVBMV YN-3分离物新鲜病叶汁液100倍稀释液, MSK326接种后7d表现症状,接种后14d发病率高达87%。TVBMV的症状因品种的病毒病抗病基因型而异。VaVa/nn基因型(感PVY感TMV)品种的心叶及邻近2片幼叶表现脉明或脉带花叶症状(沿叶脉的带状绿岛);其他幼叶表现典型的脉带花叶症状。vava/nn基因型(抗PVY感TMV)品种NC55,TN86和TN90的心叶及邻近2片幼叶无症状,稍大幼叶表现为叶尖部深绿色斑块、叶基部褪绿黄化,脉带症状和花叶症状不明显;其他叶片表现深绿色斑块。推测va基因位点可抑制幼嫩叶片表现TVBMV症状。vava/Nn基因型(双抗PVY和TMV)品种NC102,幼叶还表现点、线状白色坏死,类似蚀纹症状,但坏死线较蚀纹宽。推测该症状是TVBMV与N基因、va基因位点互作的结果。香料烟巴斯玛1号的症状为:心叶及最小2片幼叶无症状,其他叶片表现较轻的斑驳,幼叶叶尖部分深绿色斑块,脉带花叶的症状不明显。总之,从苗期接种至开花,供试烟草品种叶片均未见疱斑、叶片畸形、鼠尾、花叶灼班等TMV和CMV的典型症状,也未见叶脉褐色坏死等PVY坏死株系的典型症状。脉带花叶和深绿色斑块是TVBMV区别于TMV、CMV和PVY坏死株系的典型症状特征。TVBMV的症状相对TMV和PVY较轻,造成的产量损失相对较小。
2.2 烟草品种TVBMV抗性评价
除香料烟巴斯玛1号外,烟草品种对TVBMV的抗性与va位点相关。vava基因型品种接种后7d和14d的发病率和病情指数明显低于VaVa基因型品种(表2)。接种后21d和28d的发病率和病情指数两种基因型之间的差异缩小。表明携带va位点抗PVY的品种,表现低抗TVBMV。VaVa基因型品种的发病快,接种后14d,6个品种的病情指数达到60。其中主栽品种MSK326在接种后14d的病情指数为68.1,在供试品种中处于较高水平。以MSK326作为感病对照,按照国家标准《烟草品种抗病性鉴定》评价,供试品种对TVBMV的抗性为:巴斯玛1号、TN86-8、NC55和TN90为中抗; NC102、MS云烟87、云烟85、NC297、云烟201、红花大金元、云烟97、云烟203和云烟317为中感;V2、云烟202、云烟100、G-28、MSK326、K346和RGH51为感病。接种后21d和接种后28d调查,供试品种的病情指数都达到70以上,表明供试品种对TVBMV表现为耐病或感病。香料烟巴斯玛1号由于生长比烤烟迅速,接种时的叶片数较多,根据病害分级调查的病级相对较低,病情指数相对较低。
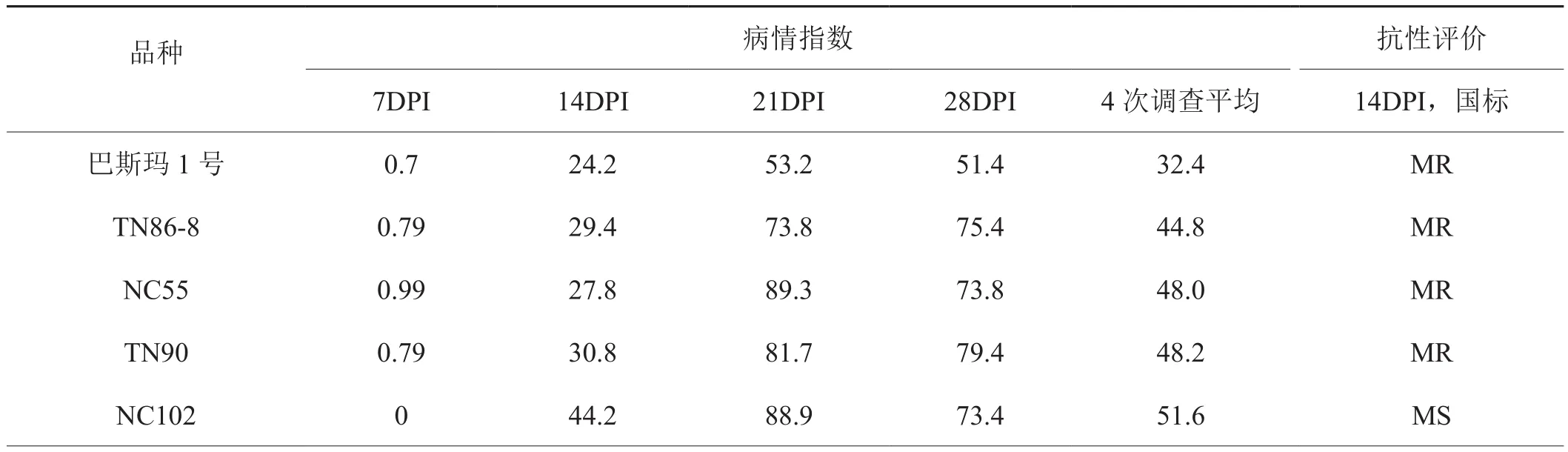
表2 烟草品种TVBMV抗性评价
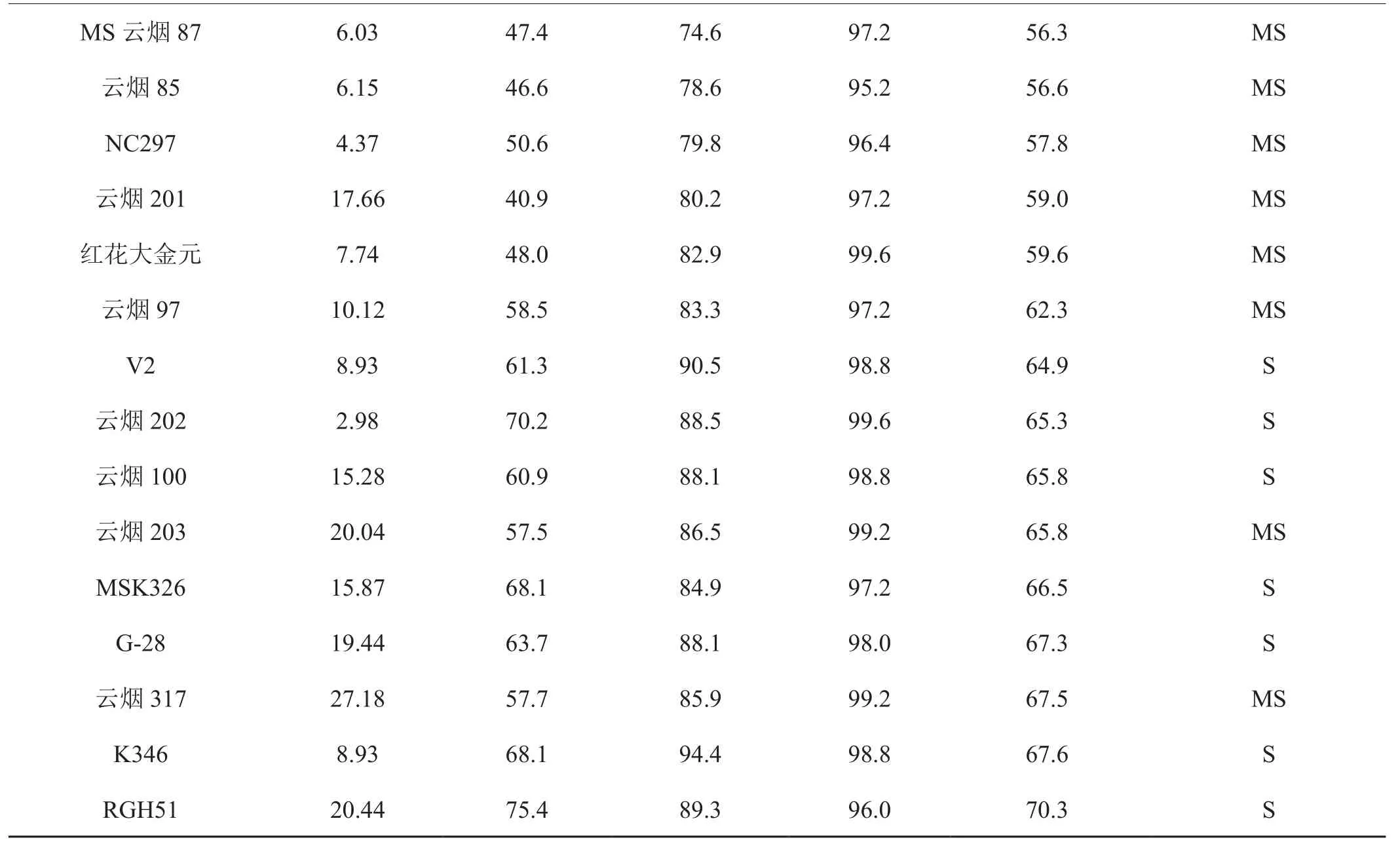
续表2
3 结论与讨论
本研究在防虫塑料大棚内,通过高压喷枪接种烟苗,观察了烟草品种的TVBMV的症状。TVBMV的症状因品种的基因型va位点与N基因而异。常见的VaVa/nn基因型(感PVY感TMV)品种表现为:心叶及邻近2片幼叶脉明或脉带花叶;其他幼叶表现典型的脉带花叶。vava/nn基因型(抗PVY感TMV)品种表现为心叶及邻近2片幼叶无症状,稍大幼叶表现为叶尖部深绿色斑块、叶基部褪绿黄化,脉带症状和花叶症状不明显;其他叶片表现深绿色斑块。va基因位点可抑制幼嫩叶片表现TVBMV症状。
TVBMV 田间样品(室内检测TVBMV阳性、TMV/CMV/PVY/TEV阴性的样品)症状(云烟85品种)为:脉带花叶;叶尖部深绿色、叶基部细小坏死点线。YN-3分离物在大棚中接种未见叶基部细小坏死点线症状。田间症状与本文接种症状的差异可能由温度等环境条件引起。TVBMV在烟株现蕾后明显隐症,一直到开花期,未见明显的叶片畸形和坏死,造成的产量损失比TMV和PVY小。本文观察的症状是一个株系(YN-3)在大棚内人工接种的结果。
根据接种后每隔7d调查一次,连续4次调查的平均病情指数,vava基因型品种低抗TVBMV,VaVa基因型品种都不抗TVBMV。TVBMV和PVY同属,推测va位点低抗TVBMV的机理类似于va位点抗PVY。品种间的抗性在接种后14d内差异明显,而接种后21d品种间的抗性差异缩小。表明va位点只能减缓TVBMV的症状发展。
国内未见烟草品种对TVBMV抗性评价的文献报道。本文尝试采用国家标准[16]评价烟草品种的抗性。以接种后发病快的主栽品种K326为感病对照,以K326首次达到感病(病情指数达到60.1)时调查的病情指数对19个烟草品种进行了抗性评价。结果表明,vava基因型的品种TN86等中抗TVBMV,VaVa基因型品种云烟85等中感或感病。但随后间隔7d和14d调查供试品种的病情指数都达到70以上,表明供试品种对TVBMV表现为耐病或感病,缺乏持久的抗性。国家标准0~9级病级划分[15]和6档抗性[16]划分,有利于品种抗性的精细评价,但同时存在抗性评价结果年度间容易波动的问题。有必要研究综合病情发展的指标来评价烟草品种抗性。
[1]Chin W T. A survey of Tobacco mosaic viruses in central Taiwan [J]. J Agric Ass China,1966, 55: 85-88.
[2]陈瑞泰,朱贤朝,王智发,等.全国16个主产烟省(区)烟草侵染性病害调研报告[J].中国烟草科学,1997(4):1-7.
[3]谢联辉,林奇英,谢莉妍.福建烟草病毒种群及其发生频率的研究[J].中国烟草学报,1994,2(1):25-31.
[4]张仲凯,方琦,吴自强,等.云南主要茄科作物病毒种类及其分布[J].云南大学学报,1998,20(2):128-131.
[5]张仲凯,李毅.云南植物病毒.北京:科学出版社,2001.
[6]Tian Y P, Liu J L, Yu X Q, et al. Molecular diversity of tobacco vein banding mosaic virus [J]. Archives of Virology, 152: 1911-1915.
[7]Chang B Y, Huang C R, Yeh S D, et al. Nucleotide sequence of the coat protein coding region of the potyvirus tobacco vein-banding mosaic virus[J].Archives of Virology,1994,138:17-25.
[8]Reddick B B, Collins-Shepard M H, Christie R G, et al. A new virus disease in North America caused by tobacco veinbanding mosaic virus [J].Plant Disease, 1992, 76: 856-859.
[9]Habera L F, Berger P H, Reddick B B. Molecular evidence from 3’-terminus sequence analysis that tobacco veinbanding mosaic virus is a distinct member of the potyvirus group [J].Archives of Virology.1994,138(1-2): 27-38.
[10]陈炯,陈剑平. Potyvirus属成员基因组全序列的简并引物PCR和RACE扩增方法[J].病毒学报,2002,18(4):371-374.
[11]于晓庆.马铃薯X病毒和烟草脉带花叶病毒的分子变异与协生作用[D].山东农业大学博士学位论文,2008.6.
[12]王红艳.芜菁花叶病毒与烟草脉带花叶病毒全基因组序列测定及分析[D].山东农业大学硕士学位论文,2008.6.
[13]Yu X Q, Lan Y F, Wang H Y, et al. The complete genomic sequence of Tobacco vein banding mosaic virus and its similarities with other potyviruses [J].Virus Genes,2007,35:801-806.
[14]Wang H Y, Zhu T S, Cui T T, et al. Complete genome sequence of a tobacco isolate of the tobacco vein banding mosaic virus strain prevailing in China[J]. Archives of Virology, 2010, 155(2): 293-295.
[15]中国烟草总公司青州烟草研究所. GB/T 23222-2008,烟草病虫害分级及调查方法.北京:中国标准出版社,2009:1-6.
[16]中国烟草总公司青州烟草研究所. GB/T 23224-2008, 烟草品种抗病性鉴定. 北京:中国标准出版社,2009:1-5.

