稀有人参皂苷compound K转化菌株的筛选及转化条件优化
赵雪淞,孟 月,陈星星
(1.辽宁工程技术大学矿业学院,辽宁阜新123000; 2.东北师范大学生命科学学院,吉林长春130024)
人参皂苷compound K(C-K)属于原人参二醇型皂苷,在人参花和果中存在,但含量甚微[1];在人体肠道内,肠道细菌可将其他的原人参二醇型皂苷降解为人参皂苷C-K[2]。近年来的研究发现,稀有人参皂苷C-K具有抗肿瘤、抗突变、抗衰老、防过敏、抗炎保肝、抗糖尿病等广泛的生物活性,具有显著的药用价值[3-8]。因此,如何获得大量的稀有人参皂苷C-K成为现代药学研究的重点。在结构上,稀有人参皂苷C-K与人参中含量较多的原人参二醇型皂苷如Rb1、Rb2、Rc等相比,仅仅是在糖基侧链上有所不同(图1)。因此,可以通过对高含量的人参皂苷进行结构改造的方法来制备稀有人参皂苷C-K。人参皂苷结构改造的方法主要有化学法和生物转化法。化学法虽然操作上较简单,但是专一性差、副产物多,且转化效率低。与化学法相比,生物转化法具有反应条件温和、专一性强、得率高等优点,是目前获得稀有人参皂苷的最有效途径[9]。近年来,生物转化法制备稀有人参皂苷C-K取得了一些进展[10-14]。但是,筛选出成本低、专一性高的优良菌种或菌株仍然是制备稀有人参皂苷C-K的关键因素。许多植物病原真菌可以分泌糖苷水解酶,用于水解寄主的细胞壁或者寄主产生的糖苷类物质,并且,植物病原真菌具有繁殖快、易于培养等优点,是筛选转化菌株的良好来源。本文从22种植物病原真菌中筛选出一种可以高效转化人参皂苷Rb1为稀有人参皂苷C-K的真菌,并优化了转化条件。研究结果为人参皂苷C-K的工业制备奠定了一定的基础。
1 材料与方法
1.1 材料与仪器
22种植物病原真菌 采自长春市郊茄科植物病原组织;V8汁培养基(1L培养基含有200mL V8汁、2g CaCO3和15g琼脂)、4℃暗保存;人参皂苷标准品Rb1、Rb2、Rc、Rd和C-K 成都曼斯特生物技术有限公司;人参皂苷混合物及人参皂苷单体 本实验室制备并采用HPLC(与标准品比较)和13C-NMR鉴定。具体制备方法如下:五年生人参干燥根(吉林抚松产)水煮法提取人参总皂苷,醇沉除去大部分人参多糖杂质,上清经大孔吸附树脂和硅胶柱层析分离得到二醇型和三醇型人参皂苷混合物,混合物再经HPLC分离纯化得到人参皂苷单体。人参皂苷单体的纯度均达到95%以上。葡萄糖、氯仿、甲醇、乙醇、正丁醇等化学试剂 北京化工厂;琼脂 上海生物技术有限公司;硅胶G薄层层析板(0.25~0.3mm) 青岛海洋化工厂。

图1 原人参二醇型皂苷的化学结构Fig.1 The chemical structure of protopanaxadiol type saponins
BCN-136OB型超净工作台 北京东联哈尔仪器制造有限公司;DHG-9075A型电热恒温培养箱 上海一恒仪器有限公司;Z-36HK型低温高速离心机 德国Hermle公司;YXQ-LG型全自动立式压力蒸汽灭菌器 上海博讯实业有限公司;恒温空气浴震荡器 哈尔滨市东明医疗仪器厂;IX71倒置荧光显微镜 日本Olympus公司;VORTEX-5型旋涡混合器 海门市其林贝尔仪器制造有限公司;752型紫外可见分光光度计 上海光谱仪器有限公司。
1.2 分析方法
TLC分析采用 G60硅胶板,展开剂:CHCl3-MeOH-H2O(65∶35∶10或70∶30∶10,v/v/v,下层)。显色剂:5%硫酸乙醇,105℃加热5min。展开方式:上行展开。
1.3 人参皂苷的生物转化
供试菌种置于V8汁液体培养基中震荡培养,130r/min、28℃,培养8d后,纱布过滤和离心,8000×g、4℃、离心20min,弃去上清,得到孢子。将孢子悬浮在20mmol/L醋酸-醋酸钠缓冲液(pH5.0)中,在130r/min、28℃条件下震荡培养24h,然后加入人参皂苷储备液(人参皂苷样品溶于pH5.0 20mmol/L醋酸-醋酸钠缓冲液中并通过0.2μm的滤膜过滤除菌),使孢子的终浓度为5×106个/mL,底物的终浓度为0.25mg/mL,继续震荡培养0~10d。从加入人参皂苷的0h开始取样,每隔24h取样一次,加入等体积的正丁醇萃取,上层正丁醇相减压蒸干,重新溶于40%乙腈水溶液中,TLC检测转化结果。
1.4 植物病原真菌的形态学鉴定
将菌种活化后接入PDA固体培养基,用划“Z”线的方法接种。然后将灭过菌的盖玻片以45度角垂直于Z线插入,28℃培养,观察菌落形态;然后小心取下盖玻片,制作临时装片,在显微镜下观察真菌菌丝和孢子的特征。
2 结果与讨论
2.1 转化菌株的筛选
因为分离纯化得到人参皂苷单体的成本较高,此步实验采用原人参二醇型皂苷Rb1、Rb2、Rc和少量Rd的混合物为底物,从22种植物病原真菌中筛选稀有人参皂苷C-K的转化菌株。结果表明,22种植物病原真菌中有6种真菌能将底物转化到C-K (图2)。从TLC图谱上可以看出,1.91和1.26号真菌转化速率相对较快,在15d时,底物几乎完全转化,而用1.91号真菌转化,C-K的产率最高,中间产物的产量最低。根据上述结果,选择1.91号真菌作为稀有人参皂苷C-K的转化菌株,对其做进一步研究。

图2 TLC分析6种真菌对原人参二醇型皂苷混合物的转化Fig.2 TLC analysis of the biotransformation of the mixture of protopanaxadiol type saponins by 6 fungi
2.2 1.91号植物病原真菌的形态学鉴定
用PDA培养基培养1.91号真菌,菌落为圆形,颜色初为白色,之后转为浅绿色,最后转为墨绿色接近黑色;培养基反面成黑色;菌落扁平,无渗出液。显微镜下观察(图3),菌丝呈树枝状,透明,有隔,分生孢子串生于孢子梗顶端,无色,无隔膜,两端平切,未发现明显的子囊果。根据上述菌落、菌丝及孢子的形态特征,查阅真菌鉴定手册[15],初步鉴定1.91号真菌属于半知菌类丛梗孢目丛梗孢科卵形孢霉属(Oospora Wallr.)。
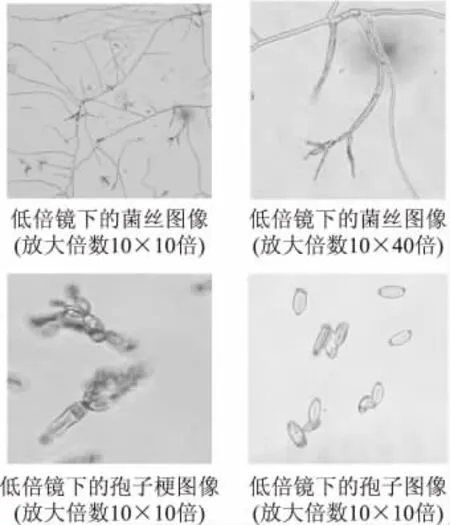
图3 1.91号菌株的菌丝和孢子形态Fig.3 The shapes of colony(A) and hyphae(B)of strain sp.1.91
2.3 1.91号真菌转化原人参二醇型皂苷的转化途径
在上述的筛菌实验中,由于底物较复杂,产物较多,从TLC图谱上,只能初步判断转化产物,不能确定具体的转化途径,因此采用原人参二醇型人参皂苷单体Rb1和Rb2进一步研究卵形孢霉对人参皂苷的转化途径。
2.3.1 1.91号真菌对人参皂苷Rb1的转化 1.91号真菌对人参皂苷单体Rb1的转化结果如图4所示。通过TLC图可以看出,1.91号真菌对Rb1单体的转化非常迅速,在0h(此处所指的0h并非绝对0h,它包含取样和正丁醇萃取的时间)已经发生转化,生成产物1;1d的时候底物Rb1和产物1完全消失,生成大量的产物2和少量产物3;8d时只剩产物3。通过对比产物与标准品的Rf值,可知:产物1为人参皂苷Rd,产物2为人参皂苷F2,产物3为人参皂苷C-K。由此可以确定1.91号真菌转化人参皂苷Rb1的途径为:Rb1→Rd→F2→C-K。

图4 TLC分析1.91号菌株对人参皂苷Rb1的转化Fig.4 TLC Analysis of the biotransformation of ginsensodies Rb1by strain sp.1.91
2.3.2 1.91号真菌对人参皂苷Rb2的转化 1.91号真菌对人参皂苷Rb2的转化结果见图5。从TLC图中可以看出:5d的时候底物Rb2被完全转化,生成产物1和少量的产物2;随着时间的延长,产物2的量逐渐增加,直到第10d,没有产物C-K出现。产物1的Rf值略高于标样Rd,产物2的Rf值略高于标样F2,据此推测,产物1可能为人参皂苷C-O,产物2可能为人参皂苷C-Y,1.91号真菌转化人参皂苷Rb2的途径可能为Rb2→C-O→C-Y,没有C-K生成。原人参二醇型皂苷Rb1、Rb2和Rc具有共同的苷元(原人参二醇)和C-3位的糖链(Glc β-(1,2)-Glc),不同之处在于C-20位的糖链。Rb1的C-20位是二个葡萄糖以β(1→6)糖苷键相连接,Rb2的C-20位是一个吡喃型阿拉伯糖和一个葡萄糖以α(1→6)糖苷键相连接,Rc的C-20位是一个呋喃型阿拉伯糖和一个葡萄糖以α-(1→6)糖苷键相连接(图1)。因此,上述研究结果说明,1.91号真菌分泌的糖苷酶是一种葡萄糖苷酶,对葡萄糖苷键具有特异性,不水解阿拉伯糖苷键,所以Rb2转化产物中没有C-K生成。据此推测,1.91号真菌对人参皂苷Rc的转化也不会有大量C-K生成,稀有人参皂苷C-K主要由人参皂苷Rb1转化而来。为了更好地应用1.91号真菌转化人参皂苷Rb1来制备稀有人参皂苷C-K,我们进一步以人参皂苷Rb1为底物,优化1.91号真菌转化人参皂苷Rb1的转化条件。

图5 TLC分析1.91号菌株对人参皂苷Rb2的转化Fig.5 TLC Analysis of the biotransformation of ginsensodies Rb2by strain sp.1.91
2.4 1.91号真菌转化人参皂苷Rb1的条件优化
2.4.1 底物添加时间对转化的影响 卵形孢霉的孢子在28℃、130r/min条件下预培养12、24、48、72h后分别加入Rb1溶液,继续震荡培养6d,转化结果如图6。从TLC图中可以看出:孢子预培养12h后转化Rb16d,产物完全是C-K,效率最高;而孢子预培养24、48、72h后转化Rb16d,仍有一定量的F2存在。因此,孢子预培养12h是最佳的底物添加时间。
2.4.2 pH对转化的影响 在pH2.0-8.0的缓冲液中,用1.91号真菌转化人参皂苷Rb1,培养时间为4d,结果如图7。从TLC图中可以看出:在pH5.0~6.0的缓冲液中,转化效率最高,底物全部转化,生成唯一终产物C-K。所以,1.91号真菌转化人参皂苷Rb1的最适pH是pH5.0~6.0。
2.4.3 温度对转化的影响 在28、37、45、55℃的温度下,用1.91号真菌对人参皂苷Rb1进行转化,结果如8所示。从TLC图可以看出,转化4d时,45℃条件下,Rb1的转化产物几乎完全是C-K,而28、37、55℃条件下,产物为F2和C-K;转化10d时,在28、37、55℃的转化条件下,转化产物仍是F2和C-K,没有完全转化成终产物C-K。所以,卵形孢霉转化人参皂苷Rb1的最适温度为45℃。

图6 底物添加时间对1.91号菌株转化人参皂苷Rb1的影响Fig.6 Effect of the time of substrate addition on biotransformation of ginsensodies Rb1by strain sp.1.91

图7 pH对1.91号真菌转化人参皂苷Rb1的影响Fig.7 Effect of pH on biotransformation of ginsensodies Rb1by strain sp.1.91

图8 温度对1.91号菌株转化人参皂苷Rb1的影响Fig.8 Effect of temperature on biotransformation of ginsensodies Rb1by strain sp.1.91
3 结论
以原人参二醇型皂苷混合物为底物筛选22种植物病原真菌,结果有6种真菌能够转化底物为稀有人参皂苷C-K,其中1.91号真菌的转化效率最高。通过初步形态学鉴定,该真菌属于半知菌类丛梗孢目丛梗孢科卵形孢霉属(Oospora Wallr.)真菌。1.91号真菌转化人参皂苷Rb1的途径为:Rb1→Rd→F2→C-K;转化人参皂苷Rb2的途径为:Rb2→C-O→C-Y。这一结果说明,1.91号真菌分泌的糖苷酶是一种葡萄糖苷酶,对葡萄糖苷键具有特异性,所以稀有人参皂苷C-K主要由人参皂苷Rb1转化而来。1.91号真菌转化人参皂苷Rb1为C-K的最佳条件为:最佳底物添加时间是孢子预培养12h后;转化最适pH是pH5.0-6.0;转化最适温度是45℃。本文为人参皂苷C-K的工业化生产奠定了一定的基础。
[1]张伟云,陈全成,郑毅男,等.RP-HPLC测定人参各部位人参皂苷compound K的含量[J].药物分析杂志,2007,27: 1-3.
[2]Bae EA,Kim NY,Han MJ,et al.Transformation of ginsenosides to compound K(1H-901)by lactic acid bacteria of human intestine[J].J Microbiol Biotechn,2003,13(1):9-14.
[3]Suda K,Murakami K.Induction of apoptosis in Lewis lung carcinoma cells by an intestinal bacterial metabolite produced from orally administered ginseng protopanaxadiol saponins[J].J Trad Med,2000,17:236-244.
[4]Kim S,Kang BY,Cho SY,et al.Compound K induces expression of hyaluronan synthase 2 gene in transformed human keratin℃ytes and increases hyaluronan in hairless mouse skin[J].Bi℃hem Biophys Res Commun,2004,316:348-355.
[5]Park EK,Shin YW,Lee HU,et al.Inhibitory effect of ginsenoside Rbland compound K on NO and prostaglandin E2 biosyntheses of RAW264.7 cells induced by lipopolysaccharide[J].Biol Pharm Bull,2005,28(4):652-656.
[6]Shin YW,Bae EA,Kim SS,et al.Effect of ginsenoside Rbland compound K in chronic oxazolone-induced mouse dermatitis[J]. Int Immunopharmacol,2005,5:1183-1191.
[7]李伟.人参皂苷Compound K对2型糖尿病的降血糖作用及肝糖异生信号转导通路调控[D].长春:吉林大学,2012.
[8]Lee HU,Bae EA,Han MJ,et al.Hepatoprotective effect of ginsenoside Rbland compound K on tert-butyl hydroperoxideinduced liver injury[J].Liver Int,2005,25:1069-1073.
[9]李学,臧埔,张连学,等.微生物转化法制备人参皂苷Compound K的研究进展[J].食品科学,2012,33(11): 323-327.
[10]杨元超,王英平,闫梅霞,等.人参皂苷compound K转化菌株的筛选[J].中国中药杂志,2011,36(12):1596-1598.
[11]宋成程,赵雪淞,杜秀丽,等.毁灭柱孢菌中一种人参皂苷Rb1水解酶的纯化及酶学性质研究[J].微生物学杂志,2011,31(5):20-26。
[12]Yan Q,Zhou W,Shi XL,et al.Biotransformation pathways of ginsenoside Rb1to compound K by β-glucosidases in fungus Paecilomyces Bainier sp.229[J].Process Biochem,2010,45: 1550-1556.
[13]Noh KH,Son JW,Kim HJ,et al.Ginsenoside Compound K production from ginseng root extract by a thermostable β-glycosidase from Sulfolobus solfataricus[J].Biosci Biotechnol Biochem,2009,73:316-321.
[14]Juan Gao,Wenjing Xu,Qiang Fang,et al.Efficient biotransformation for preparation ofpharmaceutically active ginsenoside Compound K by Penicillium oxalicum sp.68[J].Ann Microbiol,2012,4,DOI 10.1007/s13213-012-0454-3.
[15]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:129-135.

