植物V-H+-ATP酶适应逆境的分子调控机理
张玉红,安志刚
(东北林业大学森林植物生态学教育部重点实验室,黑龙江 哈尔滨 150040)
H+-ATPase广泛存在于几乎所有的细胞中。现已知生物膜H+-ATPase有三大类:P型H+-ATPase、F型H+-ATPase和V型H+-ATPase。其中,V型H+-ATPase结构复杂,功能多样,种类丰富,已成为H+-ATPase研究的新热点[1]。V型H+-ATPase在植物细胞内离子平衡的调节中具有关键作用,能把质子从胞浆中泵入液泡内使之酸化,产生质子电化学梯度,因此,该酶可为其他各种离子及代谢产物的次级转运提供动力。
V-H+-ATP酶对细胞膜内环境的稳定起着重要作用。然而,对ATP结合膜蛋白所形成的聚合体的研究和认识在基因学上还刚刚起步,例如:底物的结合机制、对膜内外环境稳定的制约功能以及对不同胁迫强度的基本应答等,但对它的一些基本特质以及调控功能已经有了初步的认识。目前,对部分植物V-H+-ATP酶不同亚基基因克隆的实现提供了对其潜在功能和特质的新的认识和研究基础[2-3]。本研究着重论述V-H+-ATP酶在胁迫应答方面的一些基本分子调控机制,以期了解植物细胞抵抗不良环境的内在应答机制并分析利用分子生物学技术手段增强植物抗胁迫能力的可能性。
1 V-H+-ATP酶的结构、分布与酶动力学
V-H+-ATP酶是一个至少由11个不同亚基构成聚合体,分别组成镶入膜内部分和膜外游离的头部,前者是与H+转运相关的亚基,后者是与ATP的结合及水解相关联的亚基(图1)。V-H+-ATP酶的分子量通常都大于700 kDa。在这11个亚基中,仅有3个亚基在整个聚合体中占有固定位置,即A、B、c亚基,交替排列的A和B亚基各自3个拷贝形成游离的头部,6个c亚基(或更多)拷贝围成圈状根植于膜内[4-5],上述模型的建立是基于对烟草(Nicotianatabacum)和酵母等V-H+-ATP酶多年研究[6-9]的结果。除了A、B、c亚基外,V-H+-ATP酶的其他亚基在外界条件发生变化时在结构和数量上会有改变,一般是出现新的亚基。免疫和生化研究表明,V-H+-ATP酶并不完全限制在液胞膜上,在内质网、前液胞、细胞膜和其他类囊体分泌系统中均有发现,但在这些膜上的分布及功能处于推测和验证阶段[10-11]。
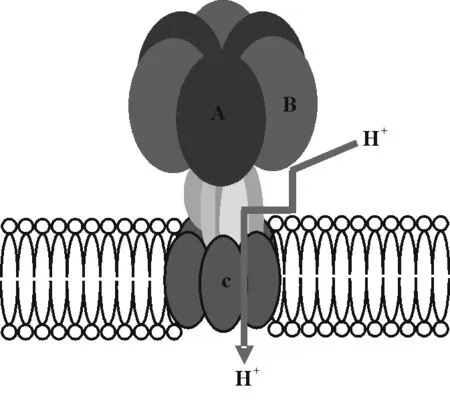
图1 V-H+-ATP酶模型[6-9]Fig.1 Model of V-H+-ATPase[6-9]
在植物细胞内,液胞是细胞有毒物质的堆积器官,酚类、酸类、有毒金属和一系列氮化物被隔离至此处以避免对细胞原生质的伤害。植物液胞膜上具备转运蛋白,承担一系列物质(如新陈代谢产物)的转运,而这些物质转运系统的能量是由V-H+-ATP酶转移H+所形成的膜内外电化学梯度供给的。V-H+-ATP酶利用ATP水解产生的能量向膜内转运H+,建立跨膜H+电化学势(Proton Motive Force,PMF),这种电化学势对物质吸收和减少导致的细胞质内各种酶有害离子的积累提供核心动力源。V-H+-ATP酶将H+逆电化学势梯度泵进液胞内,形成跨膜的H+动力势(即电化学势外负内正),在H+动力势的作用下通过相应载体或离子通道进行物质的跨膜运输[12]。V-H+-ATP酶与其它载体和离子通道的关系除V-H+-ATP酶将H+泵进液泡内直接消耗ATP产生的能量外,其它物质的跨膜转运都依赖于这种H+向液泡内转运形成的电化学势(图2)。

图2 植物液胞的简单模式图[12]Fig.2 Simple schema graph of plant vacuole [12]
V-H+-ATP酶与F-ATP合成酶是两个相关的酶,它们被认为是来自于同源进化的产物[13]。F-ATP合成酶常被作为一种参照酶与V-H+-ATP酶进行对比分析,虽然二者在结构、活性调控和抑制特性方面有不同,但在分子结构上却很相似。F-ATP合成酶的工作模型是由V0传递H+到V1进行ATP的合成,该模型像一个转子镶嵌到一个定子上,其转子部分由每个带有3个拷贝的β和α亚基构成,每次催化合成过程伴随着转子的120°旋转,3次旋转回到原位。V-H+-ATP酶在水解ATP的过程中是由连续旋转360°的A亚基完成,每次泵入H+与ATP的消耗比值在1.7~3.3范围内。V-H+-ATP酶主要行使H+转运通道的为16 kDa 的c亚基有至少6个拷贝,依次围成圈状镶嵌于膜内[13]。
2 V-H+-ATP酶在植物逆境胁迫中的重要功能
V-H+-ATP酶的基本功能以及在植物生长、发育和对外环境的适应过程中的重要作用已得到预见和证明,其中,在盐胁迫过程中V-H+-ATP酶的应答功能研究较多[14-17]。
2.1盐胁迫 盐是植物生长和产量的主要限制因素之一。在盐胁迫条件下,Na+主要趋于在老叶片内积累,然后依次是新生长的叶内、主根和次生根。有效地排出细胞质内的Na+到细胞外或液泡内是植物适应过量NaCl的主要机制,而向液泡内转运Na+的能量源自于V-H+-ATP酶建立的跨膜电化学梯度(ΔΨ),是经过位于液胞膜中Na+/H+的逆向转运通道来完成[14]。对V-H+-ATP酶活性调节的研究是基于对一些耐盐植物在盐胁迫过程中转录和翻译ATP酶亚基的基本应答关系。研究[15-18]表明,上述植物的ATP酶活性在一定范围内随着胁迫强度的增加而提高。V-H+-ATP酶c亚基在盐胁迫条件下,在生长6周的耐盐植物的叶和根部表现出大量mRNA的表达,但与A和B亚基的表达不一致,说明V-H+-ATP酶中各个亚基的表达过程在盐胁迫初期并非是同步完成的[15];相反,在嫩叶中其同步性则要高得多;在相对长期盐胁迫的耐盐植物叶片中观察到各亚基的转录趋于同步[17]。根据上述结果推测,耐盐植物V-H+-ATP酶各亚基表达的不同步性可能是各亚基的更新转换率不同或转录信息渠道不一致导致的。但相比较于非耐盐植物,耐盐植物V-H+-ATP酶各亚基的转录还是相对同步的。原位杂交和组织学研究表明,耐盐植物V-H+-ATP酶对盐胁迫的应答在不同的叶片和组织中其亚基的转录表现各异,这种组织细胞的特异性可能反映了各种细胞对盐胁迫的应答和离子转移的系统特异性。V-H+-ATP酶中A亚基的高水平转录和其他亚基转录的不一致性在经盐胁迫后的烟草悬浮细胞内也可以观察到,而耐盐植物甜菜(Betavulgaris)在盐胁迫条件下,其V-H+-ATP酶的A和c亚基表现出同步性[15]。耐盐植物V-H+-ATP酶的表达表现出与盐胁迫的相关性,如甜菜悬浮细胞V-H+-ATP酶A和c亚基的启动子活性在盐胁迫过程中大大提高[19];而许多非盐地生长的植物并不能表现出V-H+-ATP酶活性与盐的相关性,如西红柿(Lycopersiconesculentum)V-H+-ATP酶A亚基的表达水平在盐胁迫条件下只是瞬间发生,此后则表现出非应答状态[20]且这种现象同样可以在拟南芥(Arabidopsisthaliana)[21]等植物中观察到。但是,有些耐盐植物在幼苗期是非抗盐性的,其V-H+-ATP酶各亚基的表达不受盐胁迫的影响,这也可能影响结论。遗憾的是,目前的许多研究多注重于对V-H+-ATP酶的转录和表达而忽略了对其活性的分析。在NaCl胁迫条件下,耐盐植物的V-H+-ATP酶活性、数量和质子转运能力都有大幅度的提高[20-22],有些耐盐植物如碱蓬(Suaedasalsa),其V-H+-ATP酶活性和数量由Ca2+浓度决定,在一定的Ca2+浓度范围内与之呈正相关[23-24]。因为细胞本身需要增加高渗物质的含量,消耗ATP能量,相对的营养生长显得缓慢,细胞壁增厚,气体交换时间缩短等,这一系列生理过程形成的组织结构和细胞膜的特异性在胁迫减缓时并不能逆向发展。这就是耐盐植物在独特环境中的适应性进化。所以,当耐盐基因(指在盐胁迫过程中在植物中大量表达的基因)转入非耐盐植物时,并不能使非耐盐植物在组织细胞和结构形态上与耐盐植物一致,其结果是导致生命组织系统的不协调性。
2.2干旱胁迫 对于V-H+-ATP酶在干旱条件下的功能研究到目前为止还很少。因为液胞对于维持细胞膨压、保证细胞内的离子和代谢产物的浓度起着至关重要的作用,所以对水分胁迫与V-H+-ATP酶活性的变化需要进行细致的研究。旱生植物的叶片为了应对环境,除了在夜间进行呼吸外,其相适应的结构变化最为明显,如形成具有发达储水组织的肉质化叶片等。这种储水组织通常由大型的细胞组成,其中含有大液泡,渗透压较高。植物对干旱的应答表现在两个方面:1)V-H+-ATP酶的活性在气孔开张期明显降低,以减少能量消耗;2)低pH值保持高渗物质,以维持足够的膨压。可以看出,V-H+-ATP酶活性的应答变化直接与干旱植物所处环境相适应。另外一些研究表明,当西红柿处于缺水条件下,V-H+-ATP酶A亚基mRNA没有明显的表达而在补充ABA条件下其活性有所提高,同样的现象在长春花(Catharanthusroseus)细胞中也观察得到[25-27]。显然,V-H+-ATP酶活性的应答与外源激素也有关。
2.3重金属胁迫 虽然一系列植物细胞排毒机制与植物螯合素和金属硫蛋白的存在有关,但有害物质的转运与膜相关[28-29]。植物对金属的耐性和敏感性与植物种密切相关,并且与膜的性质有关,这包括液胞膜及膜中的转运通道等。因此,有理由认为在重金属存在的条件下,V-H+-ATP酶活性和质子转运会有相应的变化。V-H+-ATP酶活性的变化可能对重金属膜转运产生影响,虽然所有的重金属在过量情况下可能造成毒害,但植物需要一些特定金属离子,如Fe、Zn和Ni等[30]。基于对酵母金属离子转运通道研究,学者普遍认为,任何种类的金属都有相应的细胞膜受体转运机制,而这种转运又取决于离子的浓度。这使得不易了解膜转运系统的内环境稳定性,尤其是某些植物在自然环境条件下形成的细胞甚至液泡对高浓度金属离子的适应机制。涉及到金属的膜转运,必须提到的是要区别细胞自身的膜转运机制和其对重金属的耐受机制,因为这些涉及到不同的膜蛋白对底物的竞争从而相互影响原有的活性[31-32]。更为重要的是,一些特定的金属离子底物在离体细胞研究上可能被转入膜内,但这并不意味着在体内也是必需的转运离子。因此,要了解转运系统所面临的离子浓度从而确定底物的转移性。基于上述考虑,依赖于H+浓度梯度促进金属离子通过液泡膜中的逆向转运系统就显得尤为重要,而这个逆向转运系统的工作动力源就是V-H+-ATP酶。目前,虽然对金属/H+的逆向转运系统的研究有些报道,如Cd、Zn和Mn等,但仍需要重复测定其稳定性[33-34]。非必需离子,例如Cd的转运通道,很有可能利用了必需离子的通道。但这一结论仍受限于对其他植物种的试验。逆向转运需要H+梯度的跨膜电位,而这种跨膜电位则取决于V-H+-ATP酶的活性。因此,可以简单地假设Cd的转运能量来自于V-H+-ATP酶建立的跨膜电化学梯度[35]。但必须要提出的是,虽然许多试验证明了金属离子的存在与H+浓度梯度的相关性,但还没有数据证明金属离子的转运直接与H+浓度梯度有关。V-H+-ATP酶对硝酸盐敏感,在巴佛洛霉素(Bafilomycin)浓度为微摩尔浓度水平下其活性即受到抑制[36]。所以,逆向转运在上述抑制剂存在条件下,其活性受到抑制或降低。由于多种转运系统并存于细胞膜上,它们相互制约和影响及不同底物对转运系统本身的作用使得这类研究变得复杂但极具吸引力。如果给定这样一个事实,即:许多金属离子的跨膜运转依赖于V-H+-ATP酶所建立的浓度梯度,那么,这对研究植物对重金属胁迫的适应性机制提供了最直接的切入点。
2.4冷冻胁迫 许多热带和亚热带植物都无法抵御低温。除了对寒冷敏感的植物外,大多数植物包括来自较温和气候地区的植物通常为增加其对低而发育成具有坚硬的树干。植物发育为具备坚硬的表面意味着其应对了低温造成的对V-H+-ATP酶活性的抑制;pH梯度的形成受到抑制从而使营养物质和离子在细胞内的分配隔离可能破坏;流质膜的特性发生了变化,不饱和脂肪酸的含量提高[37]。早期的观察发现,V-H+-ATP酶的游离亚基与膜内亚基在冷冻条件下会分离进而使得V-H+-ATP酶降解[38],在V-H+-ATP酶失去功能后的细胞中,胞质内的pH值降低引起酸化,这种结果可以从其他离体植物细胞中观察到[39]。V-H+-ATP酶结构的破坏与细胞质内的酸化直接与植物对低温的敏感性和耐受性有关[40]。研究指出,V-H+-ATP酶低温解体的因素还取决于物种来源,如耐寒植物和低温敏感植物的V-H+-ATP酶在同样低温条件下,后者的酶结构更易遭受解体。耐低温植物在应对低温的策略上可能采取了启动P-ATPase活性进而提供补偿。PMF的功能对于保持适当的细胞区域化可能对植物适应低温很有意义。由H+泵建立的PMF可以向逆向转录系统提供能量源进而给细胞传送糖和蛋白,而这些物质可以保护细胞抵御低温带来的破坏。低温对V-H+-ATP酶结构的影响以及PMF的减弱可能对细胞摄入物质的区域化分配产生影响。
3 V-H+-ATP的表达调节与活性修饰
大麦(Hordeumvulgare)E亚基的mRNA在嫩叶的基部表达量最大,而在其较老部分,例如叶的尖部则较少,老叶的mRNA表达则更少;棉花(Anemonevitifolia)A亚基在快速生长的纤维素细胞有最大量的表达;耐盐植物在盐胁迫下可以刺激大量V型ATPase的表达。有趣的是,冰叶日中花(Mesembryanthemumcrystallinum)的c和E亚基的修饰表达并不受高渗物质甘露醇参与的影响,这表明了V-H+-ATP酶的表达调节主要来自于离子。冰叶日中花中的E亚基的表达不会受到强光照射的影响,但表达受到高热的影响而停止,低温则可以刺激其表达[41]。某些植物的V-H+-ATP酶亚基的表达调节可能受到植物激素的影响,例如,脱落酸和细胞分裂素对V-H+-ATP酶的活性没有影响。在赤霉素缺陷型的西红柿中,c和A、B亚基的表达可以随着外源赤霉素的使用而提高。因而,V-H+-ATP酶的表达可能受到赤霉素的控制调节,但目前其在正常环境中的意义尚不明确。
除了持续性的活性调节,V-H+-ATP酶归属于生物化学调节,其调节或慢或快。快速调节V-H+-ATP酶活性对于其他的离子通道给予的驱动力是非常重要的。给叶片施与高浓度CO2是一个有效的酸性胁迫方法,一项研究指出,在高浓度CO2或短期缺氧的条件下,用31P核磁共振叶片组织,发现有效补偿的H+快速从基质流向原生质进入液泡中。当原生质内的磷酸与甘露糖结合后,正常pH值的维持将受到影响。显然,由于甘露糖减少了原生质内的ATP水平,离子跨膜运输能力降低。
3.1pH和离子 V-H+-ATP酶的活性可受到Cl-的激发并在pH中性时表现出最高活性。在pH值上升的条件下,例如pH值为8时,酶的活性仅达到pH值为7的一半。尽管在细胞中Cl-似乎对ATPase的活性不能起到调节作用,但理想的pH值是与ATPase的活性及细胞质内的离子平衡相关的[42]。虽然原生质内的Cl-和H+的浓度受到例如盐和缺氧的胁迫,但仍没有证据表明其对ATPase有调节作用。
3.2酰苷酸和磷酸 ATP是ATPase的底物(250~800 μmol·L-1),在ATP浓度为0.5~2.0 mmol·L-1时呈上升趋势。在植物细胞原生质内,上述浓度域是自然存在的,并不取决于生长条件。ATP降解后的ADP和无机磷酸是ATPase的抑制物。因此,着重于ATPase的效应:当原生质内的ATP浓度高时,其ADP和无机磷酸的浓度通常都低,反之也一样,这种类型的调节可以解释昼夜间叶片内pH值不同的现象。直接影响电能对于ATPase活性可能与胁迫类型有关,如干旱或缺氧等一些已知具有抑制或积累胞内ATP的因素。当水势从-0.5 MPa下降到-0.8 MPa时,小麦(Triticumaestivum)叶中的ATP/ADP比例从2.8下降到0.3。虽然整个叶片中的酰苷酸水平不应该下降到由干旱引起的ATP/ADP比例变化,可能是上述变化反映了整个叶片内的酰苷酸储备源,因此可能降低ATPase活性并干扰细胞物质的分配[41]。
3.3亚基组成的修饰和附加蛋白的调节 多项研究表明,在胁迫过程中V-H+-ATP酶的结构可能发生变化。对具有景天酸代谢途径(CAM)的植物进行盐胁迫,其V-H+-ATP酶会形成Di亚基[17,43],而亚基数量的改变有时并不直接影响酶活性,并且有可能是一种必要的修饰过程。一些特定植物种的V-H+-ATP酶固有的亚基会出现等位多肽,如A和B亚基在等电聚焦两相电泳时会出现同样分子量的多肽,且其氨基酸的序列与数目几乎一样。这种等位多肽的数目因物种和组织特异性而不同,但这种等位多肽的存在意义尚不明确[44]。另外,有些亚基在胁迫情况下会产生姊妹对(Chaperone),即在亚基上附着几乎同分子量的蛋白质多肽。大多数研究者认为姊妹对的产生是胁迫条件下维持蛋白质结构的辅助因子。许多物种在不同胁迫条件下都会产生姊妹对,因此可以认为,多肽的产生对细胞生命活动中的关键酶或亚基的稳定起着非常重要的意义。
4 讨论与展望
土壤盐渍化是一个世界性的资源问题和生态问题。据世界环境规划署统计,全球陆地面积近10%为各种盐渍土,我国也有近3 000万hm2的盐渍化土壤,约占全国可耕地面积的25%。当今世界人口急剧增长,工业高速发展,耕地面积不断减少,且不合理灌溉和超量使用化肥造成了大量可耕地的次生盐渍化。农作物基本上都属于非盐生植物,如何能使经济作物正常生长在盐碱生境中并能获得较高产量,是长期以来科学家研究的热点问题之一。因此,开发和有效利用盐碱土地以提高作物产量在我国农业生产中具有十分重要的现实意义。
相关的植物生理学研究表明,盐生植物之所以能在盐碱土壤生境中正常生长,是因为盐生植物能够把土壤生境中的以Na+为代表的无机离子吸收并在液泡中积累,避免了Na+等无机离子在细胞质中积累过多而导致植物生理代谢紊乱。植物维持细胞质中的低Na+水平,保持细胞的离子稳态,使细胞免受盐碱离子伤害是通过细胞限制Na+内流,增加Na+外排,或者把其区隔化到液泡中[45],这些生理活动和过程都与植物H+-ATP酶有着密不可分的关系,它们消耗大量的能量大部分都需要由ATP酶通过水解来提供。液泡作为调节细胞膨压、代谢产物储存、有毒物质积累和信号转导等方面起重要作用的细胞器,液泡膜上的质子泵向液泡内转动质子,在膜两侧形成质子梯度,作为驱动力通过液泡膜Na+/H+逆向转运体,将胞质中Na+泵入液泡内,减轻细胞质中Na+的毒害作用,同时又起到渗透调节作用,缓解水分胁迫。进入根细胞内的Na+在液泡内积累后,减少向地上部运输,减轻对地上部光合作用的影响,保持植物的正常生理活动。因此,Na+/H+逆向转运体对植物耐盐性起重要作用。目前,已从拟南芥、水稻(Oryzasativa)、盐芥(Thellugiellahalophila)、碱蓬等多种植物中克隆到了Na+/H+逆向转运体基因,AtNHX1是鉴定的第1个液泡膜Na+/H+逆向转运蛋白基因,此基因在植物中过表达后可以提高转基因植物的耐盐性[46-47]。植物耐盐性是一个复杂性状,是多个基因相互作用的结果。过去一般认为,单一基因不能显著提高植物的耐盐性,但转单一的Na+/H+逆向转运体基因能够显著提高植物的耐盐性,可能是Na+/H+逆向转运体基因导入植物后,激活了一系列耐盐相关的基因,从而提高了植物耐盐性[48],说明转基因和育种技术相结合培育耐盐植物品种是可行的。但Na+/H+逆向转运体是依赖跨膜H+电化学势的,即H+-ATP酶水解ATP产生的能量,所以盐胁迫下V-H+-ATP酶与Na+/H+逆向转运体的协同作用可能对植物的抗盐性更为重要。因此,深入了解液泡型(或质膜型)Na+/H+逆向转运体与液泡(或质膜)质子泵如何协调响应盐胁迫,然后利用分子生物学的方法和手段研究其相关基因,将其分离、克隆并导入到非抗盐植物中,可培育出抗盐的转基因植物新品种。
尽管植物抗盐性是受多基因控制的,但随着对植物抗盐分子机制及植物耐盐的生理学和生物化学方面研究的深入,更多的耐盐基因得到分离和克隆,通过基因工程等手段培育出耐盐植物并建立与之相配套的栽培技术,也许可以达到合理、有效地利用盐碱地的目的。
[1] Schumacher K,Krebs M.The V-ATPase:Small cargo,large effects[J].Current Opinion in Plant Biology,2010,13:724-730.
[2] Beyenbach K W,Wieczorek H.The V-type H+ATPase:Molecular structure and function,physiological roles and regulation[J].Journal of Experimental Biology,2006,209:577-589.
[3] Ouyang Z,Li Z,Zhang X.Cloning and sequencing of V-ATPase subunit from mung bean and its function in passive proton transport[J].Journal of Bioenergetics and Biomembranes,2008,40(6):569-576.
[4] Ratajczak R.Structure,function and regulation of the plant vacuolar H+-translocating ATPase[J].Biochimica et Biophysica Acta,2000,1465(1-2):17-36.
[5] Drory O,Nelson N.The emerging structure of vacuolar ATPases[J].Physiology,2006,21(5):317-325.
[6] Drobny M,Schnölzer M,Fiedler S,etal.Phenotypic subunit composition of the tobacco (NicotianatabacumL.) vacuolar-type H+-translocating ATPase[J].Biochimica et Biophysica Acta-Biomembranes,2002,1564(1):243-255.
[7] Sze H,Schumacher K,Müller M L,etal.A simple nomenclature for a complex proton pump:VHA genes encode the vacuolar H+-ATPase[J].Trends in Plant Science,2002,7(4):157-161.
[8] Zhang Z Y,Inoueb T,Forgac M,etal.Localization of subunit C (Vma5p) in the yeast vacuolar ATPase by immuno electron microscopy[J].FEBS Letters,2006,580:2006-2010.
[9] Muench S P,Huss M,Song C F,etal.Cryo-electron microscopy of the vacuolar ATPase motor reveals its mechanical and regulatory complexity[J].Journal of Molecular Biology,2009,386(4):989-999.
[10] Inoue T,Wang Y,Jefferies K,etal.Structure and regulation of the V-ATPases[J].Journal of Bioenergetics and Biomembranes,2005,37(6):393-398.
[11] Gaxiola R A,Palmgren M G,Schumacher K.Plant proton pumps[J].FEBS Letters,2007,581:2204-2214.
[12] Davis J M.Vacuolar energization:Pumps,shunts and stress[J].Journal of Experimental Botany,1997,48:633-641.
[13] Futai M,Nakanishi-Matsui M,Okamoto H,etal.Rotational catalysis in proton pumping ATPases:FromE.coliF-ATPase to mammalian V-ATPase[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics,2012,1817(10):1711-1721.
[14] Pons R,Cornejo M J,Sanz A.Differential salinity-induced variations in the activity of H+-pumps and Na+/H+antiporters that are involved in cytoplasm ion homeostasis as a function of genotype and tolerance level in rice cell lines[J].Plant Physiology and Biochemistry,2011,49(12):1399-1409.
[15] Wakeel A,Hanstein S,Pitann B,etal.Hydrolytic and pumping activity of H+-ATPase from leaves of sugar beet (BetavulgarisL.) as affected by salt stress[J].Journal of Plant Physiology,2010,167(9):725-731.
[16] 刘建新,胡浩斌,赵国林.NaCl 胁迫对骆驼蓬幼苗液泡膜H+-ATPase和H+-PPase活性的影响[J].中国沙漠,2008,28(2):275-279.
[17] Löw R,Rockel B,Kirsch M,etal.Early salt stress effects on the differential expression of vacuolar H+-ATPase genes in roots and leaves ofMesembryanthemumcrystallinum[J].Plant Physiology,1996,110:259-265.
[18] 罗以筛.盐胁迫下植物质膜和液泡膜H+-ATPase活性的研究进展[J].安徽农业科学,2012,40(3):1263-1265,1280.
[19] Lehr A,Kirsch M,Viereck R,etal.cDNA and genomic cloning of sugar beet V-type H+-ATPase subunit A and c isoforms:Evidence for co-ordinate expression during plant development and co-ordinate induction in response to high salinity[J].Plant Molecular Biology,1999,39:463-475.
[20] Queirós F,Fontes N,Silva P,etal.Activity of tonoplast proton pumps and Na+/H+exchange in potato cell cultures is modulated by salt[J].Journal of Experimental Botany,2009,60(4):1363-1374.
[21] Apse M P,Aharon G S,Snedden W A,etal.Salt tolerance conferred by over expression of a vacuolar Na+/H+antiport inArabidopsis[J].Science,1999,285:1256-1258.
[22] Popova O V,Golldack D.In the halotolerantLobulariamaritima(Brassicaceae) salt adaptation correlates with activation of the vacuolar H+-ATPase and the vacuolar Na+/H+antiporter[J].Journal of Plant Physiology,2007,164(10):1278-1288.
[23] 冯兰东,丁同楼,王宝山.植物液泡膜H+-ATPase及其在胁迫中的响应[J].湛江师范学院学报,2005,16(6):71-76.
[24] Han N,Shao Q,Lu C,etal.The leaf tonoplast V-H+-ATPase activity of a C3halophyteSuaedasalsais enhanced by salt stress in a Ca-dependent mode[J].Journal of Plant Physiology,2005,162:267-274.
[25] 刘延吉,张蕾,田晓艳,等.盐胁迫对碱茅幼苗叶片内源激素、NAD激酶及Ca2+-ATPase的效应[J].草业科学,2008,25(4):51-54.
[26] Janicka-Russak M,Kobus G.Modification of plasma membrane and vacuolar H+-ATPases in response to NaCl and ABA[J].Journal of Plant Physiology,2007,164:295-302.
[27] Cooley M B,Yang H,Dahal P,etal.Vacuolar H+-ATPase is expressed in response to gibberellin during tomato seed germination[J].Plant Physiology,1999,121:1339-1348.
[28] Jaleel C A,Gopi R,Manivannan P.Endogenous hormonal and enzymatic responses ofCatharanthusroseuswith triadimefon application under water deficits[J].Comptes Rendus Biologies,2008,331(11):844-852.
[29] An Z,Li C,Zu Y,etal.Expression of BjMT2,a metallothionein 2 fromBrassicajuncea,increases copper and cadmium tolerance inEscherichiacoliandArabidopsisthaliana,but inhibits root elongation inArabidopsisthalianaseedlings[J].Journal of Experimental Botany,2006,57:3575-3582.
[30] Liu J X,Zu Y G,Shi X G,etal.BjMT2,a metallothionein type-2 fromBrassicajuncea,may effectively remove excess lead from erythrocytes and kidneys of rats[J].Environmental Toxicology and Pharmacology,2007,23:168-173.
[31] Chardonnens A N,Koevoets P L M,Van Zanten A,etal.Properties of enhanced tonoplast zinc transport in naturally selected zinc tolerantSilenevulgaris[J].Plant Physiology,1999,120:779-785.
[34] Gonzales A,Koren’kov V,Wagner G J.A comparison of Zn,Mn,Cd and Ca transport mechanisms in oat root tonoplast vesicles[J].Plant Physiology,1999,106:203-209.
[35] Astolfi S,Zuchi S,Passera C.Effect of cadmium on H+-ATPase activity of plasma membrane vesicles isolated from roots of different S-supplied maize (ZeamaysL.) plants[J].Plant Science,2005,169(2):361-368.
[36] Feng Y,Forgac M.Inhibition of vacuolar H+-ATPase by disulphide bond formation between cysteine 254 and cysteine 532 in subunit A[J].Journal of Biological Chemistry,1994,269:13224-13230.
[37] Zhang J H,Liu Y P,Pan Q H.Changes in membrane-associated H+-ATPase activities and amounts in young grape plants during the cross adaptation to temperature stresses[J].Plant Science,2006,170:768-777.
[38] Kasamo K,Yamaguchi M,Nakamura Y.Mechanism of the chilling-induced decrease in proton pumping across the tonoplast of rice cells[J].Plant Cell Physiology,2000,41:840-849.
[39] Yoshida S,Hotsubo K,Kawamura Y,etal.Alterations of intracellular pH in response to low temperature stress[J].Journal of Plant Research,1999,112:225-236.
[40] Zhao J,Barkla B J,Marshall J,etal.The Arabidopsis cax3 mutants display altered salt tolerance,pH sensitivity and reduced plasma membrane H+-ATPase activity[J].Planta,2008,227(3):659-669.
[41] Dietz J K,Tavakoli N,Kluge C,etal.Significance of the V-type ATPase for the adaptation to stressful growth conditions and its regulation on the molecular and biochemical level[J].Journal of Experimental Botany,2001,52:1969-1980.
[42] Florian R,Ingo D,Gerald S,etal.Luminal and cytosolic pH feedback on proton pump activity and ATP affinity of V-type ATPase fromArabidopsis[J].Journal of Biological Chemistry,2012(12):8986-8993.
[43] Epimashko S,Fischer-Schliebs E,Christian A L,etal.Na+/H+-transporter,H+-pumps and an aquaporin in light and heavy tonoplast membranes from organic acid and NaCl accumulating vacuoles of the annual facultative CAM plant and halophyteMesembryanthemumcrystallinumL[J].Planta,2006,224(4):944-951.
[44] Kawamura Y,Arakawa K,Maeshima M,etal.Tissue specificity ofE.subunitisoforms of plant vacuolar H+-ATPase and existence of isotype enzymes[J].Journal of Biological Chemistry,2000,275:6515-6522.
[45] Yokoi S,Bressan R A,Hasegawa P M.Salt stress tolerance of plants[J].JIRCAS Working Report,2002,23:25-33.
[46] Qiu N W,Chen M,Guo J R,et al.Coordinate up-regulation of V-H+-ATPase and vacuolar Na+/H+antiporter as a response to NaCl treatment in a C3halophyteSuaedasalsa[J].Plant science,2007,2:1218-1225.
[47] 王生银,马清,王锁民.盐生植物盐地碱蓬质膜Na+/H+逆向转运蛋白基因片段的克隆及其序列分析[J].草业科学,2012,29(6):918-923.
[48] 高永生,王锁民,张承烈.植物盐适应性调节机制的研究进展[J].草业学报,2003,12(2):1-6.

