一株副溶血弧菌噬菌体VPp1的分离鉴定及裂解性能
彭 勇, 丁云娟, 林 洪, 王静雪
(中国海洋大学 食品科学与工程学院 食品安全实验室, 山东 青岛 266003)
一株副溶血弧菌噬菌体VPp1的分离鉴定及裂解性能
彭 勇, 丁云娟, 林 洪, 王静雪
(中国海洋大学 食品科学与工程学院 食品安全实验室, 山东 青岛 266003)
为探究副溶血弧菌(Vibrio parahaemolyticus)的生物防治方法, 从水产品市场处污水中分离出一株副溶血弧菌噬菌体VPp1。并借助噬菌斑形态、电镜、酶切等技术对其进行了分类鉴定, 同时测定了其裂解谱、最佳感染复数、一步生长曲线以研究其裂解性能。分类鉴定结果表明, 其核酸是线型双链DNA, 大小在15 kb左右。具有一个正二十面体的头部, 头部直径大约为44 nm, 无尾, 属盖噬菌体科(Tectivirus); 裂解性能研究结果表明, 其在双层平板上培养 12 h可形成中心清亮的噬菌斑, 周围有大而明显的晕环。最佳感染复数为0.0001, 潜伏期为10 min, 裂解量为90.3, 是符合条件的潜伏期短裂解量大的理想噬菌体, 可用作进一步的应用。
噬菌体; 副溶血弧菌(Vibrio parahaemolyticus); 鉴定; 裂解性能
弧菌病是由弧菌属(Vibriosis)细菌引起的一类细菌性疾病, 已成为海水养殖业的主要病症之一, 该病发病迅速、流行范围广、致病性强, 给国家和企业造成了巨大的经济损失。目前, 国内外已经报道的弧菌病病原主要有副溶血弧菌(Vibrio parahaemolyticus)、鳗弧菌(Vibrio anguillarum)、溶藻弧菌(Vibrio alginolyticus)、哈维氏弧菌(Vibrio harveyi)、创伤弧菌(Vibrio vulnificus)和河弧菌(Vibrio fluvialis)等[1]。副溶血弧菌的主要感染对象是对虾、海水鱼类、文蛤、牡蛎等, 能引起海洋动物体表发炎、充血等症状,感染蟹类、贝类会引起大量死亡[2]。人体食用被感染的食品会引起腹痛、呕吐、腹泻、肠痉挛、恶心和发烧等典型胃肠炎反应[3]。
目前, 弧菌病的防治方法主要是抗菌药物防治,同时还有免疫防治、生物防治等[1]。抗菌药物的大量使用不仅污染了养殖环境, 还导致了致病菌耐药性不断增强及养殖动物抗病能力的下降。免疫防治的研究刚刚起步, 疫苗的研制大多数为福尔马林灭活的全细胞疫苗, 减毒疫苗还缺乏安全性保障, 商品化生产还未开始。生物防治可大量减少抗菌素及杀虫剂的使用量, 保护生态环境, 降低病源微生物抗药性的产生。作为一种安全、绿色的治疗方法, 已经越来越受到人们的关注, 具有广泛的推广和应用前景。
噬菌体(Bacteriophage)是感染细菌和放线菌的病毒, 是生物防治的主要手段[4]。噬菌体分为烈性噬菌体和温和噬菌体两类, 烈性噬菌体可以通过酶的作用破坏细胞壁, 专一性裂解宿主菌。本研究从水产品交易市场的污水中分离出一株副溶血弧菌噬菌体,在双层平板上培养12 h出现了清晰的噬菌斑, 属烈性噬菌体。并对其进行了初步的分类鉴定及裂解性能的研究, 为其代替抗生素应用于副溶血弧菌引起的弧菌病的治疗奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌种
分离噬菌体使用的菌种为Vibrio parahaemolyticus17802 (以下简称VP 17802), 最初由Fujino[5]等于1953年从日本一个食物中毒患者体内初次分离得到。购自美国典型微生物菌种保藏中心 (American type culture collection, ATCC)。
测定噬菌体裂解谱使用的V. parahaemolyticus菌株VP VIB304、VP VIB461、VP VIB800来自中国海洋大学应用微生物实验室; VP 17802(sj)、F3-3来自山东出入境检验检疫技术中心; qdfsVp001由中国海洋大学食品安全实验室分离自青岛周边海水, 并经过生理生化特性测定及16SrDNA序列测定鉴定为一株新的副溶血弧菌。
1.1.2 培养基
2216E培养基, 购自青岛高科园海博生物技术有限公司。
1.1.3 SM缓冲液
5.8 g NaCl, 2 g MgSO4·7H2O, 50 mL的1 mol/L pH 7.5 Tris-HCl, 加蒸馏水至1 000 mL, 灭菌备用。
1.2 方法
1.2.1 噬菌体的分离
从青岛南山水产品市场处采集商贩暂养海产品的海水及污水样品 4份并编号, 取青岛第一海水浴场岸边海水一份。取上述样品30 mL加入到50 mL的离心管中经5 000 r/min, 10 min离心, 取上清液5 mL加入5 mL 2倍浓度2216E液体培养基中, 同时加入100 µL对数期的VP 17802(OD600= 0.837), 37°C过夜培养。次日, 经5 000 r/min, 10 min离心, 取上清液过0.22 µm的微孔滤膜, 得到噬菌体原液, 4°C冰箱保存。
采用双层平板法, 用灭菌的 SM 缓冲液对噬菌体原液进行适当稀释, 将 100 µL对数期的 VP 17802(OD600= 0.837)与100 µL的噬菌体稀释液分别加入5 mL的2216E半固体培养基中, 混匀, 倒入事先制好的2216E固体琼脂上, 制成双层平板。待凝固后倒置, 并于37℃恒温箱中培养。
1.2.2 噬菌体的纯化
方法进行噬菌体纯化[6], 具体步骤为:用接种针从上述出现噬菌斑单斑的双层平板上挑取一个单斑到1 mL的SM 缓冲液中, 混匀, 4°C冰箱过夜。次日, 用灭菌的SM缓冲液将上述噬菌体液进行适当稀释, 取100 µL的噬菌体稀释液与100 µL对数期的VP 17802(OD600= 0.837)混合, 37 °C恒温放置30 min, 再与5 mL半固体培养基混匀倒入事先制好的固体琼脂平板上制成双层平板, 待凝固后倒置,并于37 °C恒温箱中培养。重复双层平板纯化操作5次得到生物学纯的噬菌体株系。
1.2.3 噬菌斑的形态观察
将各株噬菌体分别用SM 缓冲液进行适当稀释,取合适稀释度噬菌体液用双层平板法做单斑培养,观察各株噬菌体的噬菌斑特征。
1.2.4 噬菌体增殖液的制备
本研究采用固体增殖法, 选取合适稀释度的长有噬菌斑的双层琼脂平板, 加入10 mL SM缓冲液, 4°C冰箱放置过夜。次日, 8 000 r/min, 15 min离心,取上清液过0.22 µm的微孔滤膜, 得到噬菌体增殖液, 4°C冰箱保存。
1.2.5 噬菌体核酸的提取
取效价达到 109pfu/mL以上的噬菌体增殖液1 mL经 12 000 r/min离心59 min (室温), 吸去上清,收集噬菌体颗粒, 然后采用 UNIP-10柱式细菌基因组提取试剂盒 (上海生工) 提取噬菌体的核酸。所提取的噬菌体核酸溶液置于–20℃保存。琼脂糖凝胶电泳鉴定提取结果。
1.2.6 噬菌体核酸类型的鉴定
取上述噬菌体的核酸溶液, 用DNaseI、RNaseA及Mung Bean Nuclease 进行酶切实验, 琼脂糖凝胶电泳鉴定酶切结果。
1.2.7 噬菌体的电镜观察
采用磷钨酸负染法[7-8], 方法如下: 取 20 μL效价达1010pfu/mL的噬菌体液, 滴在铜网上, 自然沉淀2~3 min, 用滤纸从侧面吸去多余液体, 在铜网上加一滴2%的磷钨酸, 染色10 min, 用滤纸从侧面吸取染液, 干燥后进行电镜观察并拍照。
1.2.8 噬菌体裂解谱的测定
采用双层平板法, 取100 µL的噬菌体稀释液与100 µL对数期的副溶血弧菌(OD600= 0.837)混合, 37℃恒温放置30 min, 再与5 mL半固体培养基混匀倒入事先制好的固体琼脂平板上制成双层平板, 待凝固后倒置, 并于37℃恒温箱中培养。根据噬菌体的效价, 选择形成 30~300个噬菌斑的稀释度来分析 VPp1对 VP 17802(sj)、F3-3、VP VIB304、VP VIB461、VP VIB800、qdfsVp001 菌株的裂解情况。
1.2.9 噬菌体最佳感染复数(MOI值)的测定
按照感染复数分别为10、1、0.1、0.01、0.001、0.000 1、0.000 01、0.000 001的比例, 分别将100 µL噬菌体与100 µL VP 17802 ( 3×107CFU/mL )加入10 mL 2216E液体培养基中, 37 °C振荡培养10 h, 4000 r/min离心15 min去除菌体, 去掉沉淀, 上清液用0.22 µm的膜过滤, 用双层平板法测定噬菌体的效价, 效价最高的感染复数为最佳感染复数。
1.2.10 噬菌体一步生长曲线的测定
一步生长曲线的测定参照杜崇涛[9]的方法。分别将 1 mL 噬菌体和 1 mL对数生长期的 VP 17802 (OD600= 0.837)按照感染复数为10的比例加入到8 mL 2216E液体培养基中, 37 °C孵育5 min, 12 000 r/min离心30 s, 弃上清, 用2216E液体培养基洗涤两次。加入等体积37 °C预热2216E液体培养基并充分混匀, 迅速置于37 °C振荡培养, 同时开始计时, 前30 min内每5 min取一次样, 以后每10 min取一次样,测定噬菌体的效价。以感染时间为横坐标, 噬菌体的效价为纵坐标, 绘制一步生长曲线。
2 结果
2.1 噬菌体的分离、纯化及噬菌斑的形态观察
从青岛市南山水产市场的污水中分离出了一株噬菌体VPp1, 通过双层平板37°C培养12 h发现, VP 17802被侵染, 出现了大量的噬菌斑 (图1)。纯化得到的噬菌斑呈圆形, 中心清亮, 边缘有大而明显的晕环, 纯化后的噬菌体经固体增殖后效价可达到1010pfu/mL以上。

图1 副溶血弧菌噬菌体噬菌斑的形态Fig. 1 The bacteriophage plaque of phage VPp1
2.2 噬菌体核酸的提取
琼脂糖凝胶电泳图(图2)显示, 提取的噬菌体核酸纯度较好, 浓度较高, 条带完整。通过Quantity One 软件分析得噬菌体VPp1的核酸分子量为15738.77 bp。
2.3 噬菌体核酸类型的鉴定

图2 副溶血弧菌噬菌体的核酸Fig. 2 The nucleic acid of phage VPp1

图3 副溶血弧菌噬菌体核酸类型的判断Fig. 3 Determination of the nucleic acid type of bacteriophage
琼脂糖凝胶电泳图(图3)显示, 噬菌体能被DNaseI降解, 而不能被RNaseA降解, 说明各噬菌体的核酸是 DNA, 而不是 RNA。电泳只有一条条带,说明噬菌体核酸是线型的。不能被 Mung Bean Nuclease降解, 说明噬菌体核酸是双链的而不是单链的。综合3种酶的酶切结果表明, 本实验分离的株噬菌体的核酸是线型双链DNA。
2.4 噬菌体的电镜观察
噬菌体在透射电子显微镜下的形态图(图4)显示,噬菌体VPp1有一个呈正六边形的头部, 推测是正廿面体结构, 头部直径大约为44 nm。无尾。根据ICTV第八次报告的最新病毒分类系统的标准[10], 该噬菌体属于盖噬菌体科(Tectivirus)。
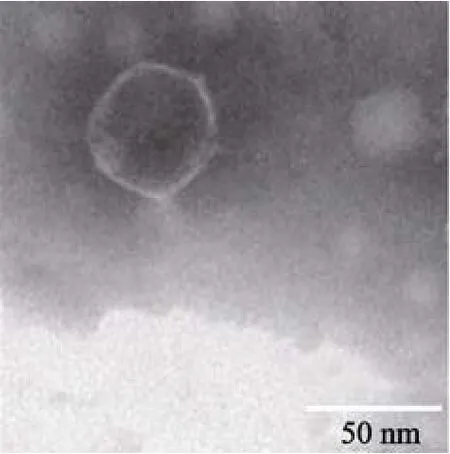
图4 副溶血弧菌噬菌体VPp1的电镜照片 (×100000) Fig. 4 Electron micrograph of phage VPp1
2.5 噬菌体裂解谱的测定
2.6 噬菌体最佳感染复数(MOI值)的测定
噬菌体最佳感染复数的测定结果分别见表1。
从表1中数据可看出, 当感染复数从10一直降到 0.0001时, 噬菌体的效价一直在升高, 当感染复数再降低时, 噬菌体效价开始降低, 即当感染复数为0.0001时, 噬菌体效价达到最高值2.62±0.03×1010,所以噬菌体VPp1的最佳感染复数为0.0001。
2.7 噬菌体一步生长曲线的测定
噬菌体 VPp1的一步生长曲线测定结果分别见图5。
据图5, 可以明显看出噬菌体VPp1感染宿主菌后10 min内, 噬菌体的量没有增加, 即潜伏期约10 min; 噬菌体感染宿主菌后 10~30 min, 噬菌体的量急速增加, 即噬菌体 VPp1的裂解期约 20 min; 在随后的90 min里, 噬菌体的量变化不大, 即噬菌体进入到稳定期。根据裂解量计算公式: 裂解量=裂解末期噬菌体效价/感染初期宿主菌浓度=2.71×109/3× 107=90.3。

表1 噬菌体VPp1最佳感染复数的测定Tab. 1 Determination of bacteriophage VPp1 MOI
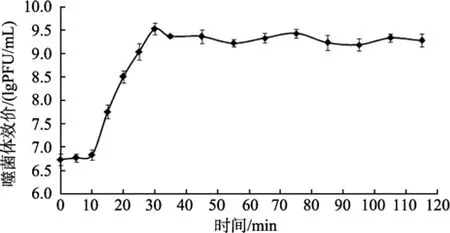
图5 噬菌体VPp1的一步生长曲线Fig. 5 One-step growth curve of phage VPp1
3 讨论
本研究曾于4、5月份进行过多次噬菌体的分离,均一无所获。6月初的一次分离成功地分离出大量噬菌体, 这说明气温对噬菌体分离的成功与否有很大影响, 原因可能是气温低时水体中宿主菌的含量极少, 致使噬菌体含量极少, 所以很难分离出来。蔺红苹[11]等的研究也提到过类似的情况。另外, 杨吉霞[12]在研究中提到从赤潮海水中分离噬菌体会更容易,原因是赤潮海水藻类爆发性增殖, 而藻类与细菌、病毒之间存在着相生相克、错综复杂的互相作用, 藻类增殖后, 细菌、病毒的数量也会随之改变。这也许不失为一个好办法。
目前国际上噬菌体的分类标准尚不完善, 2005年国际病毒分类委员会 (ICTV) 第八次报告将噬菌体进行了比较系统的分类与命名。其依据核酸类型、形态结构、基本特性及宿主菌类型等特征将噬菌体划分为群、目、科、属、种5个阶级, 种下根据实际需要可设立亚种[13]。本研究分离出的噬菌体核酸是线型双链 DNA, 根据第八次报告的分类方法, 应首先划分为群I。噬菌体无尾, 根据其形态特征可划分为盖病毒科盖噬菌体属。
阿花的泪又滚落在白净的脸上。我对谁都没说过,为了生存,为了打拼,我不得不掩饰自己,不得不虚与委蛇。其实在南方,很多人不得不这样来掩饰自己,假身份证,假文凭,假夫妻,假城里人,假洋鬼子……比比皆是。我隐瞒那段历史,是怕你们看不起我,是怕失去做女人的优势,是怕在商场难以立足。
噬菌体裂解谱测定结果显示, 本研究提取的副溶血弧菌噬菌体的裂解谱范围并不广泛, 但其能形成透亮的噬菌斑, 说明其均有很强的裂解能力。另外,多方面的研究已表明[14], 虽然噬菌体对宿主菌有高度特异性, 但通过人工改造, 可以扩展噬菌体的裂解范围。本实验提取的噬菌体有待于用各种方法扩展其宿主谱, 为其在致病菌检测方面的应用奠定基础。
感染复数, 又称感染倍数, 是为研究病毒感染与产出之间量效关系而提出的一个重要生物学指标[15]。噬菌体的感染复数是指初始感染时, 加入噬菌体的数量与加入宿主菌数量的比值。不同的噬菌体的感染复数是不同的, 存在一个最佳用量和最大产出问题, 即最佳感染复数。最佳感染复数与噬菌体的种类、结构以及宿主菌有关, 最佳感染复数反映了噬菌体的裂解能力。本研究分离的噬菌体VPp1的最佳感染复数分别为 0.0001, 邱德全[16]等分离的副溶血弧菌噬菌体最佳感染复数在0.1~10, Onanong[17]等测得食窦魏斯氏菌噬菌体感染宿主菌的最佳感染复数在0.01, 与之相比较, 可知噬菌体VPp1具有较强的裂解能力。
一步生长曲线可反映噬菌体 3个重要的特征参数: 潜伏期、裂解期、裂解量。可为噬菌体的治疗、检测等应用研究筛选出潜伏期短裂解量大的噬菌体。本研究分离的噬菌体VPp1的潜伏期较短, 裂解量达 90.3, 表明其裂解能力是非常强的, 可进一步应用于噬菌体治疗、检测等方面。
参考文献:
[1] 闫茂仓, 陈少波, 单乐州, 等. 海水养殖动物致病弧菌的研究进展[J]. 水产科学, 2009, 28(8): 475-481.
[2] 吴后波, 潘金培. 弧菌属细菌及其所致海水养殖动物疾病[J]. 中国水产科学, 2001, 8(1): 89-93.
[3] Yicheng S, Chengchu L.Vibrio parahaemolyticus: A concern of seafood safety[J]. Food Microbiology, 2007, 24: 549-558.
[4] 李亚晨, 包永明, 吕建发, 等. 海洋水产动物弧菌病的生物防治[J]. 水产科学, 2004, 23(2): 35-38.
[5] Fujino T, Miwatani T, Yasuda J. Taxonomic studies on the bacterial strains isolated from cases of“shirasu”food-poisoning (Pasteurella parahaemolytica) and related microorganisms[J]. Biken Journal, 1965, 8(2): 63-71.
[6] 余茂効, 司穉东. 噬菌体实验技术[M]. 北京: 科学出版社, 1991: 10.
[7] 宁淑香, 聂丽平, 陆敏. VP10─── 一株海洋噬菌体的分离及特性研究[J]. 水产科学, 2003, 22(2): 14 -16.
[8] 宁淑香, 聂丽平, 陆敏.河流弧菌-II (Vibrio fluvialis-II) 噬菌体───VP8的分离与研究[J]. 微生物学杂志, 2000, 20(1): 20-31.
[9] 杜崇涛. 大肠杆菌O157噬菌体的分离鉴定及其初步应用[D]. 长春: 吉林大学, 2008.
[10] 洪健, 周雪平. ICTV第八次报告的最新病毒分类系统[J].中国病毒学, 2006, 21(1): 84-96.
[11] 蔺红苹, 邱德全, 谭龙艳. 一株副溶血弧菌噬菌体的分离与鉴定[J]. 水产科学, 2010, 29(5): 291-294.
[12] 杨吉霞. 霍乱弧菌 SWBC-a为靶细菌筛选宽裂解弧菌噬菌体[J].水产科学, 2009, 28(6): 337-340.
[13] 冯书章, 刘军, 孙洋. 细菌的病毒 ─── 噬菌体最新分类与命名[J].中国兽医学报, 2007, 27(4): 604-608.
[14] Graschopf A, Blasi U. Functional assembly of the lambda S2 holin requires periplasmatic localization of its N2 terminus[J]. Arch Microbiol, 1999, 172: 31.
[15] 代保英. 大肠杆菌K88噬菌体的分离、分类初步鉴定和生物学特性的测定[D]. 扬州: 扬州大学, 2009.
[16] 邱德全, 蔺红苹, 谭龙艳. 一株副溶血弧菌噬菌体生理特性的研究[J]. 微生物学通报, 2007, 34(4): 735-739.
[17] Onanong P, Nuttaporn P, Nuttika S, et al. Isolation and characterization of a novelPodoviridae-phage infectingWeissella cibariaN22 from Nham, a Thai fermented pork sausage[J]. Food Microbiology, 2011(28): 518-525.
(本文编辑: 谭雪静)
Isolation, identification and lysis properties analysis of aVibrio parahaemolyticusphage VPp1
PENG Yong, DING Yun-juan, LIN Hong, WANG Jing-xue
(Food Safety Laboratory, College of Food Science and Engineering, Ocean University of China, Qingdao, 266003, China)
Dec.,2, 2011
phage;Vibrio parahaemolyticus; identification; lysis properties
In order to develop an effective bio-controlling method againstVibrio parahaemolyticus, a virulent phage VPp1 was isolated from aquatic sewage water and identified by plaque shapes, restriction, electronic microscope and lysis properties analyses. The results revealed that VPp1 contains a linear double stranded DNA with 15kb in size and it has an icosahedral head with 44 nm in diameter and does not have a tail, suggesting that VPp1 belongs to theTectivirusfamily. VPp1 forms plaques with transparent center and large halo after culture in double-layer agar plate for 12 hours and its optimum MOI value was 0.0001. A one-step growth experiment showed that the latent period and burst size were estimated at 10 min and 90.3 phage particles/infected cell, respectively. VPp1 could be widely used because of its short latent period and large burst size.
Q939.48
A
1000-3096(2013)01-0096-06
2011-12-02;
2012-03-25
国家自然科学基金资助项目(31071540); 现代农业产业技术体系建设专项资金资助项目(nycytx-50); 山东省自然科学基金资助项目(ZR2011CQ024)
彭勇(1987-), 男, 山东潍坊人, 硕士研究生, 主要从事食品质量与安全方面研究, 电 话: 0532-82031550, E-mail: pengyongpy520@163.com; 王静雪, 通信作者,电话: 0532-82032389, E-mail: snow@ouc.edu.cn

