高效液相色谱法快速筛查与测定葡萄酒中纽甜
王 齐,朱伟伟*,杨 俊
(1.昆明理工大学分析测试研究中心,云南 昆明 650093;2.河池学院化学与生命科学系,广西 宜州 546300)
高效液相色谱法快速筛查与测定葡萄酒中纽甜
王 齐1,朱伟伟2,*,杨 俊1
(1.昆明理工大学分析测试研究中心,云南 昆明 650093;2.河池学院化学与生命科学系,广西 宜州 546300)
建立一种高效液相色谱法快速定性筛查与准确定量检测葡萄酒中人工合成甜味剂纽甜的方法。采用Waters Nova-Pak C18反相色谱柱,以离子对试剂缓冲液:乙腈=60:40(V/V)为流动相,在218nm波长处,对样品进行筛查,纽甜出峰时间约在13.4min;疑似阳性样品在梯度洗脱条件下进行定量检测,纽甜出峰时间约在15.9min,检出限为0.37μg/mL,平均回收率在99%~101%之间,相对标准偏差均小于1.0%(n=5)。本方法简便、准确、实用,在批量样品检测时可节省约50%的分析时间。
葡萄酒;纽甜;高效液相色谱;定性筛查;定量测定
纽甜(neotame),化学名称为N-[N-(3,3-二甲基丁基)-L-α-天门冬氨酰]-L-苯丙氨酸-1-甲酯,分子式为C20H30N2O5,是一种新型功能性甜味剂。纽甜的甜度约为蔗糖的8000~12000倍,为阿巴斯甜的40倍以上,甜味纯正,无其他甜味剂常带的苦味和金属味,稳定性高,且价格相对低廉,故纽甜作为甜味调节剂广泛用于各类食品、饮料和制造业中[1-2]。
葡萄酒是以鲜葡萄或葡萄汁为原料,经全部或部分发酵酿制而成的,含有一定酒精度的发酵酒,按其含糖量可分为干葡萄酒、半干葡萄酒、半甜葡萄酒和甜葡萄酒。近年来,大量研究发现葡萄酒因含有丰富的生物酚[3-4],而具有抗氧化、清除自由基等功效[5-9],从而受到消费者的青睐。葡萄酒因其产地、原料、工艺及环境的不同,使得各地出产的葡萄酒中的组成成分与口感截然不同[10-12]。葡萄酒生产商可能会添加某些甜味剂如纽甜、阿巴斯甜、安赛蜜、糖精钠等,调节葡萄酒的甜度,达到各类葡萄酒应有的口感。然而根据GB 15037—2006《葡萄酒》中的规定[13],所有葡萄酒中均不得添加甜味剂,因此对葡萄酒中纽甜等甜味剂进行检测意义重大。食品和饮料中纽甜的测定方法有高效液相色谱法、液相色谱-质谱联用法等[14-16],其中高效液相色谱法是最常用的测定方法。GB/T 23378—2009《食品中纽甜的测定方法》[17]中运用梯度洗脱的方法能够较好地对复杂样品体系中纽甜组分与干扰组分进行分离测定,但是此方法分析时间过长。因此在日常风险监测等大样品量检测中,急需建立一种高效、简便、可靠的分析方法以填补葡萄酒中纽甜的测定方法空白。
本实验拟建立一种先用等度比例色谱条件对样品进行定性筛查,然后再用梯度比例色谱条件对阳性疑似葡萄酒样品中纽甜含量进行测定的方法。此方法对样品定性筛查的假阳性率小于5%,稳定性好,检出限低,回收率高,能够用于日常大样品量检测,以提高食品安全监测的工作效率。
1 材料与方法
1.1 材料与试剂
纽甜标准品 美国USP公司;辛烷磺酸钠(色谱纯)美国Tedia天地试剂公司;磷酸、甲酸(均为分析纯) 天津风船化学试剂有限公司;三乙胺(分析纯) 天津瑞金特化学试剂有限公司;乙腈(色谱纯) 江苏汉邦科技有限公司。
1.2 仪器与设备
600四元泵、717plus自动进样器、2487双波长紫外检测器、M32色谱数据处理工作站 美国Waters公司;PHS-3D型精密pH计 上海雷磁仪器厂。
1.3 方法
1.3.1 缓冲液的配制
吸取2.5mL三乙胺溶液,溶解于1000mL蒸馏水中,用稀甲酸调节pH值至4.5。
1.3.2 离子对试剂缓冲液的配制
称取2.00g辛烷磺酸钠,用200mL蒸馏水溶解后,加入1.0mL磷酸溶液,定容至1000mL。
1.3.3 色谱条件
色谱柱:Waters Nova-Pak C18柱(150mm×3.9mm,5μm);定性筛选色谱流动相I(isocratic):离子对试剂缓冲液:乙腈=60:40(V/V);定量分析流动相G(gradient)梯度比例变化见表1;流速1.0mL/min;色谱柱温度30℃;紫外检测器波长218nm。

表1 梯度洗脱条件Table1 Gradient elution conditions %
1.3.4 标准溶液的配制
分别准确称取0.50、1.25、2.50、5.00mg纽甜标准品于小烧杯中,溶解后转移至50mL容量瓶中,用pH4.5缓冲液定容至刻度,其质量浓度分别为10、25、50、100μg/mL。
1.3.5 样品处理
准确吸取5.0mL样液于10mL容量瓶中,加pH4.5缓冲液定容至刻度。
1.3.6 样品的采集
市场随机抽取50份不同产地、不同品牌半甜葡萄酒样,按以上实验方法进行实验。选取3个具有代表性样品:不含纽甜阴性样品标记为A葡萄酒样;经定性色谱条件分析判定为疑似阳性,定量色谱条件未检出的假阳性样品标记为B葡萄酒样;经定量色谱条件检出含有纽甜的阳性样品标记为C葡萄酒样。
2 结果与分析
2.1 定性筛查等度比例I色谱条件对样品的筛查
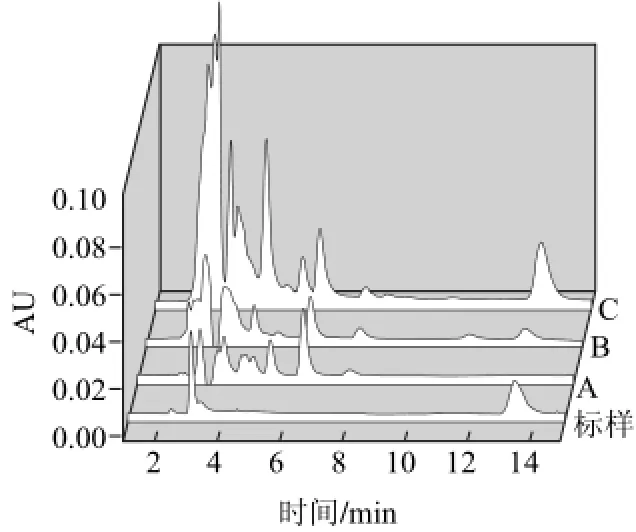
图1 等度比例Ⅰ色谱条件下纽甜色谱图Fig.1 HPLC spectrum of neotame by mobile phase I
图1为纽甜标样、不含纽甜葡萄酒阴性样(A)、不含纽甜葡萄酒假阳性样(B)与含纽甜葡萄酒阳性样(C)在等度比例I色谱条件下获得的色谱图。从图1可见,纽甜标样在等度比例I色谱条件下的保留时间为13.4min,与阳性样(C)中纽甜组分保留时间一致;而葡萄酒假阳性样(B)中干扰组分峰与纽甜标样峰保留时间相近为13.2min,在不加标或其他方法验证情况下极易判定为纽甜组分。
2.2 定量测定梯度比例G色谱条件对纽甜含量的测定

图2 梯度比例G色谱条件下纽甜色谱图Fig.2 HPLC spectrum of neotame by mobile phase G
图2为纽甜标样、不含纽甜葡萄酒假阳性样(B)与含纽甜葡萄酒阳性样(C)在梯度比例G条件下的色谱图。从图2可见,纽甜标样在梯度比例G色谱条件下的保留时间为15.9min,与阳性样(C)中纽甜组分保留时间一致;而葡萄酒假阳性样(B)中干扰组分保留时间相近为14.8min,此色谱条件能够对假阳性样中干扰组分进行判别。
2.3 梯度比例G色谱条件定量分析方法学考察
将1.3.3节中不同质量浓度的纽甜标准溶液以梯度比例G色谱条件分别进样10μL,结果见表2。以峰面积为纵坐标、质量浓度为横坐标,绘制标准曲线图,标准曲线方程为Y=14258X+14397,相关系数R2=0.9998;并以2.0μg/mL纽甜标准溶液进行检出限测定实验,在RSN=3时计算检出限为0.37μg/mL。

表2 纽甜标准溶液质量浓度和峰面积Table2 Correlation between neotame concentration and HPLC peak area
取10份不含纽甜的葡萄酒样品,分别加入纽甜标准品,配制成20.0μg/mL和80.0μg/mL高、低质量浓度两组样品进行加标回收率实验,结果见表3。结果表明本方法的平均回收率在99%~101%之间,相对标准偏差均小于1.0%。本法定量分析方法学结果与GB/T 23378—2009中方法学结果进行比较,回收率与精密度无明显差异,满足定量分析要求。

表3 纽甜回收率和精密度实验结果Table3 Mean recovery rates and relative standard deviations for neotame in blank wine samples with spiked standard
2.4 实际葡萄酒样品分析应用
市场随机抽取50份不同产地、不同品牌半甜葡萄酒样,按等度比例I色谱条件进行定性样品快速筛查,经筛查后疑似含有纽甜的葡萄酒样品,再经梯度比例G色谱条件进行定量分析。50份葡萄酒样品中通过快速筛查方法发现9例样品疑似含有纽甜,再经梯度比例G色谱条件定量分析,发现此9例样品中2例为杂质干扰,7例样品含有纽甜,其余41例阴性样品不含纽甜。快速定性筛查等度比例I色谱条件的假阳性率仅为4.7%,而定性筛查等度比例I色谱条件分析时间比梯度比例G色谱条件分析时间少约20min,以风险监测一批50个样品的葡萄酒为例,可节省约30h(双平行测定)。
3 结 论
本实验采用等度比例色谱条件,对葡萄酒中纽甜进行定性快速筛查,再采用梯度比例色谱条件对葡萄酒中纽甜进行定量分析。结果表明,使用定性快速筛查的方法其假阳性率小于5%,而定量测定的色谱条件方法稳定性好,检出限低,回收率高。本实验建立的葡萄酒中纽甜快速定性与准确定量分析的方法,能够在批量样品检测中节省约50%的分析时间,既能提高食品检验机构工作效率,又能保证分析测试环节的工作质量。
[1] 魏志勇, 刘颖秋, 佘志刚. 纽甜的应用及研究进展[J]. 食品工业科技, 2008, 29(12): 252-255.
[2] 张金峰, 沈寒晰, 张存社. 新型甜味剂纽甜研究进展[J]. 应用化工, 2010, 39(10): 1574-1577.
[3] ANASTASIADI M, PRATSINIS H, KLETSAS D, et al. Bioactive non-coloured polyphenols content of grapes, wines and vinification by-products: evaluation of the antioxidant activities of their extracts[J]. Food Research International, 2010, 43(3): 805-813.
[4] YILMAZ Y, TOLEDO R T. Oxygen radical absorbance capacities of grape/wine industry byproducts and effect of solvent type on extraction of grape seed polyphenols[J]. Journal of Food Composition and Analysis, 2006, 19(1): 41-48.
[5] SHRIKHAND A J. Wine by-products with health benefits[J]. Food Research International, 2000, 33(6): 469-474.
[6] KATALINIĆ V, MILOS M, MODUN D, et al. Antioxidant effectiveness of selected wines in comparison with (+)-catechin[J]. Food Chemistry, 2004, 86(4): 593-600.
[7] RADOVANOVIĆ A, RADOVANOVIĆ B, JOVANČIĆEVIĆ B. Free radical scavenging and antibacterial activities of southern Serbian red wines[J]. Food Chemistry, 2009, 117(2): 326-331.
[8] VILLANO D, FERNANDEZ-PACHON M S, TRONCOSO A M, et al. Influence of enological practices on the antioxidant activity of wines[J]. Food Chemistry, 2006, 95(3): 394-404.
[9] CAZZOLA R, CESTARO B. Red wine polyphenols protect n-3 more than n-6 polyunsaturated fatty acid from lipid peroxidation[J]. Food Research International, 2011, 44(9): 3065-3071.
[10] HOGAN S, ZHANG Lei, LI Janrong, et al. Antioxidant properties and bioactive components of Norton (Vitis aestivalis) and Cabernet Franc (Vitis vinifera) wine grapes[J]. LWT-Food Science and Technology, 2009, 42(7): 1269-1274.
[11] RIVERO-PEREZ M D, GONZALEZ-SANJOSE M L, ORTEGAHERAS M, et al. Antioxidant potential of single-variety red wines aged in the barrel and in the bottle[J]. Food Chemistry, 2008, 111(4): 957-964.
[12] NIXDORF S L, HERMOSÍN-GUTIÉRREZ I. Brazilian red wines made from the hybrid grape cultivar isabel: phenolic composition and antioxidant capacity[J]. Analytica Chimica Acta, 2010, 659(1/2): 208-215.
[13] 中国国家标准化管理委员会. GB 15037—2006 葡萄酒[S]. 北京: 中国标准出版社, 2006.
[14] WASIK A, MCCOURT J, BUCHGRABER M. Simultaneous determination of nine intense sweeteners in foodstuffs by high performance liquid chromatography and evaporative light scattering detection: development and single-laboratory validation[J]. Journal of Chromatography A, 2007, 157(1/2): 187-196.
[15] 刘晓霞, 丁利, 刘锦霞, 等. 高效液相色谱-串联质谱法测定食品中6种人工合成甜味剂[J]. 色谱, 2010, 28(11): 1020-1025.
[16] 蒋晓彤, 陈国松, 姜玲玲, 等. 高效液相色谱法同时检测6种甜味剂[J]. 食品科学, 2011, 32(6): 165-168.
[17] 中国国家标准化管理委员会. GB/T 23378—2009 食品中纽甜的测定方法[S]. 北京: 中国标准出版社, 2009.
Fast Qualitative Analysis and Accurate Quantitative Determination of Neotame in Wine by High Performance Liquid Chromatography
WANG Qi1,ZHU Wei-wei2,*,YANG Jun1
(1. Research Center for Analysis and Measurement, Kunming University of Science and Technology, Kunming 650093, China;2. Department of Chemistry and Life Science, Hechi Universtiy, Yizhou 546300, China)
A high performance liquid chromatography (HPLC) method for fast qualitative analysis and accurately quantitative determination of artificial sweetener neotame in wine was developed. Neotame was qualitatively analyzed on a Waters Nova-Pak C18column with an ultraviolet detector at 218 nm using acetonitrile: ion-pair reagent = 40:60 (V/V) as the mobile phase, and the retention time of neotame was approximately 13.4 min. The contents of neotame in the suspected samples were determined under gradient elution condition, and the retention time of neotame was approximately 15.9 min. The detection limit of the developed method was 0.37 μg/mL, and the mean recovery rate for neotame in blank wine samples with spiked standard was 99%-101% with a relative standard deviation less than 1.0% (n = 5). This method is simple, accurate and practical, and can save 50% time during the analysis of large number of samples.
wine;neotame;high performance liquid chromatography;fast qualitative analysis;accurately quantitative determination
TS207.3
A
1002-6630(2013)04-0154-03
2012-02-06
云南省科技平台项目(2010DH025);昆明理工大学分析测试中心主任基金项目(2008001);
河池学院2008年“引进人才科研启动费”项目(2008QS-N012)
王齐(1981—),男,工程师,硕士,研究方向为天然产物。E-mail:kmuac@163.com
*通信作者:朱伟伟(1981—),女,讲师,硕士,研究方向为药物分析。E-mail:zhuww1230@yahoo.com.cn

