青蒿琥酯对肺泡上皮细胞TGF-β1/MAPK通路的影响*
陈 娟,王昌明,周 燕,黎红秀
(桂林医学院附属医院呼吸内科,广西桂林541001)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一组多种病因引起的以气道受损、炎症因子大量分泌、间充质细胞增生和细胞外基质异常沉积为特点的渐进性疾病,患者确诊后平均生存期仅3~5年[1]。IPF发病机制不明,近年来国内外研究表明肺泡上皮细胞-间质细胞转分化(epithelial-mesenchymal transition,EMT)是肺纤维的重要机制之一,细胞因子转化生长因子-β1(transforming growth factor beta1,TGF-β1)可通过活化p38丝裂原活化蛋白激酶类(p38mitogen-activated protein kinases,p38MAPK)诱导 EMT 过程[2]。目前,对IPF尚缺乏有效的治疗方法,临床上常用糖皮质激素和免疫抑制剂,但效果并不满意。本课题组前期研究表明,青蒿素衍生物青蒿琥酯除抗疟疾外,还具有抗纤维化作用[3-4]。本研究用青蒿琥酯为工具药,研究在其干预下对TGF-β1诱导的EMT过程中的影响及其可能机制。
1 材料与方法
1.1 材料 永生化大鼠肺泡Ⅱ型上皮细胞(rat lung epithelial-t-antigen negative,RLE-6TN)株购自中南大学湘雅实验中心细胞库。TGF-β1购自Peprotech公司(美国);四甲基偶氮唑盐(MTT)粉剂购自sigma公司(美国);Total RNA提取试剂、逆转录试剂盒购自TaKaRa宝生物工程大连有限公司;引物由Invitrogen公司设计合成;组织细胞裂解液(tissue and cell lysis solution,WIP)、BCA蛋白浓度测定试剂盒购自北京博奥森生物技术有限公司;p38MAPK兔抗人一抗购自Santa cruz(美国);α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)兔抗人单克隆抗体购自ABBIOTEC公司(美国);V-波形蛋白(vimentin,Vim)兔抗人一抗购自Bioworld Technology;辣根酶标记山羊抗兔IgG购自中杉金桥;胎牛血清购自GIBCO公司;1640培养基购自HyClone公司。
1.2 方法
1.2.1 细胞培养 RLE-6TN细胞在37℃、5%CO2、饱和湿度的条件下用含10%胎牛血清的1640培养基培养。稳定传代后用含1%胎牛血清的培养液培养细胞同步化24h,根据相关文献及预实验结果,诱导剂TGF-β1按说明书配置好母液后稀释于含1%胎牛血清的培养液中,终浓度为3ng/mL,青蒿琥酯用NaHCO3溶解后再调整到相应终浓度作用于细胞。
1.2.2 细胞分组 MTT粉剂用PBS配成5mg/mL的存储液,过滤除菌,4℃保存。将细胞分为6组,1个对照组、5个实验组(其中1个诱导组,4个药物干预组)。计数细胞,3 000个/孔细胞种植96孔板,设5个复孔,在1%FBS(对照组)、TGF-β13ng/mL(TGF-β1组)、TGF-β13ng/mL+青蒿琥酯1 mg/L(TGF-β1联合1组)、TGF-β13ng/mL+青蒿琥酯2mg/L(TGF-β1联合2组)、TGF-β13ng/mL+ 青蒿琥酯 4mg/L(TGF-β1联合3组)、TGF-β13ng/mL+青蒿琥酯8mg/L(TGF-β1联合4组)作用细胞24h后加入MTT溶液至终浓度0.5mg/mL,继续培养4h,吸干净 MTT溶液,加入二甲基亚砜(dimethyl sulfoxide,DMSO)150μL,避光平摇10min,用酶标仪测定490nm处的吸光度值(A)。根据抑制率=﹝(对照组OD490值-实验组OD490值)/对照组OD490值﹞×100%计算细胞抑制率。用寇式改良法计算IC50,根据IC50选择药物干预浓度进行以下实验。
1.2.3 倒置显微镜观察 当细胞生长融合至60%~80%时,弃培养液,换含1%胎牛血清的1640培养液静止24h,换新鲜静止液,于对照组、TGF-β1组及 TGF-β1联合1、2、3、4组培养液中分别加入1%FBS、TGF-β13ng/mL及TGF-β13ng/mL+青蒿琥酯1、2、4、8mg/L作用细胞24h后,使用倒置相差显微镜观察细胞形态学的改变并拍照。
1.2.4 Western blot检测上皮及间质细胞标志物的表达 各组细胞生长、培养同1.2.3,培养细胞24h后用WIP裂解液(1 mL)+蛋白酶抑制剂(10μL)+磷酸酶抑制剂(10μL)混合,每皿(d=10cm)加入 WIP裂解液混合液200μL,冰上裂解45 min,用细胞刮刮下后离心取上清液,BCA蛋白测定试剂盒做标准曲线测定蛋白浓度后,取30μg样品蛋白进行10%的十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶变性电泳,然后转膜至聚偏二氟乙烯(PVDF)膜,加入一抗,37℃孵育2h,Tris-Buffered-Saline with Tween-20(TBST)洗涤后加辣根酶标记二抗,37℃孵育2h,TBST洗涤后加适量ECL发光液(ECL luminous liquid)暗室发光,曝光后在凝胶成像系统下扫描并获取密度值。
1.3 统计学处理 采用SPSS17.0统计软件进行分析,各实验均重复3次。实验数据以±s表示,差异显著性分析采用One-way ANOVA分析,组间采用方差分析比较,以P<0.05为差异有统计学意义。
2 结 果
2.1 青蒿琥酯对TGF-β1诱导的RLE-6TN细胞增殖的影响TGF-β1作用于RLE-6TN 24h后,细胞较对照组增殖明显(P<0.05);青蒿琥酯不同浓度作用于 TGF-β1诱导的 RLE-6TN 24h后,细胞增殖受到抑制(表1)。根据抑制率用寇式改良法计算IC50,24hIC50=8.86mg/L。
2.2 青蒿琥酯对TGF-β1诱导的RLE-6TN细胞形态的影响与对照组比较,加入TGF-β1后,RLE-6TN由铺路石状上皮形态变成梭形、纺锤形,而且其细胞间隙略变大,细胞和细胞之间的连接变得松散。在TGF-β1诱导后再加入青蒿琥酯,即TGF-β1联合1、2、3、4组,与 TGF-β1组比较,细胞的梭形结构减少,部分恢复铺路石状上皮形态,但细胞之间连接仍松散,见图1。
2.3 青蒿琥酯对TGF-β1诱导的RLE-6TN细胞p38MAPK及间质细胞标志性蛋白表达的影响 细胞培养24h后,TGF-β1诱导RLE-6TN表达p38MAPK、α-SMA、Vim均较对照组明显增加(P<0.05),青蒿琥酯作用于 TGF-β1诱导的 RLE-6TN后,p38MAPK、α-SMA、Vim表达均较 TGF-β1组明显减少(P<0.01),且各组间减少呈剂量依赖性(P<0.05)。内参为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),各组蛋白表达的电泳图,见图2。

图1 倒置显微镜下各组细胞形态(×100)
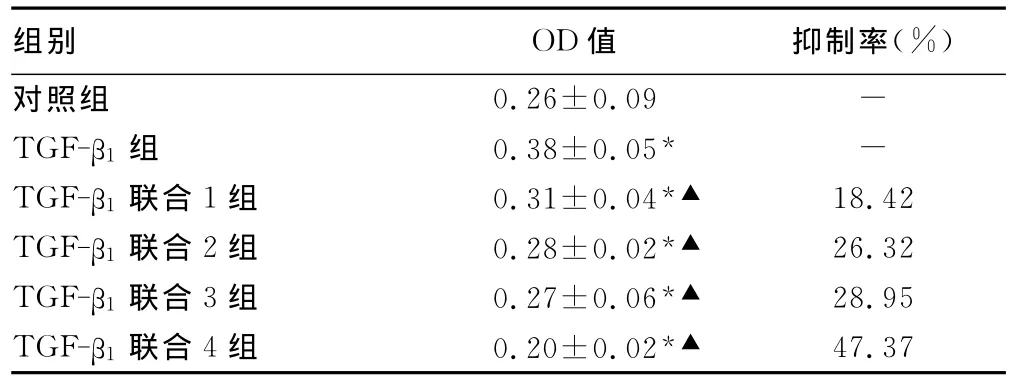
表1 各组细胞24h后增殖抑制率比较
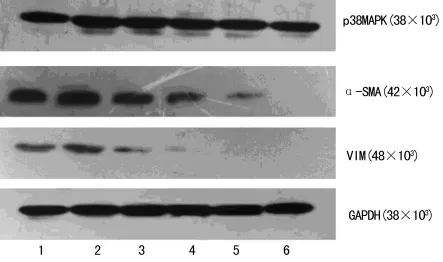
图2 各组蛋白表达的电泳图
3 讨 论
肺间质纤维化(Pulmonary fibrosis,PF)是一组多种病因引起的以气道、肺泡结构排列紊乱,胶原大量沉积为特点的渐进性疾病。临床表现为刺激性干咳、无痰、进行性的呼吸困难等,最终可以引起呼吸功能衰竭而死亡。目前肺纤维化的病因及其发病机制尚未完全阐明,但都有其共同规律,肺部受感染或损伤后,损伤的肺上皮细胞和血管内皮细胞产生大量的细胞因子,刺激炎症细胞的聚集、活化,分泌胶原等细胞外基质,沉积在肺间质,导致肺纤维化[5]。
TGF-β1是一种多效性的细胞因子,是目前肺纤维化的研究热点和重要药物作用靶点。TGF-β1可由淋巴细胞、单核细胞、上皮细胞和成纤维细胞等多种细胞产生,通过自分泌和旁分泌的方式调节细胞的增殖、分化、迁移、黏附、调节细胞外基质的代谢,参与肺胚胎发育、组织损伤和修复[6]。
Furukawa等[7]研究表明,TGF-β1诱导MAPK磷酸化活性变化,通过MAPK信号转导途径调节人肺上皮细胞向肌纤维母细胞转化,产生大量的细胞外基质,导致肺间质纤维化。肺泡上皮细胞(alveolar epithelial cell,AEC)包括Ⅰ和Ⅱ型,肺泡Ⅱ型上皮细胞(typeⅡalveolar epithelial cell or typeⅡpneumocyte,ATⅡ)是一种多功能细胞,对维持肺泡结构和功能有重要意义。它是Ⅰ、Ⅱ型上皮细胞的祖细胞[8-9],在正常细胞更新和损伤修复过程中,ATⅡ可以分化为Ⅰ型细胞,也可通过有丝分裂补充自身的数量。此外,ATⅡ具有合成和分泌肺表面活性物质,维持肺泡内外液体平衡,免疫调节等作用[10]。
丝氨酸/苏氨酸蛋白激酶(MAPKs)信号通路是真核细胞转导细胞外信号到细胞内引起细胞反应的四大信号系统之一,其参与了细胞生长、发育及细胞间功能同步等多种生理功能,目前已知MAPKs由4个主要成员构成,即细胞外信号调节激酶 (ERK1/ERK2)、应激活化蛋白激酶 (SAOK/JNK)、p38MAPK和ERK5。其中p38MAPK与肺纤维化过程密切相关[11]。TGF-β1诱导活化TGF-β1受体复合物,级联活 化p38MAPK,p38MAPK把信号传递到细胞核内,活化EMT相关转录因子Snail家族蛋白中的Snail1和Slug表达,从而引起细胞形态及分泌功能的改变。Snail家族蛋白通过锌指结构域及N-末端结构域起着转录抑制子的作用,Snail1在EMT过程中的作用早已有报道[12]。
张新志等[13]用抗纤灵冲剂作用于SD大鼠后,发现抗纤灵冲剂可通过调节TGF-β1/p38MAPK信号转导通路,发挥抗肾小管间质纤维化效应。Matsuoka等[14]研究也证实,用p38MAPK拮抗剂干预由博莱霉素诱导的肺纤维化动物模型后纤维化程度明显减轻,以上资料均显示p38MAPK的活化与纤维化的发生、发展密切相关。
Willis等[15]研究表明Vim是一种中间丝蛋白,是间质细胞的典型标记物,α-SMA是一种肌动蛋白,几乎所有的真核细胞都表达肌动蛋白,常用于标记间质细胞。TGF-β1诱导的EMT早期变化就是细胞质内细胞骨架进行重排,表达新的表型蛋白如α-SMA,细胞质内肌丝也从上皮型的角蛋白(cytokeratin,CK)转变为间质细胞的Vim。细胞黏附连接主要成分E-钙黏蛋白的下调或丢失,紧密连接成分的下调,以及间充质细胞特异性的蛋白标记,如纤维连接蛋白、Vim和N-钙黏蛋白的表达上调已成为人们判断EMT发生的重要的分子指标[16]。
青蒿琥酯是抗疟疾的有效单体,近年来研究发现青蒿琥酯除了有很好的抗疟作用外,还具有抗炎、抗肿瘤、抗纤维化等作用[17]。本课题前期研究表明青蒿琥酯可以抑制人胚肺成纤维细胞增殖、促进其凋亡[3-4],且呈剂量依赖性。以上的研究结果为青蒿素防治肺纤维化提供了理论依据。但是目前国内外关于青蒿琥酯防治肺纤维化的研究报道较少,主要是关于其对成纤维细胞增殖的抑制作用,而对青蒿琥酯调控TGF-β1诱导的EMT的作用机制研究少见报道。
本研究稳定传代ATⅡRLE-6TN后,予TGF-β13ng/mL诱导ATⅡ转分化为间质细胞,结果表明,TGF-β1作用于RLE-6TN 24h后,p38MAPK、α-SMA、Vim蛋白均表达增加(P<0.05)。可认为TGF-β1成功诱导RLE-6TN转分化为间质细胞,其可能机制为活化p38MAPK蛋白。给予不同剂量的青蒿琥酯作用于TGF-β1诱导后的RLE-6TN 24h后,信号蛋白p38MAPK及间质细胞标志物α-SMA、Vim蛋白均较TGF-β1组表达明显减少(P<0.01),且呈浓度依赖性。可认为青蒿琥酯对TGF-β1诱导的转分化过程有抑制作用,且随着青蒿琥酯浓度的增加,这种抑制作用逐渐增强。
综上所述,TGF-β1能诱导EMT过程。青蒿琥酯具有抗纤维化作用,其可能机制为抑制p38MAPK的活性从而抑制EMT过程。
[1]陈恒屹,崔社怀.特发性肺间质纤维化发病机制及治疗进展[J].中华肺部疾病杂志:电子版,2009,2(1):58-62.
[2]李飞凤,周建华,胡永斌,等.p38MAPK信号通路调控二氧化硅诱导的人支气管上皮细胞上皮-间质转型[J].工业卫生与职业病,2011,37(2):69-73.
[3]王昌明,张孝飞,谭宁,等.青蒿琥酯对人胚肺成纤维细胞系HFL-I细胞增殖,凋亡的影响及机制[J].山东医药,2009,50(3):33-35.
[4]王昌明,张孝飞,黄岚珍,等.青蒿琥酯诱导人胚肺成纤维细胞凋亡的分子机制研究[J].时珍国医国药,2010,21(11):2837-2838.
[5]孔琪,秦川.肺纤维化的发病机制及关键靶点[J].国外医学:呼吸系统分册,2005,25(5):331-333,336.
[6]石永利,孟凡青.TGF-β1诱导的上皮-间叶转变与肺纤维化[J].临床与实验病理学杂志,2011,27(5):527-529.
[7]Furukawa F,Matsuzaki K,Mori S,et al.p38MAPK mediates fibrogenic signal through Smad3phosphorylation in rat myofibroblasts[J].Hepatology,2003,38(4):879-889.
[8]Emura M.Stem cells of the respiratory epithelium and their in vitro cultivation[J].In Vitro Cell Dev Biol,1997,33(1):3-14.
[9]Uhal BD.Cell cycle kinetics in the alveolar epithelium[J].Am J Physiol,1997,272(6Pt 1):L1031-1045.
[10]Pison U,Wright JR,Hawgood S.Specific binding of surfactant apoprotein SP-A to rat alveolar macrophages[J].Am J Physiol,1992,262(4Pt 1):L412-417.
[11]黄政坤,包建东,戴军,等.p38MAPK抑制剂对急性肺损伤大鼠肺组织核因子-κB表达的影响[J].临床麻醉学杂志,2007,23(4):323-325.
[12]Nieto MA.The snail superfamily of zinc-finger transcription factors[J].Nat Rev Mol Cell Biol,2002,3(3):155-166.
[13]张新志,黄迪,吴锋,等.TGF-β1/p38MAPK 通路对肾间质纤维化影响及抗纤灵冲剂干预机制的实验研究[J].中华中医药杂志,2011,26(2):245-248.
[14]Matsuoka H,Arai T,Mori M,et al.A p38MAPK inhibitor,FR-167653,ameliorates murine bleomycin-induced pulmonary fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2002,283(1):L103-112.
[15]Willis BC,dubois RM,Borok Z.Epithelial origin of myofibroblasts during fibrosis in the lung[J].Proc Am Thorac Soc,2006,3(4):377-382.
[16]宋建国,王冬梅.上皮细胞向间质细胞转变的调控及其与细胞凋亡的关系[J].生命科学,2010,22(11):1147-1153.
[17]杨耀芳.青蒿素及衍生物的药理作用和临床应用[J].中国临床药学杂志,2003,12(4):253-254.

