脂联素及其受体在LIPC抗MIRI大鼠心肌细胞凋亡中的作用*
高建芝,赵林静,张婧君,腾清蕾△
(1.新乡医学院基础医学院法医综合实验室,河南新乡453003;2.新乡医学院基础医学院微生物学教研室,河南新乡453003;3.新乡医学院第三附属医院麻醉科,河南新乡453003)
近年国内外学者研究发现,心肌缺血-再灌注(myocardial ischemia-reperfusion injury,MIRI)引起的心肌损伤与心肌细胞的信号转导通路密切相关。目前临床上许多药物及机械处理大都是通过这些细胞信号转导通路来实现对心肌的保护作用。其中脂联素/脂联素受体1(adiponectin/adiponectin receptor-1,ADP/ADPR1)信号转导通路是近期的研究热点,在促进细胞的生存中发挥着极其重要的作用[1-4]。近年来,通过对ADP的研究证实了其在心血管领域的生物学效应,包括调节促增殖反应、抗凋亡作用和抗感染作用等[5-9]。尽管ADP在MIRI中有抗损伤和抗凋亡的作用,但其是否通过ADP/ADPR1信号通路对损伤的心肌细胞起保护作用及其机制仍不清楚。本研究旨在探讨在体内状态下,ADP/ADPR1信号通路是否在抗MIRI大鼠心肌细胞凋亡中发挥作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 本研究采用SD雄性大鼠30只,体质量220~280g,由河南省实验动物中心提供。
1.1.2 主要试剂 DNA标记、总RNA提取试剂盒和逆转录聚合酶链式反应(RT-PCR)试剂盒均购自北京中杉金桥生物技术有限公司,原位末端缺口标记细胞凋亡检测试剂盒购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 实验分组及处理 实验分为3组,每组10只。MIRI组:结扎冠状动脉左前降支30min再灌注120min;假手术sham组:手术过程与MIRI组相似,仅穿线不结扎冠状动脉左前降支;肢体缺血预适应(limb ischemic preconditioning,LIPC)组:持续阻断股动脉标志5min后,持续再灌注5min,如此反复3次,连续预适应3d,第4d进行MIRI实验,手术操作同MIRI模型。各组实验结束时,迅速摘取每组大鼠心脏缺血区中心部分的心肌组织作为留存的心肌组织标本并放置在无菌无热源冻存管内后置入液氮罐中,随后放入-80℃冰箱中。
1.2.2 RT-PCR检测 采用Trizol一步法提取各组大鼠心肌总RNA进行逆转录。β-actin:上游引物:5′-CAG TAA CAG TCC GCC TAG AA-3′,下 游引物:5′-GAT TAC TGC TCT GGC TCC TA-3′379bp;ADP:上游引物:5′-CTT CCA GAA ACG TGA TCC GAA-3′238bp,下游引物5′-AGT CCT TGC AGG AAG AGT GAC C-3′;ADPR1:上游引物5′-GGT GAA GGT CGG AGT CAA CGG-3′215bp,下游引物5′-GGT CAT GAG TCC TTC CAC GAT-3′。PCR扩增产物用1.5%琼脂糖凝胶进行电离观察,成像。
1.2.3 原位末端缺口标记(TUNEL)法检测心肌细胞凋亡 具体操作步骤完全按照试剂盒说明书进行,以磷酸盐缓冲液(PBS)代替反应液做阴性对照。凋亡的细胞核呈棕黑色或棕色。每只大鼠观察4张切片,每张切片计数5个视野(×400),计算每个视野内凋亡阳性细胞核数占细胞总数百分比,取其平均值为心肌细胞凋亡指数。
1.3 统计学处理 采用SPSS13.0软件处理数据,计量资料以±s表示,组间比较采用单因素方差分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组ADP和ADPR1mRNA检测结果 RT-PCR法测ADP和ADPR1的mRNA表达结果显示,以β-actin为内参,用ADP和ADPR1与β-actin比值代表目的条带强度的相对值,与sham组 ADP(0.74±0.08)和 ADPR1(0.72±0.041)相比,MIRI组 ADP(0.53±0.07)和 ADPR1(0.52±0.016)的mRNA表达明显减少(P<0.05);与 MIRI组相比,LIPC组上调ADP(0.72±0.21)和ADPR1(0.80±0.023)的 mRNA表达(P<0.05),见图1。

图1 各组大鼠心肌组织ADP、ADPR1mRNA的表达情况
2.2 TUNEL法检测各组心肌细胞凋亡的情况 棕色核为凋亡细胞核,计算凋亡指数(AI),结果显示sham组大鼠凋亡心肌细胞较少见;MIRI组大鼠凋亡阳性细胞数目(18.68±2.81)比sham组(2.01±0.44)明显增加(P<0.05);与 MIRI组相比,LIPC组的心肌细胞 AI(8.17±1.93)明显减少(P<0.05),提示LIPC可以减轻MIRI损伤诱导的心肌细胞凋亡,见图2。
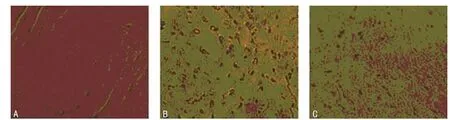
图2 各组大鼠心肌细胞凋亡情况的比较(×400)
3 讨 论
研究表明ADP/ADPR1信号通路参与了抑制炎性反应和抑制细胞凋亡的过程[10-11]。近年又发现 MIRI损伤后,ADP也参与了损伤心肌的修复,增加ADP水平或增加心肌对ADP的敏感性可减轻心肌梗死后左心室的功能障碍[12]。
血清ADP通过血液循环到达心肌组织与ADPR1结合发挥心肌保护作用。至今共发现3种ADP受体:ADPR1、ADPR2和T钙粘蛋白,其分布呈高度组织特异性[13],其中AD-PR1主要分布在心肌。心肌局部ADP统与心肌细胞能量代谢及功能状态密切相关[14]。也有研究表明,血清ADP与ADPR1结合可发挥心肌保护作用,如可以减轻MIRI损伤、心肌重塑和左心室收缩功能障碍[15]。
近年来通过离体结扎冠状动脉前降支造成MIRI模型发现,与野生鼠比较,ADP基因敲除鼠的心脏明显扩大,心肌细胞凋亡数量和心肌纤维化程度明显增加,而新生毛细血管密度显著降低[16]。
肢体LIPC可以合成释放内源性保护物质,然后经复杂的细胞信号转导途径发挥MIRI保护作用。心肌细胞ADP/ADPR1途径的激活就是此保护作用的具体机制之一,可以引起下游一系列靶蛋白的磷酸化,抑制线粒体通透性转换孔(mPTP)的开放,最终减少心肌细胞凋亡[17]。
本实验结果显示,MIRI大鼠心肌ADPR1表达水平下降,限制了ADP发挥其生物学作用,尤其是对MIRI大鼠心肌细胞凋亡的过程起促进作用。MIRI大鼠ADP和ADPR1mRNA的表达明显低于sham组,LIPC组较MIRI组心肌组织ADP和ADPR1mRNA的表达明显增高,以上各组心肌组织ADP mRNA的表达水平与ADPR1mRNA表达水平呈正相关,提示ADP与其受体的结合对心肌组织的保护作用以及LIPC的心脏保护效应是通过上调ADP的水平实现的。
在本实验中LIPC明显抑制了再灌注损伤后的细胞凋亡,且LIPC组中ADP和ADPR1mRNA的表达高于MIRI组,提示LIPC具有抑制细胞凋亡的作用并且可能通过ADP/ADPR1信号通路来抑制心肌细胞凋亡。
[1]Baker JL,Olsen LW,Thorkild TI.Childhood body-mass index and the risk of coronary heart disease in adulthood[J].N Engl J Med,2007,357(23):2329-2337.
[2]Denzel MS,Scimia MC,Zumstein PM,et al.T-cadherin is critical for adiponectin-mediated cardioprotection in mice[J].J Clin Invest,2010,120 (12):4342-4352.
[3]Wijesekara N,Krishnamurthy M,Bhattacharjee A,et al.Adiponectin-induced ERK and Akt phosphorylation protects against pancreatic beta cell apoptosis and increases insulin gene expression and secretion[J].Biol Chem,2010,285(44):33623-33631.
[4]Shibata R,Sato K,Pimentel DR,et al.Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK-and COX-2-dependent mechanisms[J].Nat Med,2005,11(10):1096-1103.
[5]Pyrzak B,Ruminska M,Popko K,et al.Adiponectin as a biomarker of the metabolic syndrome in children and adolescents[J].Eur J Med Res,2010,15(2):147-151.
[6]Tao L,Wang Y,Gao E,et al.Adiponectin:an indispensa-ble molecule in rosiglitazone cardioprotection following myocardial infarction[J].Circ Res,2010,106(2):409-417.
[7]Wang Y,Tao L,Yuan Y,et al.Cardioprotective effect of adiponectin is partially mediated by its AMPK-independent antinitrative action[J].Am J Physiol Endcorinol Metab,2009,297(2):384-391.
[8]Solomon SD,MeMurray JJ,Pfeffer MA,et al.Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma Prevention[J].N Engl J Med,2005,352(11):1071-1080.
[9]Wu L,Qiao H,Li Y,et al.Protective roles of puerarin and Danshensu on acute ischemic myocardial injury in rats[J].Phytomedicine,2007,14(10):652-658.
[10]Shibata R,Izumiya Y,Sato K,et al.Adiponectin protects against the development of systolic dysfunction following myocardial infarction[J].J Mol Cell Cardiol,2007,42(6):1065-1074.
[11]Duda MK,O′Shea KM,Lei B,et al.Dietary supplementationwith omega-3PUFA increases adiponectin and attenuates ventricular remodeling and dysfunction with pressure overload[J].Cardiovasc Res,2007,76(20):303-310.
[12]Kondo K,Shibata R,Unno K,et al.Impact of a single intracoronary administration of adiponectin on myocardial ischemia/reperfusion injury in a pig model[J].Circ Cardiovasc Interv,2010,3(2):166-173.
[13]Ohmori R,Momiyama Y,Kato R,et al.Associations between serum resistin levels and insulin resistance,inflammation,and coronary artery disease[J].J Am Coll Cardiol,2005,46(2):379-380.
[14]汪俊,邵名亮,曹蘅,等.脂联素对大鼠心肌缺血再灌注损伤的保护作用[J].中华心血管病杂志,2010,38(3):252-258.
[15]Smith CC,Yellon DM.Adipocytokines,cardiovascular pathophysiology and myocardial protection[J].PHarmacol Ther,2011,129(2):206-219.
[16]Gonon AT,Widegren U,Bulhak A,et al.Adiponectin protects against myocardial ischaemia-reperfusion injury via AMP-activated protein kinase,Akt and nitric oxide[J].Cardiovasc Res,2008,78 (1):116-122.
[17]Argaud L,Gateau-Roesch O,RaiSky O,et al.Postconditioning inhibits mitochondrial Permeability transition[J].Circulation,2005,111(2):194-197.

