PDTC对大鼠心肌梗死后NF-κB与MMP-2表达及心肌胶原重塑的影响
陈章荣,吴新华△,罗开良,何 泉,杨 瑛,向玉鸾,王小平
(1.大理学院附属医院心内科,云南大理671000;2.重庆医科大学第二附属医院心内科 400010;3.重庆医科大学第一附属医院心内科 400016)
心肌梗死后胶原含量增多和成分的改变等胶原重塑参与了心衰的发生发展,防治病理性胶原重塑成为研究热点。心肌间质胶原重塑过程受基质金属蛋白酶(MMPs)控制。在MMPs的转录调节中,核转录因子κB(NF-κB)信号通路的激活起重要作用,抑制NF-κB活化有可能改善间质胶原重塑[1-2]。二硫代氨基甲酸吡咯烷(PDTC)是一种 NF-κB抑制剂,其能有效地抑制 NF-κB激活[3]。Kumar等[4]用转基因小鼠进行试验发现:PDTC通过抑制NF-κB活性,减轻细胞外基质沉积,改善了心肌重塑。因此,PDTC有可能通过抑制NF-κB活性而改善心肌梗死后间质胶原重塑,本研究将对此进行探讨,现报道如下。
1 材料与方法
1.1 动物模型的建立及给药方法 动物模型制作参照文献[5]的方法,以3.5%水合氯醛腹腔内注射(10mL/kg)麻醉,气管插管,经胸骨左缘第2~4肋开胸,以左冠状动脉主干为标志,在左心耳下方2mm处进针,6/0号丝线结扎左前降支,制作心肌梗死模型。心电图观察两个以上肢体导联上出现ST段上抬大于或等于0.2mV并伴有对应导联变化,同时肉眼观结扎区域变白为造模成功。选择造模成功、术后24h仍存活的大鼠,分为心肌梗死对照(MI)组和PDTC干预(PD)组。另设假手术(SH)组,在相同冠状动脉部位只穿线不结扎。每组动物均为6只,如死亡则补充。PD组手术后24h给予PDTC(Calbiochem公司,美国)80mg·kg-1·d-1腹腔内注射[6],连续28d;MI组及SH组给生理盐水对照。
1.2 超声心动图 术后28d大鼠在处死前均行超声心动图(HP/SONOS 5500多普勒超声仪,探头频率4~10MHz),测定左室舒张末径(LVEDD)、左室舒张末容积(LVEDV)、左室短轴缩短率(FS)、射血分数(EF)。
1.3 标本留取、梗死面积计算、心肌胶原染色及定量分析 处死动物,分离左心室,然后沿左心室长轴分为3份,心底部及心尖部用液氮速冻后置-70℃保存用于逆转录聚合酶链反应(RT-PCR)及蛋白免疫印迹法检测。中间部分切成3mm的薄片,行苦味酸天狼猩红染色。普通光镜下梗死区疤痕组织染成红色为主,非梗死区染成黄色为主。佳能A530摄影后用Image Pro Plus 4.5软件行图像分析,计算梗死面积[7]。计算公式:梗死面积=(疤痕内弧长+疤痕外弧长)/(外周长+内周长)×100%。取天狼猩红染色切片在普通显微镜下随机取5个视野采集非梗死区图像,用Image Pro Plus 4.5图像分析软件测定红色胶原所占组织学面积百分比,取平均值得到总胶原含量。用相同方法在偏振光显微镜下采集非梗死区图像,测定红色和橙黄色的Ⅰ型胶原、绿色的Ⅲ型胶原得到Ⅰ、Ⅲ型胶原含量,计算Ⅰ/Ⅲ型胶原比值。
1.4 半定量RT-PCR检测NF-κB及MMP-2表达水平 TRIzol法提取大鼠心肌组织总RNA。引物由上海博尚生物公司合成,各引物序列见表1。RT-PCR反应体系为50μL,按试剂盒(日本Toyobo公司)说明进行操作。
1.5 蛋白免疫印迹法检测NF-κB蛋白表达 取大鼠心肌组织,按RIPA试剂说明提取心肌总蛋白,BCA-100测定蛋白含量。取40μg蛋白经10% 聚丙烯酰胺凝胶电泳(SDS-PAGE)后转至PVDF膜上,用含5%脱脂奶封闭1h后分别与兔抗鼠NF-κB、MMP-2、β-actin抗体(Santa Cruz公司产品,以 TBS稀释,浓度分别为1∶750、1∶500、1∶500)室温孵育2h;洗膜后与二抗(羊抗兔IgG)室温孵育1h后化学发光显影,凝胶成像系统拍照、扫描分析。

表1 NF-κB、MMP-2和β-actin的RT-PCR引物序列
1.6 统计学处理 采用SPSS12.0软件统计进行分析,计量资料以±s表示,两组之间的比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 超声心动图 与SH组相比,MI组和PD组的LVEDD、LVEDV显著增加,FS和EF显著降低,差异有统计学意义(P<0.01);与 MI组相比,MI组和PD组的LVEDD、LVEDV显著降低,FS和EF显著增加,差异有统计学意义(P<0.01),见表2。
2.2 非梗死区胶原含量 心肌梗死面积在MI组及PD组无显著性差异。与SH组比较,MI组和PD组总胶原、Ⅰ型胶原、Ⅲ型胶原Ⅰ/Ⅲ比值显著增加,差异均有统计学意义(P<0.01);与MI组相比,PD组的总胶原、Ⅰ型胶原、Ⅲ型胶原Ⅰ/Ⅲ比值明显降低,差异有统计学意义(P<0.01),见表3和图1。
2.3 NF-κB及 MMP-2mRNA水平表达 与SH组相比,MI组和PD组NF-κB、MMP-2的mRNA表达量明显增加,差异有统计学意义(P<0.01),与 MI组相比,PD组的mRNA表达明显降低,差异有统计学意义(P<0.01),结果见表4和图2。
2.4 NF-κB及MMP-2蛋白质水平表达 MI组和PD组NF-κB、IL-1β的蛋白质表达量相对于SH组明显增加,差异有统计学意义(P<0.01),PD组与 MI组相比,其蛋白质表达量明显降低,差异有统计学意义(P<0.01),结果表5和图3。
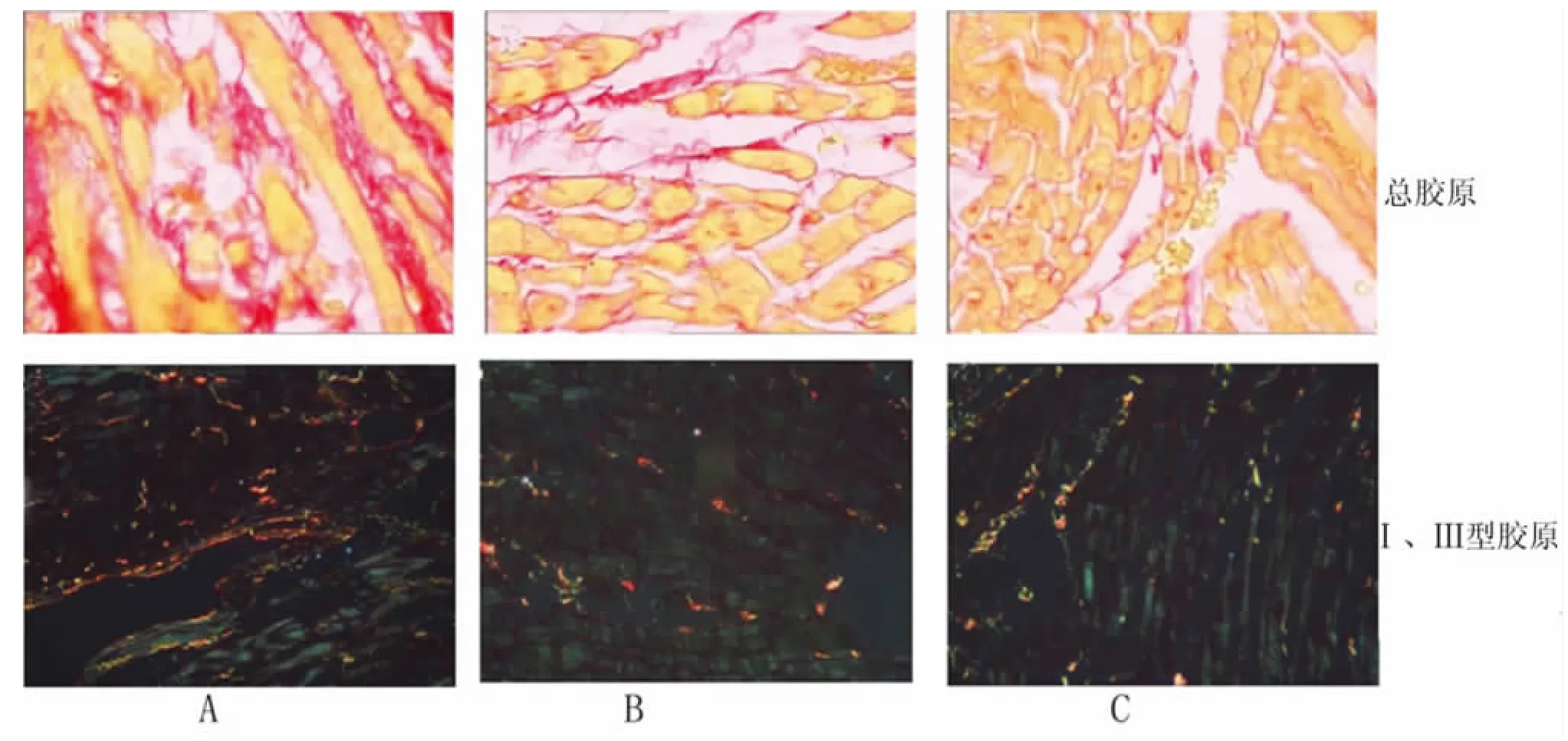
A:MI组;B:PD组;C:SH 组。

表2 各组超声心动图相关指标比较
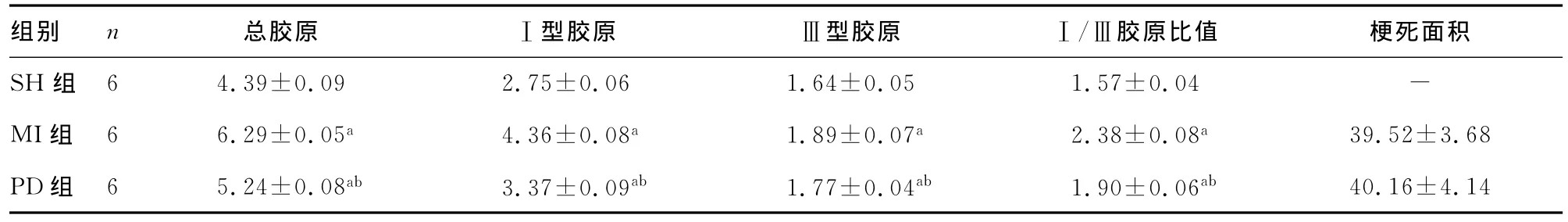
表3 各组胶原含量比较
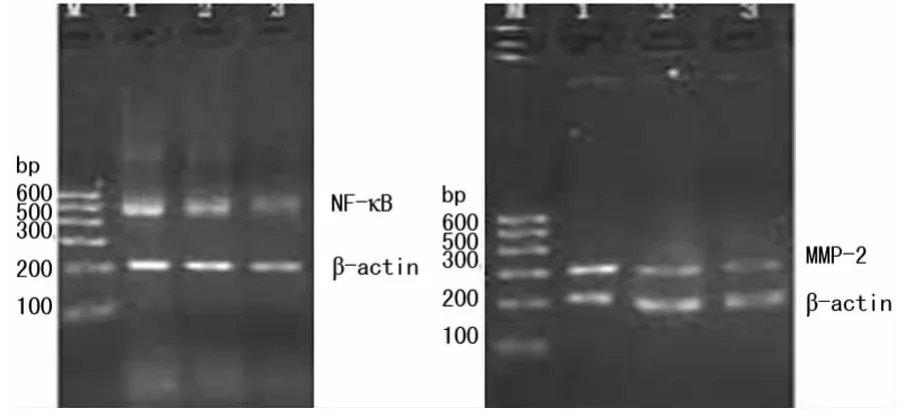
图2 大鼠心肌NF-κB、MMP-2的RT-PCR结果
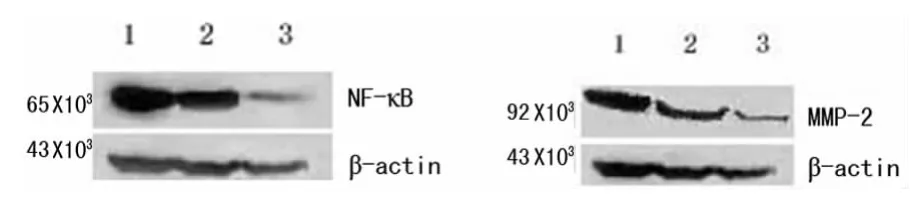
图3 大鼠心肌NF-κB、MMP-2的蛋白质表达
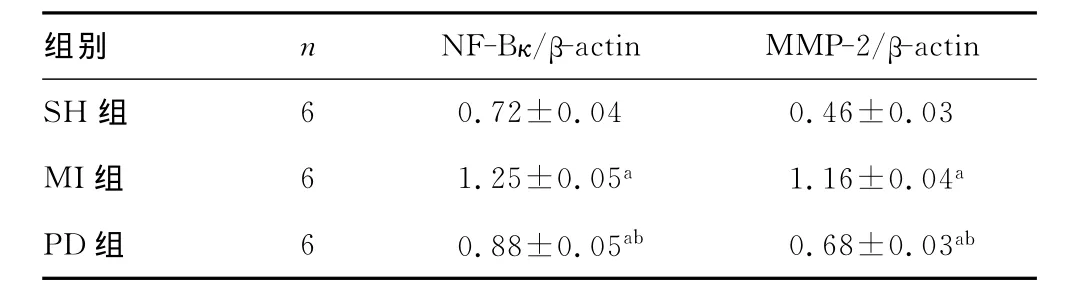
表4 NF-κB、MMP-2的 mRNA表达量

表5 NF-κB、MMP-2蛋白表达量
3 讨 论
本研究中超声心动图结果表明MI组和PD组的LVEDD和LVEDV较SH组增加,FS和EF降低;说明心肌梗死后大鼠心功能指标恶化,大鼠心功能恶化可能与胶原重塑有关。心肌梗死后心肌间质重塑主要胶原沉积,胶原沉积是心肌重塑的重要内容,减少胶原沉积可改善心功能[8]。胶原重塑表现为总胶原、Ⅰ型胶原含量的增多和Ⅰ/Ⅲ型胶原比值增加。本研究通过结扎冠状动脉左前降支制作大鼠心肌梗死模型,采用天狼猩红染色观察心肌非梗死区总胶原、Ⅰ型胶原、Ⅲ型胶原的变化。结果显示MI组非梗死区总胶原和Ⅰ/Ⅲ型胶原比值增多较SH组多,说明心肌梗死后发生胶原重塑。Ⅰ型胶原含量的增多含量增多增加了心肌僵硬度,参与心衰发展。
MMPs是降解细胞外基质成分的最主要蛋白水解系统,与心肌间质胶原重塑有密切关系[9-10]。研究表明 MMPs在心肌梗死发生后即开始激活,并且重塑期间,MMP-2活性和表达均显著增高[11]。陈昭喆等[12]研究也表明,心肌梗死后MMP-2表达增加,并与胶原重塑密切相关。本实验中在MI组和PD组MMP-2增加,同样证实了在心肌重塑过程中存在表达MMPs增高。在MMPs的转录调节中,NF-κB信号通路的激活起重要作用。本研究发现MI组大鼠的NF-κBp65的表达在心肌梗死后4周就已有增加,最近的研究也证明了心肌梗死后存在 NF-κB的激活[13]。Xie等[14]研究表明激活的 NF-κB 能直接刺激MMP-2表达。本研究中MI组MMP-2表达增加与NF-κBp65变化一致,再次说明NF-κBp65调节MMP-2表达。
既然 心 肌梗死后存在 NF-κB激 活,NF-κB通 过 促 进MMPs表达引起胶原重塑是心肌间质重塑的一个重要机制,那么应用NF-κB抑制剂有可能通过此途径改善胶原重塑,改善心功能。为此,本研究应用NF-κB的特异性抑制剂PDTC进行实验,结果显示PDTC干预后心肌梗死大鼠的总胶原、Ⅰ型胶原、Ⅲ型胶原较MI组下降,LVEDD和LVEDV较MI组降低,FS和EF增加,说明PDTC改善了大鼠心肌梗死后间质重塑,改善了心功能。Kumar等[4]用转基因小鼠进行试验发现:PDTC通过抑制NF-κB活性,减轻细胞外基质沉积,改善了心肌重塑。PDTC抑制NF-κB机制为:PDTC能特异性抑制NF-κB亚单位表达或抑制IκB的降解,减少NF-κB的核转为有关[15]。本研究中应用PDTC后NF-κB表达降低,且其下游MMP-2表达相应下降,因此推测PDTC改善大鼠心肌梗死后间质胶原重塑可能与PDTC抑制NF-κB活性,下调MMPs的表达的表达有关。刘晓黎等[16]应用PDTC通过抑制NF-κB活性改善了大鼠的肺血管重塑,降低了肺动脉压。Cau等[1]研究表明,在中应用PDTC通过抑制,下调MMP-2和MMP-9表达改善了肾性高血压大鼠的血管重塑,改善了血管功能。
总之,本研究表明PDTC通过抑制 NF-κB激活,降低MMP-2表达,改善心肌梗死后间质后重塑,改善心功能,PDTC治疗心肌梗死可能成为一个新的研究方向。但是,由于心肌梗死后心肌间质重塑的机制较复杂,PDTC是否具有还有其他通路改善重塑,其安全如何等尚未评价,尚待进一步研究。
[1]Cau SB,Guimaraes DA,Rizzi E,et al.Pyrrolidine dithiocarbamate down-regulates vascular matrix metalloproteinases and ameliorates vascular dysfunction and remodelling in renovascular hypertension[J].Br J Pharmacol,2011,164(2):372-381.
[2]Ben-David D,Livne E,Reznick AZ.The involvement of oxidants and NF-κB in cytokine-induced MMP-9synthesis by bone marrow-derived osteoprogenitor cells[J].Inflamm Res,2012,61(7):673-688.
[3]Zhang JJ,Xu ZM,Chang H,et al.yrrolidine dithiocarbamate attenuates nuclear factor-κB activation,cyclooxygenase-2expression and prostaglandin E2production in human endometriotic epithelial cells[J].Gynecol Obstet Invest,2011,72(3):163-168.
[4]Kumar S,Seqqat R,Chgurupati S,et al.Inhibition of nuclear factorκB regresses cardiac hypertrophy by modulating the expression of extracellular matrix and adhesion molecules[J].Free Radic Biol Med,2011,50(1):206-215.
[5]刘元生,陈运贞.慢性心肌梗死大鼠实验模型[J].重庆医科大学学报,2002,27(2):153-155.
[6]Li Y,Ha T,Gao X,et al.NF-kappaB activation is required for the development of cardiac hypertrophy[J].Am J Physiol Heart Circ Physiol,2004,287(4):1712-1720.
[7]Delyani JA,Robinson EL,Rudolph AE,et al.Effect of a selective aldosterone receptor antagonist in myocardial infarction[J].Am J Physiol Heart Circ Physiol,2001,50(5):647-654.
[8]Rosano JM,Cheheltani R,Wang B,et al.Targeted Delivery of VEGF after a Myocardial Infarction Reduces Colla-gen Deposition and Improves cardiac function[J].Cardiovasc Eng Technol,2012,3(2):237-247.
[9]Aggeli C,Pietri P,Felekos I,et al.Myocardial structure and matrix metalloproteinases[J].Curr Top Med Chem,2012,12(10):1113-1131.
[10]杨永健,张鑫,朱文玲,等.基质金属蛋白酶参与心力衰竭患者心肌细胞外基质的调控[J].中华医学杂志,2006,86(24):1693-1696.
[11]Hojo Y,lkeda U,Ueno S,et al.Expression 0fmatrix metalloproteinases in patients with acute myocardial infarction[J].Jpn Circ J,2001,65(2):71-75.
[12]陈昭喆,宋亚辉,谢秀乐,等.MMP-2对大鼠心肌梗死后心肌Ⅱ、Ⅲ型胶原表达的影响及洛沙坦的干预效应[J].重庆医学,2007,36(12):1173-1174.
[13]Gu Y,Wang X.Artemisinin Attenuates Post-Infarct Myocardial Remodeling by Down-Regulating the NF-κB Pathway[J].Tohoku J Exp Med,2012,227(3):161-170.
[14]Xie Z,Singh M,Singh K,et al.Differential regulation of matrix metalloproteinase-2and-9expression and activity in adult rat cardiac fibroblasts in response to interleukin-1beta[J].J Bio Chem,2004,279(38):39513-39519.
[15]Li YQ,Zhang ZX,Xu YJ,et al.N-Acetyl-L-cysteine and pyrrolidine dithiocarbamate inhibited nuclear factor-kappaB activation in alveolar macrophages by different mechanisms[J].Acta Pharmacol Sin,2006,27(3):339-346.
[16]刘晓黎,王昌明,蒋明,等.核转录因子-κB抑制剂对慢性阻塞性肺疾病气道、肺血管重构的防治作用[J].实用医学杂志,2011,27(4),582-584.

