豆渣膳食纤维及豆渣超微化制品对小鼠肠道菌群的影响
吴占威,胡志和*,邬雄志
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
豆渣膳食纤维及豆渣超微化制品对小鼠肠道菌群的影响
吴占威,胡志和*,邬雄志
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
用豆渣膳食纤维及豆渣超微化制品灌胃BALB/c小鼠,研究其对小鼠肠道菌群的影响。正常对照组用生理盐水进行灌胃,实验组分别以低剂量(0.5g/(kg·d))、高剂量(2.5g/(kg·d))灌胃水溶性膳食纤维(SDF)、非水溶性膳食纤维(IDF)、超微粉碎豆渣(SPO)和螺杆挤压-超微粉碎豆渣(ESPO)。实验期间,每周同一时间取小鼠粪便,采用选择性培养基检测小鼠粪便中乳酸杆菌、双歧杆菌、肠杆菌和肠球菌的数量。结果表明:灌胃的各个阶段,各实验组在灌胃豆渣膳食纤维及豆渣制品后对小鼠的肠道菌群均有明显影响,其中高剂量IDF、低剂量SDF和低剂量的ESPO对小鼠肠道菌群调理作用明显,在增加乳酸杆菌和双歧杆菌的同时,一定程度上抑制了肠球菌和肠杆菌的增长。
豆渣;膳食纤维;肠道菌群;超微粉碎;螺杆挤压-超微粉碎
大豆豆渣是生产豆腐、豆浆等制品的副产物,其含有丰富的膳食纤维,含量高达50%左右[1]。大量的研究证明,膳食纤维具有良好的保健功能,包括促进肠道蠕动、降低血液胆固醇、调节血糖和调节肠道菌群[2-3]。
超微粉碎是一种新型的加工技术,能够通过降低物料的颗粒度改善物料的加工性质,如分散性、可溶性、膨胀性等,同时能够提高原料的适口性[4-5],通过超微粉碎对豆渣处理得到超微化豆渣(SPO)。螺杆挤压技术在食品领域应用普遍,能实现高温、高压、高剪切力的优势组合[6],不仅能够改变原料的加工性质,对色泽、抗氧化性等方面也有较大影响[7]。因两者加工过程方便、简单,利于连续化生产,因此在结合利用时具有较大优势,通过此结合技术处理的豆渣为螺杆挤压-超微化豆渣(ESPO)。
本实验通过碱-酶结合的方法制备了水溶性膳食纤维(SDF)和非水溶性膳食纤维(IDF),利用超微粉碎技术和螺杆挤压-超微粉碎联用技术处理豆渣原料,分别得到SPO和ESPO,并通过灌胃BALB/c小鼠,探讨豆渣膳食纤维及豆渣超微化制品对小鼠肠道菌群的影响,旨在为大豆豆渣的新品开发和豆渣应用提供一定的参考。
1 材料与方法
1.1 材料与试剂
新鲜大豆豆渣 天津立达食品有限公司;GW-Y-2高温α-淀粉酶、XWS-G-1纤维素酶 天津市诺奥科技发展有限公司;P7000胰蛋白酶 美国Sigma公司;M0015葡萄糖淀粉酶 上海江莱生物科技有限公司;TPY 培养基、M17培养基、VRBDA 培养基、叠氮钠-结晶紫-七叶苷培养基 青岛高科园海博生物技术有限公司;(23±1)g的BALB/c雄性小鼠72只 中国人民解放军军事医学科学实验动物中心。
1.2 仪器与设备
CW3-1.5超微粉碎机 烟台慧宝设备制造有限公司;DS32型螺杆膨化机 济南赛信膨化机械有限公司;RE-52旋转蒸发器 上海亚荣生化仪器厂;EMS-8A磁力搅拌器 天津市欧诺仪器仪表有限公司;Scientz-50N冷冻干燥机 宁波新芝生物技术股份有限公司;S20-GT-1F洁净工作台 上海博讯实业有限公司医疗设备厂;HZQ-F160A高低温恒温培养箱 上海一恒科学仪器有限公司。
1.3 方法
1.3.1 常规指标的测定
水分:按照GB 5009.3—2010《食品中水分的测定》测定;脂肪:按照GB 5009.6—2003《食品中脂肪的测定》测定;蛋白质:按照GB 5009.5—2010《食品中蛋白质的测定》测定;灰分:按照GB 5009.4—2010《食品中灰分的测定》测定;膳食纤维:按照GB/T 5009.88—2008 《食品中膳食纤维的测定》测定。
1.3.2 豆渣膳食纤维的制备
将湿豆渣烘干,粉碎后用20倍3%的碱液(m/m)、65℃搅拌浸泡1h,之后在4000r/min条件下离心15min,去除上层液后用热水洗涤残渣,用160目纱网洗涤3次,烘干后粉碎,调节料液比1:45,在50℃、pH5条件下,添加1.7%(酶与底物的质量比)纤维素酶,酶解6h,然后沸水浴灭酶10min,调pH7.0,过滤后将滤渣清洗后冷冻干燥,即为非水溶性膳食纤维(IDF);将滤液浓缩后进行冷冻干燥,即为水溶性膳食纤维(SDF)。
1.3.3 豆渣超微粉碎处理
将豆渣烘干,加入超微粉碎机内粉碎20min,得到超微粉碎豆渣(SPO),其D50(50%颗粒)粒径为8.5μm左右。
1.3.4 豆渣螺杆挤压-超微粉碎联用处理
将豆渣烘干,加入去离子水,调节水分含量为20%,在螺杆转速120r/min,挤压温度为150℃条件下进行螺杆挤压处理,之后进行烘干。将烘干的豆渣加入超微粉碎机内粉碎20min,得到螺杆挤压-超微化豆渣(ESPO),其D50粒径为9.2μm左右。
1.3.5 实验动物及分组
在22℃条件下饲养实验动物,适应性饲养1周后,随机分为9组(每组8只),分为1个对照组和8个实验组。将IDF、SDF、SPO、ESPO 4种物质分别按照低剂量(L) (0.5g/(kg·d))和高剂量(H)(2.5g/(kg·d))灌胃小鼠,对照组用生理盐水进行灌胃,各组小鼠均自由取食和饮水,灌胃周期为28d,之后停止灌胃1周。
1.3.6 粪便样品的采集和肠道微生物的检测
分别于灌胃的第0、7、14、21、28、35天(即停止灌胃1周后)采集小鼠粪便,称取约0.1g左右并置于灭菌试管,加入10mL灭菌的生理盐水,用漩涡振荡器将粪便完全分散,取1mL加入另一试管,加入9mL灭菌生理盐水,混合均匀,如此进行逐级10倍稀释。选择合适的稀释度,采用涂布法将0.2mL菌液均匀涂抹于相应的选择性培养上,在37℃条件下进行培养,其中双歧杆菌和乳酸杆菌需要厌氧环境,并在24h后观察菌落状况并计数,结果以每克粪便中的细菌菌落数的对数值表示(lg(CFU/g))。
1.3.7 结果的统计学处理
所有实验数据采用SPSS17.0统计软件对结果进行分析,处理结果均以±s表示。
2 结果与分析
2.1 豆渣膳食纤维和豆渣超微化制品的基本成分
豆渣膳食纤维、超微粉碎豆渣和螺杆挤压-超微粉碎豆渣的基本成分分析,结果见表1。
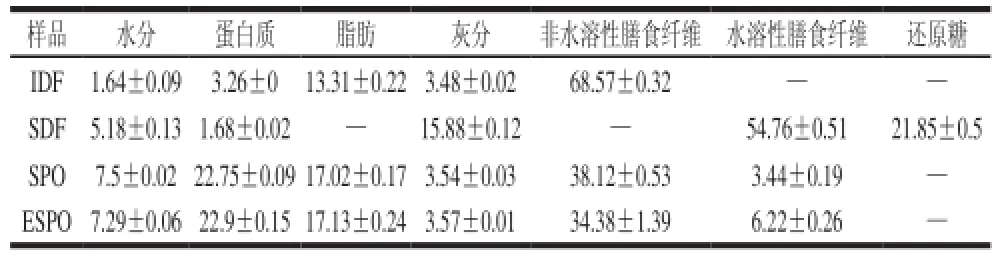
表1 IDF、SDF、SPO和ESPO的基本成分含量Table1 Basic components of IDF, SDF, SPO and ESPO %
2.2 豆渣膳食纤维和豆渣超微化制品对小鼠体质量增加量的影响
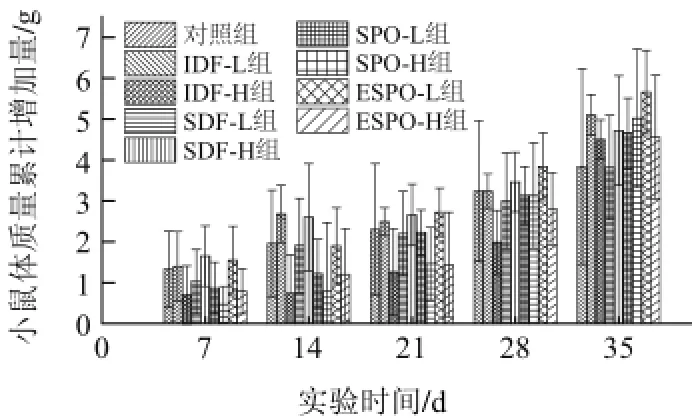
图1 实验组和对照组小鼠在实验期间的体质量累计增加量变化Fig.1 Weight gain of the mice from experimental groups and control group
由图1可知,灌胃生理盐水的对照组和灌胃豆渣膳食纤维及豆渣超微化制品的实验组在灌胃期间(1~4周)体质量增长量差异较大,但总的规律来看,小鼠体质量是增长的。灌胃期间,在体质量累计增加量上,IDF-H组比对照组增加量小,且具有显著差异(P<0.05),其他各组与对照组相比差异不明显(P>0.05)。停止灌胃期间,多数组的小鼠体质量增加速度明显加快,SDF-L组小鼠体质量增加量略低于对照组,其余各实验组的体质量增加量均高于对照组,其中IDF-H、ESPO-L、ESPO-H组与对照组存在显著差异(P<0.05)。由此说明,灌胃操作及灌胃物质对小鼠的进食量和进食规律产生影响,从而影响体质量增加和生长,同时高剂量IDF对小鼠体质量的增加起到抑制作用,可能是由于大量不溶性膳食纤维的摄入减缓了胃排空,延长饱腹感,降低能量密度,并通过限制食物和胃消化酶的作用,减少了小肠对蛋白质、脂肪等营养物质的吸收所致[8-10]。
2.3 豆渣膳食纤维和豆渣超微化制品对小鼠肠道微生物主要菌群特征的影响
2.3.1 豆渣膳食纤维和豆渣超微化制品对小鼠肠道内乳酸杆菌消长规律的影响
按照1.3.5节进行灌胃、饲养小鼠,按照1.3.6节的实验方法采集、处理粪便样品,进行微生物培养检测,结果见图2。
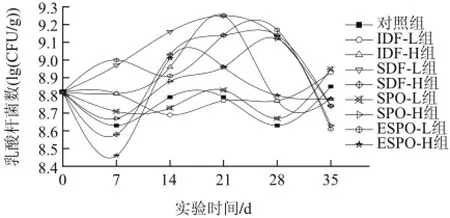
图2 IDF、SDF、SPO和ESPO对小鼠肠道乳酸杆菌的影响Fig.2 Effects of IDF, SDF, SPO and ESPO on intestinal Lactobacillus of the mice
由图2可知,灌胃期间,对照组小鼠肠道乳酸杆菌的数量较为稳定,呈现缓慢波动状态,变化范围为(8.63±0.02)~(8.85±0.05)(lg(CFU/g)),实验组小鼠肠道乳酸杆菌的数量变化差异较大。灌胃至7d时,SDF-L组和ESPO-L组小鼠乳酸杆菌的数量有增加趋势,与对照组相比差异极为显著(P<0.01),但与0d相比差异不明显(P>0.05);IDF-L、IDF-H组肠道乳酸杆菌的数量基本维持不变;SPO-L、SPO-H、SDF-H及ESPO-H 4组与对照组相同,均呈现肠道乳杆菌降低的趋势,其中ESPO-H组与对照组差异显著。灌胃14d后,IDF-H、SDF-L、SDF-H、SPO-H及ESPO-H组乳酸杆菌均有较明显增加,与对照组相比均具有极显著差异(P<0.01);ESPO-L组乳酸杆菌虽然在7~14d内降低,但依然显著高于对照组(P<0.01);SPO-L组增加较小,与对照组差异不明显(P>0.05)。21d时,IDF-L、SPO-L组与对照组差异不显著,其余各组肠道乳酸杆菌均维持在较高水平,并与对照组存在极显著差异(P<0.01)。灌胃至28d时,SDF-H、SPO-H和ESPO-L组小鼠肠道乳酸杆菌达到最大值;IDF-H、SDF-L及ESPO-H组均有不同程度下降,但都显著高于对照组(P<0.01);SPO-L组变化与对照组一致,没有显著差异(P>0.05),说明除IDF-L、SPO-L组外,其余各组灌胃物质均可以在灌胃期间增加肠道乳酸杆菌的数量。停止灌胃1周后,SDF-L、SDF-H、SPO-H及ESPO-L组乳酸杆菌均有极其明显的降低,说明在没有灌胃物质的刺激下,乳酸杆菌的增殖趋势难以维持。
2.3.2 豆渣膳食纤维和豆渣超微化制品对小鼠肠道内双歧杆菌消长规律的影响
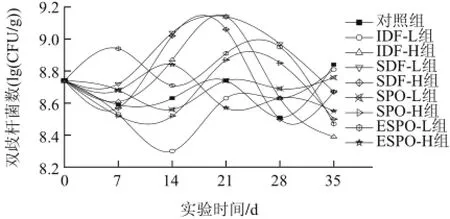
图3 IDF、SDF、SPO和ESPO对小鼠肠道双歧杆菌的影响Fig.3 Effects of IDF, SDF, SPO and ESPO on intestinal Bif i dobacterium
由图3可知,对照组小鼠肠道内双歧杆菌变化趋势与乳酸杆菌的变化趋势基本相同,在(8.51±0.07)~(8.84±0.05)(lg(CFU/g))范围内呈现缓慢波动,实验组小鼠肠道双歧杆菌数量变化范围较大。灌胃至7d时,ESPO-L组小鼠双歧杆菌数量极显著增加(P<0.01),其余各组均出现降低;而SDF-L、SPO-L、ESPO-L及ESPO-H组均极显著高于同时期的对照组(P<0.01),IDF-L组与SPO-H组显著低于对照组(P<0.05),IDF-H、SDF-H组与对照组不存在明显差异(P>0.05)。14d时,IDF-H、SDF-L、SDF-H和ESPO-H组肠道双歧杆菌数量不断增加,并极显著高于对照组(P<0.01),IDF-L、SPO-L及ESPO-L组均出现不同程度的降低,其中IDF-L组肠道双歧杆菌数量降低程度最为剧烈,并极显著低于对照组(P<0.01)。灌胃21d时,IDF-H、SDF-L、SDF-H及SPO-H组均出现灌胃期间肠道双歧杆菌数量的最大值,随后下降,说明此4组的灌胃物质在一定时期内能够促进肠道双歧杆菌的增殖;IDF-L组虽然出现了较大程度的增加,但仍显著低于对照组(P<0.01)。当28d时,IDF-H、SDF-L、SDF-H、SPO-L及SPO-H组双歧杆菌数量出现不同程度的下降,其余3组未出现差异性变化;除SDF-H组外,其余各组均极显著高于对照组(P<0.01)。停止灌胃1周后IDF-H、SDF-L、SPO-H和ESPO-L组双歧杆菌数量出现极显著降低(P<0.01),与对照组存在极显著差异(P<0.01)。
2.3.3 豆渣膳食纤维和豆渣超微化制品对小鼠肠道内肠杆菌消长规律的影响

图4 IDF、SDF、SPO和ESPO对小鼠肠道肠杆菌的影响Fig.4 Effects of IDF, SDF, SPO and ESPO on intestinal Enterobacter
由图4可知,在整个实验期间对照组、ESPO-L组和ESPO-H组小鼠肠杆菌数量均呈现缓慢波动,其他组肠道肠杆菌的数量波动范围较大。灌胃7d时,除SDF-L、SDF-H、SPO-L与ESPO-H组外,其他各组均出现肠道肠杆菌的极显著减少(P<0.01),且IDF-L、IDF-H与SPO-H组降低幅度较大,并与对照组差异极显著(P<0.01)。7d之后,SDF-H、SPO-L与ESPO-L组出现肠杆菌持续降低的趋势;其余各组小鼠肠道肠杆菌均出现增长,至灌胃14d时,均与对照组存在极显著差异(P<0.01)。21d时,SDF-H与SPO-H组极显著高于对照组和起始值(P<0.01),而IDF-L和ESPO-L组虽然肠杆菌数量增高,却依然极显著低于对照组(P<0.01),其余各组均出现降低的趋势。当灌胃28d时,除ESPO-H组外,其余各组均出现降低,且低于起始肠杆菌数量,其中IDF-L、IDF-H、SDF-H与SPO-L组极显著低于对照组。停止灌胃7d后各实验组小鼠肠道肠杆菌变化范围都较小,因此灌胃期间高剂量IDF、低剂量SDF、高剂量SDF与高剂量SPO组小鼠肠杆菌数量的不稳定可能是由于灌胃物质引起,有可能存在增加肠道肠杆菌数量的风险,Montagne等[11]的研究结果同样表明在特定环境中膳食纤维的摄入有可能引起肠道肠杆菌数量的增加。从整体来看,IDF-L与SPO-L组的效果较为明显,能够较为有效地抑制和减少肠道肠杆菌的数量。
2.3.4 豆渣膳食纤维和豆渣超微化制品对小鼠肠道内肠球菌消长规律的影响
由图5可知,灌胃期间,对照组小鼠肠道肠球菌数量波动较为平缓,变化范围为(7.36±0.06)~(7.94±0.04) (lg(CFU/g)),对照组中IDF-H、SDF-H、SPO-H与ESPO-L组肠道肠球菌变化范围较大。灌胃7d时,IDF-H、SDF-H与ESPO-L组肠球菌数量出现较大幅度增加,并与对照组差异极显著(P<0.01);其余各组肠球菌增加量不大。14d时,IDF-H组达到最大值,并出现降低;IDF-L、SDF-H、 SPO-H、ESPO-L与ESPO-H组在7~14d期间出现不同程度的降低,IDF-L与SDF-H组与对照组相比差异极显著(P<0.01)。灌胃21d时,除SDF-H组外各组均极显著低于对照组(P<0.01)。至灌胃28d时,全部实验组小鼠肠道肠球菌数量均极显著低于对照组(P<0.01)。由此可见,除SDF-H组外,各实验组的灌胃物质对于小鼠肠球菌的抑制起到了一定作用,特别是灌胃的中后期这种抑制的趋势更加明显。灌胃停止1周后,IDF-L、SPO-H、ESPO-L及对照组肠球菌数量均出现明显的降低,其余各组变化较为平缓。
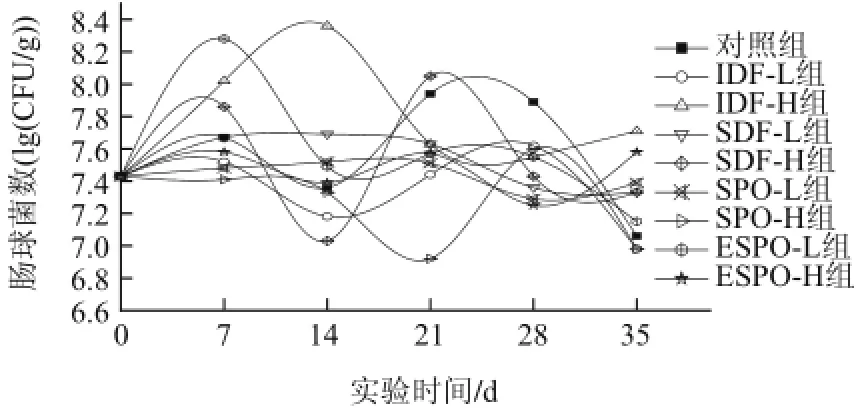
图5 IDF、SDF、SPO和ESPO对小鼠肠道肠球菌的影响Fig.5 Effects of IDF, SDF, SPO and ESPO on intestinal Enterococcus
3 讨 论
肠道菌群是生物体胃肠道功能的重要组成部分,参与生物体的生理、生化、病理和药理的全过程,已经得到广泛关注[12-14]。膳食结构的调整和改变容易引起肠道菌群的数量和菌群优势的变化[15-16]。因此,本实验通过平板培养计数法研究了灌胃豆渣膳食纤维及相关超微化制品对小鼠肠道菌群的影响,不仅证实了豆渣膳食纤维及其豆渣制品对小鼠具有调节肠道菌群的生理作用,同时也为豆渣膳食纤维及相关加工制品的开发提供理论依据。
通过灌胃高剂量IDF、低剂量SDF和低剂量的ESPO组的小鼠,肠道菌群调节作用较为显著,不仅能够促进乳酸杆菌和双歧杆菌的增殖,同时能够在一定程度上影响或抑制肠杆菌及肠球菌的增殖。豆渣膳食纤维在调节生物体肠道菌群的机制上可能有如下几个方面:首先,膳食纤维,特别是水溶性的膳食纤维能够被肠道内微生物分解利用,产生乙酸、丙酸、丁酸等挥发性脂肪酸及CH4等气体[17]。这些发酵产物的生成与多种因素有关,包括膳食构成、膳食纤维的理化性质、纤维的生物利用率、肠保留时间、肠道菌系的构成等。膳食纤维发酵产生的挥发性脂肪酸能够降低结肠环境的pH值,也对结肠的微生物区系起到调节作用,促进了双歧杆菌和乳杆菌的增长,同时抑制了梭菌和大肠杆菌的增殖[18]。其次,不溶性膳食纤维的吸水膨胀加速了粪便的排出,减少其在肠道内的停留时间,通过此过程携带出了大量的细菌及其发酵产物,从而对菌系和微环境的调节也具有作用。
通过成分分析可知,豆渣含膳食纤维约占40%、蛋白质23%、脂肪约为17%。因此,与IDF、SDF相比,SPO与ESPO均不是纯度较高的单一物质。在灌胃豆渣时,膳食纤维可能作为主要的营养物质对肠道菌群进行影响,与此同时豆渣中含有较高含量的蛋白质和脂肪成分,也会影响到肠道菌群的变化。Chung等[19]研究表明,大鼠在饲喂高蛋白日粮6周后肠道肠杆菌和梭菌属数量显著增加。在脂肪对肠道菌群的影响方面,刘雪姬等[20]通过高脂饮食饲喂小鼠表明,高脂饲料可以显著降低肠道乳酸杆菌、双歧杆菌及肠球菌数量,同时使肠杆菌数量显著增加。因此,在本实验中,超微化豆渣灌胃组与膳食纤维灌胃组之所以产生优势菌群及菌群数量上的差异,很可能是由于豆渣中膳食纤维、蛋白质及脂肪的综合作用引起。另外,SPO与ESPO的加工过程不同,ESPO在经过了高温、高压、高剪切力的螺杆挤压过程后,豆渣中不溶性膳食纤维会有一小部分转化为水溶性膳食纤维[21],蛋白质也会在这种剧烈的作用下变性,消化率增加[22],油脂产生部分氧化,造成SPO组与ESPO组小鼠肠道菌系的变化趋势和数量不同。
[1] REDONDO-CUENCA A, VILLANUEVA-SUAMÁJOSE M A, MATEOS-APARICIO I. Soybean seeds and its by-product okara as sources of dietary fibre. Measurement by AOAC and Englyst methods[J]. Food Chemistry, 2008, 108(3): 1099-1105.
[2] 刘成梅, 李资玲, 梁瑞红, 等. 膳食纤维的生理功能与应用现状[J].食品研究与开发, 2006, 27(1): 122-125.
[3] KUTOŠ T, GOLOB T, KAM, et al. Dietary fi bre content of dry and processed beans[J]. Food Chemistry, 2003, 80(2): 231-235.
[4] ZHAO Xiaoyan, AO Qiang, YANG Lianwei, et al. Application of super fi ne pulverization technology in biomaterial industry[J]. Journal of the Taiwan Institute of chemical engineers, 2009, 40(3): 337-343.
[5] ZHAO Xiaoyan, YANG Zaibin, GAI Guosheng, et al. Effect of super fi ne grinding on properties of ginger powder[J]. Journal of Food Engineering, 2009, 91(2): 217-222.
[6] 刘汉文, 黄良策, 陈洪兴, 等. 挤压膨化对豆渣可溶性膳食纤维的影响[J]. 食品科学, 2011, 32(8): 159-162.
[7] SHIH M C,KUO C C, CHIANG W C,et al. Effects of drying and extrusion on colour, chemical composition, antioxidant, activities and mitogenic response of spleen lymphocytes of sweet potatoes[J]. Food Chemistry, 2009, 117(1): 114-121.
[8] SLAVIN J L. Dietary fi ber and body weight[J]. Nutrition, 2005, 21(3): 411-418.
[9] ROLLS B J, ELLO-MARTIN J A, TOHILL B C. What can intervention studies tell us about the relationship between fruit and vegetable consumption and weight management?[J]. Nutrition Reviews, 2004, 62(1): 1-17.
[10] HOWARTH N C, SALTZMAN E, ROBERTS S B. Dietary fiber and weight regulation[J]. Nutr Rev, 2001, 59(5): 129-39.
[11] MONTAGNE L, PLUSKE J R, HAMPSON D J. A review of interactions between dietary fibre and the mucosa, and their consequences on digestive health in young monogastric animals[J]. Animal Feed Science and Technology, 2003, 108: 95-117.
[12] 曹晋宜, 陈庆森, 王友湘, 等. 酪蛋白糖巨肽(CGMP)对小鼠肠道菌群消长规律的影响[J]. 食品科学, 2007, 28(11): 536-540.
[13] 史先振, 朱圣陶, 贺峰, 等. 木糖调节小鼠肠道菌群作用的研究[J].食品科学, 2009, 30(1): 265-267.
[14] SERINO M, LUCHE E, CHABO C, et al. Intestinal microfiora and metabolic diseases[J]. Diabetes & Metabolism, 2009, 35(4): 262-272.
[15] DAVIS C D, MILNER J A. Gastrointestinal microflora, food components and colon cancer prevention[J]. Journal of Nutritional Biochemistry, 2009, 20(10): 743-752.
[16] MONTAGNE L, ARTURO-SCHAAN M, Le FLOC’H N, et al. Effect of sanitary conditions and dietary fibre on the adaptation of gut microbiota after weaning[J]. Livestock Science, 2010, 133(1/3): 113-116.
[17] LIN Bin, GONG Joshua, WANG Qi, et al. in vitro assessment of the effects of dietary fibers on microbial fermentation and communities from large intestinal digesta of pigs[J]. Food Hydrocolloids, 2011, 25: 180-188.
[18] GREEN C J. Fibre in enteral nutrition[J]. Clinical Nutrition, 2001, 20(1): 23-39.
[19] CHUNG K T, FULK G E, SILVERMAN S J. Dietary effects on the composition of fecal flora of rats[J]. Applied Environmental Microbiology, 1977, 33(3): 654-659.
[20] 刘雪姬, 陈庆森, 闫亚丽. 高脂饮食对小鼠肠道菌群的影响[J]. 食品科学, 2011, 32(23): 306-311.
[21] 易文芝, 邓洁红, 汤志才, 等. 挤压膨化提高含豆渣产品可溶性膳食纤维的工艺研究[J]. 粮油食品科技, 2012, 20(1): 12-15.
[22] 沈宁, 杨光, 吴景, 等. 双螺杆挤压对大豆蛋白质的影响[J]. 食品工业科技, 2007, 28(7): 69-71.
Effect of Dietary Fiber from Okara and Superfine Okara on Intestinal Microflora in Mice
WU Zhan-wei,HU Zhi-he*,WU Xiong-zhi
(Tianjin Key Laboratory of Food and Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
In order to explore the effect of dietary fiber from okara and superfine okara on intestinal microflora of mice, BALB/c mice were subjected to gavage treatments. The mice from control group were administered with normal saline, and the mice from experimental groups were administered with soluble dietary fiber (SDF), insoluble dietary fiber (IDF), superfine pulverization okara (SPO) and extrusion-superfine pulverization okara (ESPO), respectively, at low (0.5 g/(kg·d)) and high (2.5 g/(kg·d) doses. During experiments, the selective medium was used to detect the quantity of Lactobacillus, Bif i dobacterium, Enterobacter and Enterococcus in the fecal of mice at the same time every week. The results showed that each treatment group was susceptible to intestinal microflora after administration of dietary fiber from okara and superfine okara at the early stage. The high-dose IDF, low-dose SDF and low-dose ESPO had obvious regulation effect on intestinal microflora of mice with the obvious enhancement of Lactobacillus and Bif i dobacterium, and the suppression of Enterobacter and Enterococcus.
okara;dietary fiber;intestinal microflora;superfine pulverization;extrusion-superfine pulverization
TS209
A
1002-6630(2013)03-0271-05
2012-09-21
吴占威(1985—),男,硕士研究生,研究方向为食品生物技术。E-mail:wuzhanwei1@163.com
*通信作者:胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn

