单癸月桂酸甘油酯的抑菌作用及机理研究
曾哲灵,赵存洋,罗春燕,周 星
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学环境与化学工程学院,江西 南昌 330031;3.南昌大学生命科学与食品工程学院,江西 南昌 330031)
单癸月桂酸甘油酯的抑菌作用及机理研究
曾哲灵1,2,赵存洋1,3,罗春燕1,3,周 星1,3
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学环境与化学工程学院,江西 南昌 330031;3.南昌大学生命科学与食品工程学院,江西 南昌 330031)
对不同质量浓度的单癸月桂酸甘油酯的抑菌活性及其抑菌机理进行研究。采用滤纸片法对单癸月桂酸甘油酯进行细菌敏感性测试;二倍试管稀释法测定最低抑菌质量浓度(MIC);光电比浊法测定抑菌效果;二乙酸荧光素(FDA)染色实验研究其对细菌膜通透性的影响;分光光度法测定细菌胞内蛋白含量、细菌细胞壁脂多糖(LPS)含量、细菌菌悬液离心后上清液中核酸物质含量;原子吸收光谱法测定细菌菌悬液离心后上清液中胞内内容物K+、Ca2+、Mg2+含量;扫描电镜观测细菌表面形态变化。结果表明:单癸月桂酸甘油酯对革兰氏阳性菌及阴性菌均有较好的抑制效果,对金黄色葡萄球菌(G+)、枯草芽孢杆菌(G+)的抑制作用主要是破坏其细胞膜及细胞壁,对大肠杆菌(G―)的抑制作用主要是引起细胞壁外膜LPS外泄。
单癸月桂酸甘油酯;抑菌作用;抑菌机理
单脂肪酸甘油酯,也称脂肪酸单甘油酯,简称单甘油酯。单甘油酯作为食品乳化剂广泛应用于各种食品中[1-2],其使用量约占食品乳化剂的46%[3],包括单长碳链脂肪酸甘油酯、单中碳链脂肪酸甘油酯。单中碳链脂肪酸甘油酯不仅乳化性优于单长碳链脂肪酸甘油酯,还具有水中分散性好、抗菌谱广、抑菌效果好的特点,已被美国食品与药物管理局批准为“一般公认安全化合物”用于食品,德国、日本等国也广泛将其用作食品、药品及化妆品乳化剂和抗菌剂。单中碳链脂肪酸甘油酯包括单辛酸甘油酯、单癸酸甘油酯、单月桂酸甘油酯及其混合物。
近年来,国内外有关脂肪酸和单脂肪酸甘油酯的抑菌性能研究已有文献报道。1977年Kabara[4]、2003年Ruzicka[5]、2010年Bunkova[6]等研究发现,40多种天然脂肪酸及其单甘油酯中,月桂酸和单月桂酸甘油酯的抗菌性能较好。2012年,杨晓韬等[7]研究发现了单辛酯酸甘油酯对肉制品污染菌有良好的抑制效果。研究发现单甘酯、双甘酯可抑制金黄色葡萄球菌的正常繁殖[8]。Bryon[9]、Zhang Hui[10]等研究发现脂肪酸单甘油酯对于食品腐败菌、幽门螺旋杆菌有良好的抑制效果。有关脂肪酸抑菌机理的研究也有文献报道,2010年,Desbois等[11]研究阐述了脂肪酸的抑菌机理,发现脂肪酸的主要抑菌作用位点位于细菌的细胞膜,通过破坏细胞膜上的电子传递系统和氧化磷酸化达到抑菌效果。有关单中碳链脂肪酸甘油酯的抑菌机理研究,至今未见文献报道,抑菌机理尚不清楚。
本实验采用二乙酸荧光素(FDA)染色法测定细胞膜通透性,扫描电镜观测细胞表面形态变化,分光光度法测定细菌胞内蛋白含量、细菌细胞壁脂多糖(LPS)含量、细菌菌悬液离心后上清液中胞外核酸物质含量,原子吸收光谱法测定细菌菌悬液离心后上清液中细菌胞内内容物K+、Ca2+、Mg2+含量,研究以樟树籽仁油为原料制备的单癸月桂酸甘油酯的抑菌作用及机理,为单中碳链脂肪酸甘油酯及其类似化合物抑菌作用和机理的进一步研究及应用提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌种
大肠杆菌Escherichia coil ACCC 0169、金黄色葡萄球菌Staphylococus aureus ACCC 01170、枯草芽孢杆菌Bacillus subtilis ACCC 01336、蜡状芽孢杆菌Bacillus cereus ACCC 0563、鼠伤寒沙门氏杆菌Salmonella typhimurium ACCC 530013、单增李斯特氏菌Listeria monocytogenes ACCC 0356 中国农业微生物菌种保藏中心。
1.1.2 原料与试剂
单癸月桂酸甘油酯(单癸月桂酸甘油酯总含量为94.03%,其中单癸酸甘油酯含量为54.00%、单月桂酸甘油酯含量为40.03%)由南昌大学食品科学与技术国家重点实验室以樟树籽仁油为原料制备;配制牛肉膏蛋白胨培养基、营养肉汤培养基所需试剂和大豆卵磷脂均为食品级;二乙酸荧光素(FDA) 美国Sigma公司。
1.1.3 仪器与设备
765pc型紫外-可见分光光度计 上海光谱仪器有限公司;F-4500型荧光分光光度计 日本Hitachi技术有限公司;AA800型原子吸收光谱仪 美国Perkin Elmer公司;8500场发射扫描电子显微镜 美国Aglient公司。
1.2 方法
1.2.1 单癸月桂酸的含量测定
参照文献[12]进行。
1.2.2 敏感性测试
取配成108CFU/mL的供试菌菌悬液各0.1mL涂布于牛肉膏蛋白胨固体平板上。将直径为6mm的无菌滤纸片分别浸入0.9%的生理盐水(对照组)和质量浓度为5、10、15、20mg/mL单癸月桂酸甘油酯溶液中,取出,并在容器内壁上滤去多余的溶液,然后将滤纸片贴入平板均分的4个小区内。将贴好滤纸片的平板倒置于恒温培养箱中,37 ℃培养24h,取出测定抑菌圈直径。
1.2.3 最低抑菌质量浓度(MIC)的测定
采用琼脂平板稀释法[13]使牛肉膏蛋白胨琼脂平板中单癸月桂酸甘油酯终质量浓度为5、2.5、1.25、0.63、0.32、0.16、0.08、0.04mg/mL,以0.9%无菌生理盐水牛肉膏蛋白胨琼脂平板为实验对照组。用生理盐水将处于对数生长期的供试菌种稀释为104CFU/mL的种子液,取0.1mL种子培养液涂布于药敏平板表面,37℃培养24h,肉眼观察,无细菌菌落形成的最低单癸月桂酸甘油酯稀释质量浓度即为MIC。
1.2.4 抑菌效果的测定
采用光电比浊法[14]测定单癸月桂酸甘油酯的抑菌效果。将一定量处于对数生长期的受试菌种接种至含有MIC的单癸月桂酸甘油酯的肉汤培养基中,使培养基A540nm净增值为0.05左右。37℃、120r/min条件下进行培养,以不含单癸月桂酸甘油酯组为阴性对照组,每隔5h测定A540nm的数值。时刻t时的抑菌率采用下式计算。
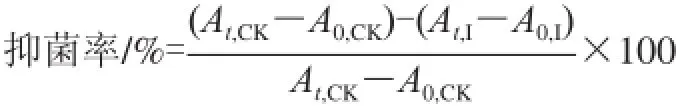
式中:A0,CK和At,CK分别作为对照的样品在培养时间为0h和th的吸光度;A0,I和At,I分别为含单癸月桂酸甘油酯样品在培养时间为0h和th的吸光度。
1.2.5 单癸月桂酸甘油酯对细菌细胞膜通透性的影响
将处于对数生长期的受试菌种悬浮于生理盐水中,使菌浓度为106CFU/mL。以加入MIC的单癸月桂酸甘油酯组为实验组,以不加样品组为对照组,在37℃、120r/min培养12h。分别取实验组与对照组菌悬液6mL于离心管中,4000r/min离心5min,6mL PBS重悬液洗涤2次,离心弃上清液,加入2mg/mL FDA丙酮溶液250μL,常温条件下孵育20min,PBS重悬液洗涤3次,离心弃上清液,加入6mL PBS,用荧光分光光度计测定荧光强度。FDA激发波长为297nm,发射波长为527nm。
1.2.6 单癸月桂酸甘油酯对细菌细胞内容物含量的影响
1.2.6.1 单癸月桂酸甘油酯对细菌蛋白含量的影响
分别取1.2.5节实验组与对照组菌悬液各10mL于离心管中,4000r/min离心5min,弃上清液,收集菌体,10mL PBS重悬液洗涤2次,再离心弃上清液清除去胞外残留蛋白,加入10mL蒸馏水,25kHz、600W超声破碎细胞15min,得胞内蛋白提取液。取2mL蛋白提取液于3mL考马斯亮蓝G-250染液中,静置染色15min,用紫外-可见分光光度计测定A595nm。
1.2.6.2 单癸月桂酸甘油酯对细菌胞外核酸含量的影响
分别取1.2.5节实验组与对照组菌悬液各10mL于离心管中,4000r/min离心5min取上清液,用紫外-可见分光光度计测定A260nm。
1.2.6.3 单癸月桂酸甘油酯对细菌胞外K+、Ca2+、Mg2+含量的影响
分别取1.2.5节实验组与对照组菌悬液10mL于离心管中,4000r/min离心5min取上清液,原子吸收光谱法测定上清液中K+、Ca2+、Mg2+含量。
1.2.7 单癸月桂酸甘油酯对大肠杆菌脂多糖(LPS)含量的影响
采用热酚水提取法[15]提取1.2.5节实验组与对照组大肠杆菌LPS。每1g细菌(4000r/min离心20min收集)加3mL蒸馏水进行悬浮,菌悬液反复冻融3次后,与等量90%苯酚共同水浴至68℃后混合,剧烈搅拌30min,冰浴至2℃,3000r/min离心20min。酚相加等体积无菌蒸馏水洗涤2次,收集酚相于透析袋中,流水透析48h去酚,之后用蒸馏水透析48h以上,至FeCl3检测无酚试剂反应视为透析完成,用50%聚乙二醇20000浓缩至原体积的1/4,即得LPS粗品。1,9-二甲基亚甲蓝(DMB)染色法[16]测定LPS含量,即取0.1mL LPS粗品溶于2.9mL DMB染液中,均匀混合,室温条件下放置10min,用紫外-可见分光光度计测定A550nm。
1.2.8 扫描电镜观察
分别取1.2.5节实验组与对照组菌悬液各2mL于离心管中,4000r/min离心5min收集菌体,用4%戊二醛溶液固定菌体细胞4h,PBS洗涤残留戊二醛,50%、70%、90%、100%梯度体积分数乙醇分别脱水处理菌体15min,将脱水后的菌体涂布于干净的载玻片上,自然风干,喷金于菌体表面,扫描电镜观察菌体表面形态。
2 结果与分析
2.1 单癸月桂酸甘油酯含量测定
单癸月桂酸甘油酯的含量为94.03%,其中单癸酸甘油酯含量为54.00%、单月桂酸甘油酯含量为40.03%。
2.2 敏感性测试
以常见食品致病菌与食品腐败菌为指示菌,进行抑菌敏感性测试。由表1可见,单癸月桂酸甘油酯对革兰氏阳性菌及阴性菌均有抑制作用,其中金黄色葡萄球菌、枯草芽孢杆菌及大肠杆菌对单癸月桂酸甘油酯高度敏感。

表1 常见食品致病菌及腐败菌对单癸月桂酸甘油酯的敏感性Table1 Sensitivity of monolaurin and monocaprin against common food pathogenic bacteria and spoilage bacteria
2.3 单癸月桂酸甘油酯对高度敏感菌的MIC测定

表2 单癸月桂酸甘油酯对高度敏感菌的MIC测定结果Table2 MIC of monolaurin and monocaprin against highly sensitive bacteria
分别以金黄色葡萄球菌、枯草芽孢杆菌及大肠杆菌为指示菌,琼脂平板稀释法测定其MIC。由表2可见,单癸月桂酸甘油酯对金黄色葡萄球菌的MIC为0.32mg/mL,枯草芽孢杆菌的MIC为0.32mg/mL,大肠杆菌的MIC为5mg/mL。
2.4 单癸月桂酸甘油酯的抑菌效果
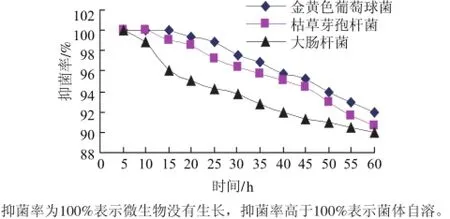
单癸月桂酸甘油酯抑菌效果Fig.1 Bacteriostatic effect of monolaurin and monocaprin图 1
微生物适应性强,能通过自身代谢途径将外来物分解而产生抗药性。因此,药物抗微生物代谢能力,抑制时效性是衡量抑菌效果的一个重要指标。由图1可见,单癸月桂酸甘油酯对金黄色葡萄球菌、枯草芽孢杆菌及大肠杆菌60h的后抑制率保持在90%以上。因此,单癸月桂酸甘油酯抗微生物代谢能力强,抑菌时效好。
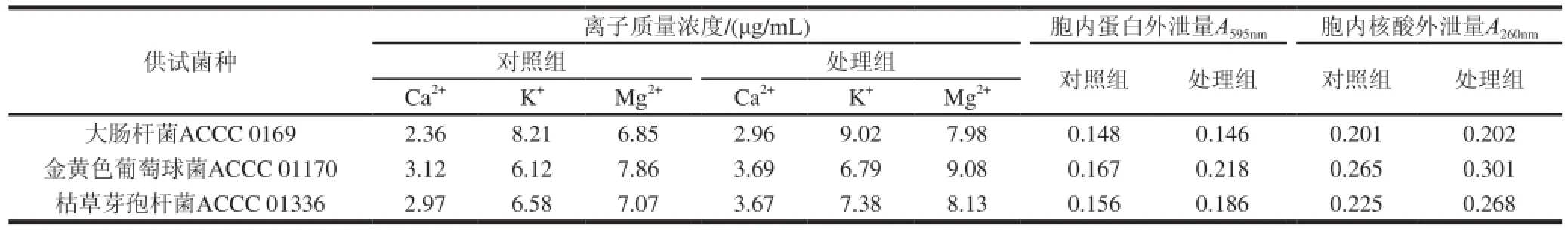
表3 单癸月桂酸甘油酯对细菌内容物泄露的影响Table3 Effect of monolaurin and monocaprin on leakage of substances in cells
2.5 单癸月桂酸甘油酯对细菌细胞膜通透性的影响
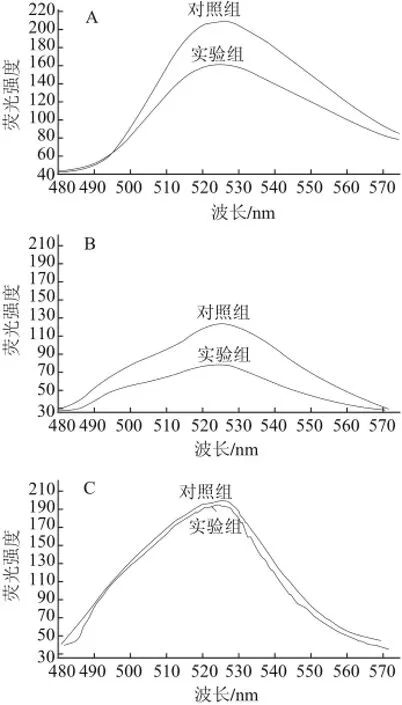
图2 单癸月桂酸甘油酯对金黄色葡萄球菌(A)、枯草芽孢杆菌(B)和大肠杆菌(C)FDA的荧光强度影响Fig.2 Effect of monolaurin and monocaprin on FDA fluorescence intensity of Staphylococcus aureus (A), Bacillus subtilis (B), and Escherichia coli (C)
FDA是一种不带电荷的脂质性分子,容易透过细胞膜,其本身不发荧光,但进入细胞以后可被细胞内非特异性酯酶水解,释放出能发黄绿色荧光的荧光素分子。如果细胞膜完整,这些荧光素分子滞留在活细胞中,使细胞发出黄绿色荧光。如果细胞膜受损伤,荧光素分子将从细胞内流失,细胞不再发黄绿色荧光。通过测定FDA荧光强度的变化可反映细胞膜完整性、通透性,FDA荧光强度低表明细胞内细胞膜完整性破坏,荧光从胞浆中外漏。由图2A、B可见,经单癸月桂酸甘油酯处理后的金黄色葡萄球菌、枯草芽孢杆菌荧光强度明显降低,说明其细胞膜受到破坏、通透性增加。由图2C可见,经单癸月桂酸甘油酯处理后的大肠杆菌荧光强度几乎没有改变,表明其细胞膜结构完整、通透性没有变化,单癸月桂酸甘油酯对大肠杆菌的作用位点可能不在细胞膜上。
2.6 单癸月桂酸甘油酯对细菌内容物泄露的影响
用分光光度法分别测定单癸月桂酸甘油酯对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌胞内蛋白、核酸物质及金属离子泄露的影响。由表3可见,经处理后的金黄色葡萄球菌、枯草芽孢杆菌胞内蛋白含量明显降低,上清液中核酸物质、Ca2+、Mg2+、K+含量明显增加,表明其胞内蛋白、核酸物质、金属离子已通过细胞膜泄露至胞外;经处理后的大肠杆菌的胞内蛋白、上清液中核酸物质均无明显变化,上清液中Ca2+、Mg2+、K+含量明显增加,表明其并未引起大肠杆菌胞内蛋白、核酸物质大分子的泄露。
2.7 单癸月桂酸甘油酯对大肠杆菌LPS含量的影响
LPS是革兰氏阴性菌细胞壁的主要组成成分,是其外膜的特有结构。外膜中的LPS对控制细胞通透性、提高Mg2+等阳离子浓度、维持细胞正常功能与代谢起到至关重要的作用[17-18]。分光光度法比较了处理前后大肠杆菌LPS含量。结果显示,处理组A550nm为0.126,对照组A550nm为0.394,处理组A550nm比对照组减少了0.268。
2.8 扫描电镜观察结果
图3中对照组金黄色葡萄球菌边缘整齐、形状规则,图3D中的实验组金黄色葡萄球菌边缘模糊并发生了形变。图3B中对照组枯草芽孢杆菌边缘光滑、菌体饱满,图3E中实验组菌体已经明显干瘪了,将要融化破碎。图3C、F中的对照组与实验组大肠杆菌表面未发现有明显变化。

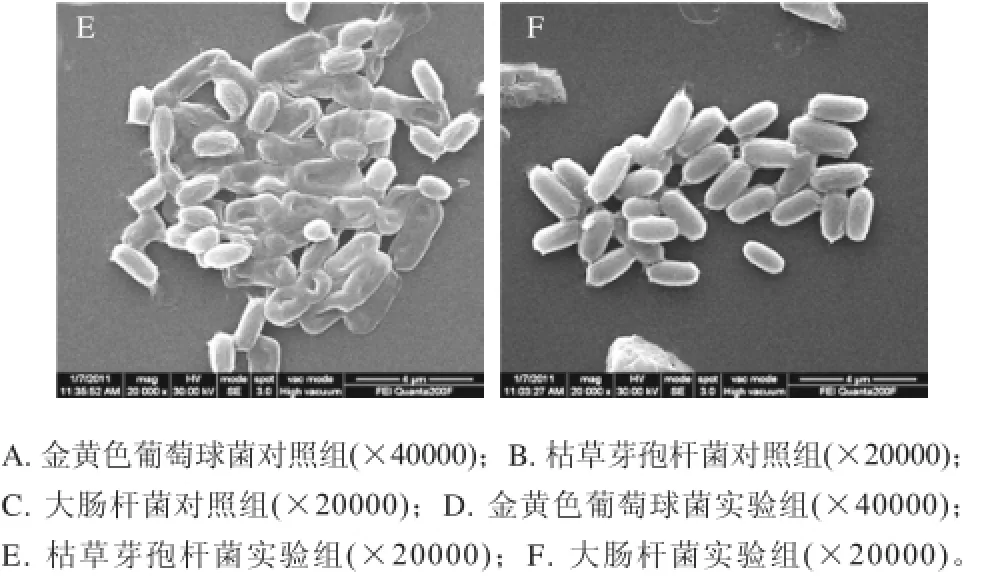
图3 扫描电镜观察细菌表面结果Fig.3 Results of SEM images
3 讨 论
从抑菌活性看,单癸月桂酸甘油酯对革兰氏阳性菌与革兰氏阴性菌均有高效的抑制作用,但对革兰氏阳性菌的抑制作用要优于革兰氏阴性菌,这可能是因为细胞壁结构存在差异,革兰氏阴性菌细胞壁有一层外膜,这层外膜能与一些外来物质发生特异性结合,从而对菌体起到一定的保护作用。
一般认为,食品防腐剂对微生物的抑制作用是通过影响细胞亚结构而实现的,这些亚结构包括细胞壁、细胞膜、与代谢有关的酶、蛋白质合成系统及遗传物质。由于每个亚结构对菌体而言都是必需的,因此食品防腐剂只要作用于其中的一个亚结构便能达到杀菌或抑菌的目的[19]。
根据经单癸月桂酸甘油酯处理后的金黄色葡萄球菌(G+)、枯草芽孢杆菌(G+)菌体荧光强度降低,胞内蛋白含量减少,上清液中核酸物质、Ca2+、Mg2+、K+含量增加,扫描电镜观察菌体有明显变形或破碎的现象,推测单癸月桂酸甘油酯对G+菌的抑制作用主要是破坏菌体的细胞壁及细胞膜。根据经单癸月桂酸甘油酯处理后的大肠杆菌(G―)菌体荧光强度几乎不变,胞内蛋白含量、上清液中核酸物质含量变化不明显,上清液中Ca2+、Mg2+、K+含量增加,LPS含量减少,扫描电镜观察菌体无明显表面形态变化,推测单癸月桂酸甘油酯对G—菌的抑制作用主要是引起细胞壁外膜LPS外泄。
[1] 李爱华. 浅谈我国食品添加剂的现状和发展趋势[J]. 食品科学, 1995, 16(10): 5-9.
[2] 刘梅森, 何唯平. 单甘酯系列复合乳化剂对软冰淇淋品质影响的研究[J]. 食品科学, 2007, 28(5): 32-36.
[3] 张万福, 译. 食品乳化剂[M]. 北京: 中国轻工业出版社, 1993: 110-111.
[4] KABARA J J, VRABLE R. Antimicrobial lipids: natural and synthetic fatty acids and monoglycerides[J]. Chemistry and Materials Science, 1977, 12(9): 753-759.
[5] RUZICKA J, VELCLVOA K, JANIS R, et al. Antimicrobial effects of 1-monoacylglycerols prepared by catalytic reaction of glycidol with fatty acids[J]. European Food Research and Technology, 2003, 217(4): 329-331.
[6] BUNKOVA L, KREJCI J, JANIS R, et al. Influence of monoacylglycerols on growth inhibition of micromycetes in vitro and on bread[J]. European Journal of Lipid Science and Technology, 2010, 112(2): 173-179.
[7] 杨晓韬, 李春, 周晓宏. 7种食品防腐剂对肉制品污染微生物的抑菌效果比较研究[J]. 食品科学, 2012, 33(11): 12-16.
[8] 谢丽斯, 张文艳, 许佳, 等. 食品添加剂对食源性金黄色葡萄球菌生物被膜的影响[J]. 食品科学, 2012, 33(17): 154-157.
[9] BRYON W P, ROSANNE P B, LORNA L F. Susceptibility of Helicobacter pylori to bactericidal properties of medium-chain monoglycerides and free fatty acids[J]. Antimicrobial Agents and Chemotherapy, 1996, 40(2): 302-306.
[10] ZHANG Hui, WEI Hewen, CUI Yinan, et al. Antibacterial interactions of monolaurin with commonly used antimicrobials and food components[J]. Food Microbiology and Safety, 2009, 74(7): 418-421.
[11] DESBOIS A P, SMITH V J. Antibacterial free fatty acids: activities, mechanisms of action and biotechnological potential[J]. Applied Microbiology and Biotechnology, 2010, 85(6): 1629-1642.
[12] 彭超, 曾哲灵, 戴志凯, 等. 酸性离子液体催化樟树籽仁油和甘油合成单甘酯[J]. 中国油脂, 2010, 35(8): 61-65.
[13] 朱亚芳, 赵浩如. 中药体外抑制痤疮丙酸杆菌的活性测定[J]. 药学与临床研究, 2009, 17(3): 224-226.
[14] 欧光南, 周常义, 高芳, 等. 反丁烯二酸芳香醇酯的合成及抑菌活性研究[J]. 食品科学, 2006, 27(11): 207-209.
[15] 潘劲草, 黄志成, 余文炳. 肠出血性大肠杆菌O157:H7 LPS抗原的制备及鉴定[J]. 中国人兽共患病杂志, 1999(15): 59-61.
[16] 张运涛, 顾谦群, 方玉春, 等. 分光光度法测定海洋河弧菌510脂多糖[J]. 青岛海洋大学学报, 2003, 33(3): 355-360.
[17] 蒋建新, 姚咏明, 郑江. 细菌内毒素基础与临床[M]. 北京: 人民军医出版社, 2004: 16-200.
[18] GRONOW S, BMDE H. Lipopolysaccharide biosynthesis: which steps do bacteria need to survive?[J]. Journal of Endotoxin Research, 200l, 7(1): 3-23.
[19] RUSSELL N J, GOULD G W. Food preservatives[M]. New York: Blackie, 1991.
Antibacterial Function and Mechanism of Monolaurin and Monocaprin
ZENG Zhe-ling1,2,ZHAO Cun-yang1,3,LUO Chun-yan1,3,ZHOU Xing1,3
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. School of Environmental and Chemical Engineering, Nanchang University, Nanchang 330031, China;3. School of Life Science and Food Engineering, Nanchang University, Nanchang 330031, China)
The objective of this study is to explore the antimicrobial activity and mechanism of monoglycerides containing monolaurin and monocaprin. Paper disc method was used to evaluate bacterial susceptibility of monolaurin and monocaprin. Two-fold dilution method was used to test minimum inhibitory concentration (MIC), and photoelectricity turbidimetry method was used to determine antibacterial efficacy. Orescein diacetate (FDA) was used as fluorescent indicator to reflect the membrane permeability of tested bacteria after treatment with monolaurin and monocaprin. Spectropbotometric method was used to test the leakage of internal substances of tested bacteria, such as protein, nucleic acid, lipopolysaccharide, K+, Ca2+and Mg2+. The change of cell surface was characterized using scanning electron microscope. Results showed that gram-positive and gram-positive bacteria were susceptive to monolaurin and monocaprin. The activities of monolaurin and monocaprin against Bacillus subtilis (G+) and Staphylococus aureus (G+) resulted from the destruction of cell wall and membrane caused by monolaurin and monocaprin. On the contrary, its antibacterial activity against Escherichia coil (G—) resulted from the leakage of lipopolysaccharide in cell walls.
monolaurin and monocaprin;antibacterial activity;antibacterial mechanism
TS202.3
A
1002-6630(2013)03-0070-05
2011-11-11
江西省国际科技合作项目(2010EHB02500);国家中小企业创新基金项目(11C26213604985);国家国际科技合作专项(2011DFA32770);江西省自然科学基金项目(20114BAB204018)
曾哲灵(1965—),男,教授,博士,研究方向为食物(含生物质)资源的开发与利用。E-mail:zlzengjx@163.com

