替米沙坦对大鼠脑缺血后核因子κB表达的影响
祝春华,温 雅,王力娜,马悦霞
(河北医科大学第二医院神经内科,河北石家庄050000)
·论 著·
替米沙坦对大鼠脑缺血后核因子κB表达的影响
祝春华,温 雅,王力娜,马悦霞
(河北医科大学第二医院神经内科,河北石家庄050000)
目的探讨抗高血压药物替米沙坦对大鼠脑梗死的治疗作用及其机制。方法线栓法建立大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)大鼠模型。替米沙坦治疗后,观察其神经功能评分、脑梗死体积和患侧脑水肿,采用免疫组织化学法、Western blot和实时荧光定量聚合酶链反应检测核因子κB(nuclear factorκB,NF-κB)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptors,PPARγ)基因和蛋白变化。结果MCAO后24 h,与假手术组比较,替米沙坦能明显改善神经功能评分、减轻脑水肿、减小梗死体积,同时显著下调NF-κB,上调PPARγ的蛋白表达和基因表达;与GW9662(特异性阻断剂)联合干预,上述作用消失。结论替米沙坦能保护脑缺血性脑组织,其作用机制可能是激活PPARγ、抑制NF-κB表达。
脑缺血;NF-κB;过氧化物酶体增殖物激活受体
替米沙坦(telmisartan)是临床常用的血管紧张素受体阻断剂类抗高血压药物。高血压病是脑血管病患者的主要危险因素,近年研究[1-2]发现,替米沙坦不仅通过调控血压保护重要的靶器官——脑组织,还对脑缺血具有良好的抗炎和脑保护作用,能够显著减轻脑梗死体积、脑水肿和继发性脑损伤,其机制多与过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptors,PPARγ)有关。如果替米沙坦在调整血压的同时,对脑梗死组织有保护作用,达到一举两得的效果,将有利于临床治疗。核因子κB(nuclear factorκB,NF-κB)在介导神经细胞凋亡、炎症反应等方面的作用至关重要[3-7]。因此,本研究以大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型为研究对象,以替米沙坦进行
干预治疗,通过观察替米沙坦对脑梗死大鼠的神经功能评分、减轻脑水肿、减小梗死体积以及NF-κB和PPARγ表达的影响,探讨替米沙坦对脑梗死治疗作用及机制。
1 资料与方法
1.1 动物与试剂
1.1.1 实验动物:成年健康雄性清洁级SD大鼠90只,体质量250~280g,由河北省实验动物中心提供。
1.1.2 试剂和仪器:兔抗PPARγ多克隆抗体(美国Santa Craz);兔抗NF-κBp65多克隆抗体(美国Santa Craz);替米沙坦(德国Boehringer-Ingelheim);GW9662(美国Sigma);DYY-12型电泳仪(北京六一仪器厂);Synergy-HT多功能酶标仪(美国Bio-Tek);PCR扩增仪(德国Eppendorf);荧光定量PCR仪(7500)(美国ABI)。
1.1.3 引物设计与合成:上海生物工程公司合成,引物序列如下,PPARγ,上游5′-GAAGACATCCCGTTCACAAGA-3′,下游5′-TGAT GCTTTATCCCCACAGAC-3′,扩增全长207 bp;NF-κB,上游5′-AGCTCCTGTCCCAGTTCTAGC-3′,下游5′-ACTCCTGGGTCTGTGTTGTTG-3′,扩增全长168bp;β-actin,上游5′-GGAGATTACTGCCCTGGCTCC-TA-3′,下游5′-GACTCATCGTACTCCTGCTTGCTG-3′,扩增全长150bp。
1.2 实验方法
1.2.1 动物分组和模型:随机将90只SD大鼠分为假手术组、溶剂对照组、替米沙坦组、替米沙坦+GW9662组。采用本实验室成熟的线栓法建立持续性大鼠右侧MCAO模型[3-4]。替米沙坦组30mg/kg于MCAO手术前1h灌胃给药;假手术组和对照组给予等体积生理盐水;替米沙坦+GW9662组于MCAO手术前1h以灌胃方式给予30mg/kg替米沙坦,术后立即腹腔注射4mg/kg GW9662。
1.2.2 神经功能缺失评分:将各组大鼠分别于相应时间点进行神经功能评分后断头处死,采用改良的Longa分级法单盲进行行为学评分。0分,无缺陷;1级,不能伸展对侧前肢;2分,对侧前肢屈曲;3分,轻度向对侧转圈;4分,严重向对侧转圈;5分,向对侧跌倒(n=6)。
1.2.3 脑组织含水量测定:在相应时间点断头取脑,冠状切开去除额极,双侧取约2mm厚的脑组织,采用干湿法测定脑含水量[(脑组织湿质量-脑组织干质量)/湿质量×100%](n=8)。
1.2.4 脑梗死体积测定:在相应时间断头取脑,均匀切成5片冠状切片,浸入2%TTC溶液,37℃染色30min后,4%多聚甲醛中固定24h。梗死体积百分比=(矫正梗死体积/非缺血侧半球体积)×100%(n=6)。
1.2.5 NF-κB和PPARγ蛋白和基因表达:采用免疫组织化学法(n=3)和Western blotting(n=4)检测NF-κB和PPARγ蛋白表达。采用实时荧光定量PCR(n=3)检测NF-κB和PPARγmRNA表达。
1.3 统计学方法:应用SPSS11.0统计软件进行数据分析,计量资料以±s表示,多组数据比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 替米沙坦改善大鼠MCAO后的神经功能:溶剂对照组与假手术组比较,MCAO后有明显的神经功能障碍。替米沙坦组与溶剂对照组和替米沙坦+GW9662组比较,神经功能障碍明显改善(P<0.05);替米沙坦+GW9662组与溶剂对照组比较差异有统计学意义。见表1。
表1 各实验组术后24h神经功能缺失评分比较Table 1 Neurological deficits at 24h after operation in different experimental groups ±s,scores)
*P<0.05 vs Sham group #P<0.05 vs vehicle group and telmisartan+GW9662 group by q test
Groups Neurological deficits Sham 0 Vehicle 4.00±0.89*Telmisartan 2.50±1.05*#Telmisartan+GW9662 3.83±0.75*
2.2 替米沙坦显著减轻患侧脑水肿:术后24h,与假手术组比较,其余3组患侧脑组织有明显的水肿(P<0.05);替米沙坦组与溶剂对照组和替米沙坦+GW9662组比较,患侧脑水肿明显减轻(P<0.05)。4组大鼠对侧脑组织含水量差异无统计学意义。见表2。
表2 各实验组术后24h脑组织含水量比较Table 2 Brain water content of ipsilateral and contrallateral hem isphere at 24h after operation in different experimental groups ±s,%)
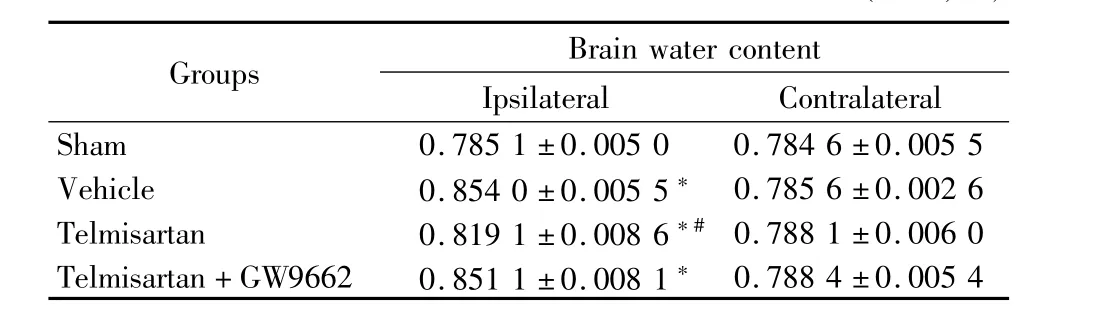
表2 各实验组术后24h脑组织含水量比较Table 2 Brain water content of ipsilateral and contrallateral hem isphere at 24h after operation in different experimental groups ±s,%)
*P<0.05 vs sham group #P<0.05 vs vehicle group and telmisartan+GW9662 group by q test
Groups Brain water content Ipsilateral Contralateral 0.788 4±0.005 4 Sham 0.785 1±0.005 0 0.784 6±0.005 5 Vehicle 0.854 0±0.005 5*0.785 6±0.002 6 Telmisartan 0.819 1±0.008 6*#0.788 1±0.006 0 Telmisartan+GW9662 0.851 1±0.008 1*
2.3 替米沙坦显著减小脑梗死体积:假手术组未见缺血病灶,溶剂对照组、替米沙坦组和替米沙坦+GW9662组均有大小不等的缺血性病灶(P<0.05)。替米沙坦组与溶剂对照组和替米沙坦+GW9662组比较,缺血性病灶体积明显减小(P<0.05)。见表3。
表3 各实验组术后24h脑梗死体积比较Table 3 Infarct volume at 24h after operation in different experimental groups ±s,%)
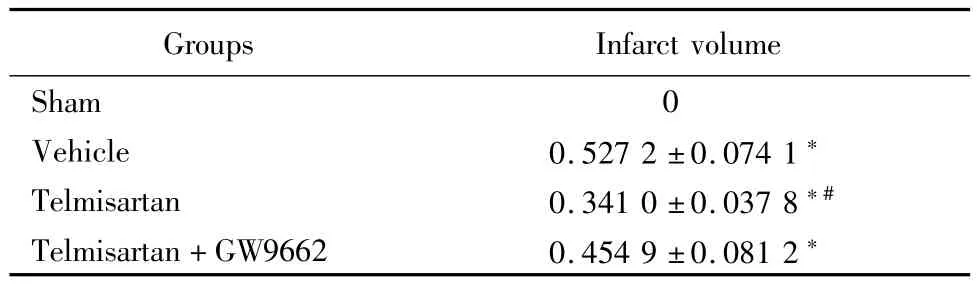
表3 各实验组术后24h脑梗死体积比较Table 3 Infarct volume at 24h after operation in different experimental groups ±s,%)
*P<0.05 vs sham group #P<0.05 vs vehicle group and telmisartan+GW9662 group by q test
Groups Infarct volume Sham 0 Vehicle 0.527 2±0.074 1*Telmisartan 0.341 0±0.037 8*#Telmisartan+GW9662 0.454 9±0.081 2*
2.4 替米沙坦调节NF-κB蛋白和基因表达:免疫组织化学法显示,与假手术组比较,溶剂对照组和替米沙坦+GW9662组PPARγ阳性细胞数明显减少(P<0.05),NF-κB阳性细胞数明显增多(P<0.05);替米沙坦组与溶剂对照组和替米沙坦+GW9662组比较,PPARγ阳性细胞数明显增多(P<0.05),NF-κB阳性细胞数明显减少(P<0.05)。见表4。
Western blot和实时定量PCR结果显示,与假手术组比较,溶剂对照组和替米沙坦+GW9662组NF-κB蛋白以及基因表达明显上调(P<0.05),PPARγ表达明显下降;替米沙坦组与溶剂对照组和替米沙坦+GW9662组比较,NF-κB蛋白以及基因表达明显下调,PPARγ表达明显上调(P<0.05)。见表5,6。
表4 替米沙坦调节NF-κB和PPARγ表达阳性细胞数Table 4 Telm isartan regulates NF-κB and PPARγpositive cell number ±s,%)
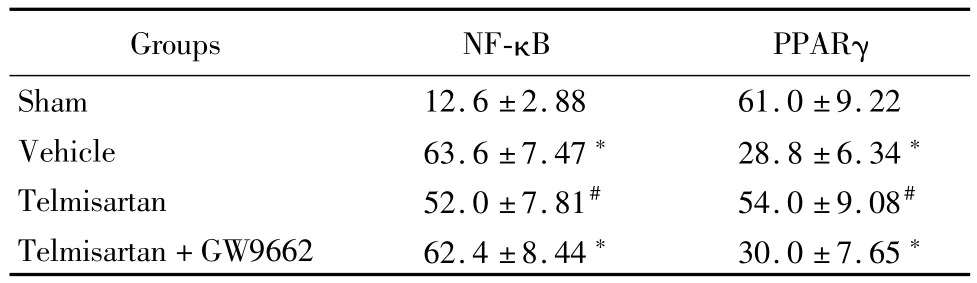
表4 替米沙坦调节NF-κB和PPARγ表达阳性细胞数Table 4 Telm isartan regulates NF-κB and PPARγpositive cell number ±s,%)
*P<0.05 vs sham group #P<0.05 vs vehicle group and telmisartan+GW9662 group by q testPPARγ:peroxisome proliferator-activated receptors;NF-κB:nuclear factor κB
Groups NF-κB PPARγ Sham 12.6±2.88 61.0±9.22 Vehicle 63.6±7.47*28.8±6.34*Telmisartan 52.0±7.81#54.0±9.08#Telmisartan+GW9662 62.4±8.44*30.0±7.65*
表5 替米沙坦调节NF-κB和PPARγ蛋白表达Table 5 Telm isartan regulates NF-κB and PPARγprotein expression ±s,%)
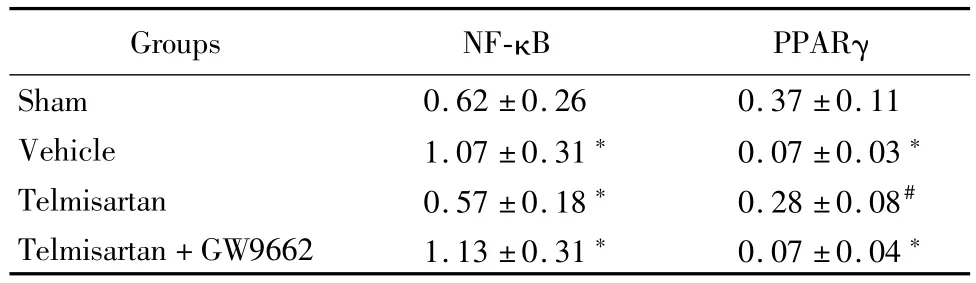
表5 替米沙坦调节NF-κB和PPARγ蛋白表达Table 5 Telm isartan regulates NF-κB and PPARγprotein expression ±s,%)
*P<0.05 vs sham group #P<0.05 vs vehicle group and telmisartan+GW9662 group by q testPPARγ:peroxisome proliferator-activated receptors;NF-κB:nuclear factor κB
Groups NF-κB PPARγ Sham 0.62±0.26 0.37±0.11 Vehicle 1.07±0.31*0.07±0.03*Telmisartan 0.57±0.18*0.28±0.08#Telmisartan+GW9662 1.13±0.31*0.07±0.04*
表6 替米沙坦调节NF-κB和PPARγ基因表达Table 6 Telm isartan regulates NF-κB and PPARγgene expression ±s,%)

表6 替米沙坦调节NF-κB和PPARγ基因表达Table 6 Telm isartan regulates NF-κB and PPARγgene expression ±s,%)
*P<0.05 vs sham group #P<0.05 vs vehicle group and telmisartan+GW9662 group by q testPPARγ:peroxisome proliferator-activated receptors;NF-κB:nuclear factor κB
Groups NF-κB PPARγ Sham 1.00±0.76 1.00±0.25 Vehicle 4.25±1.16*0.16±0.02*Telmisartan 1.43±0.75#0.71±0.17#Telmisartan+GW9662 3.20±0.68*0.21±0.14*
3 讨 论
NF-κB是脑缺血后启动炎症反应的关键因子,其中p65是NF-κB在脑组织内的主要活性亚基之一。正常情况下,NF-κB与κB抑制因子(I-κB)结合以非活性形式存在于细胞浆,在缺血缺氧刺激下,NF-κB与I-κB分离而激活后,向细胞核内转位,调节下游白细胞介素8、血管细胞黏附分子1、肿瘤坏死因子α等炎症介质的表达。同时,这些炎症反应的产物又再次激活NF-κB,使炎症反应形成持续放大的态势[3,8-9]。有研究[10-11]发现,NF-κB基因敲除能够显著减小脑梗死体积和炎症反应。进一步证明NF-κB是脑缺血后炎症反应和氧化应激过程的重要参与者。
PPARγ是关键性核转录因子,活化后表现出抗炎、抗氧化、神经保护等独特优势,在保护缺血脑组织方面发挥的作用突出而得到越来越多的关注。研究发现,PPARγ有效调节下游炎症因子、抑制炎症反应与抑制NF-κB有关,具体机制包括抑制I-κB分解、p65亚基向细胞核内转位以及与特定DNA序列的结合等。Remels等[12]在骨骼肌细胞中证实PPARγ的抗炎症反应通过抑制NF-κB活性发挥作
用。Zhang等[13]通过脑缺血的研究发现,GW9662成功阻断了吡格列酮抑制NF-κBp65活性的抗炎症反应作用,进一步证实PPARγ是NF-κB的上游调控基因。
PPARγ以结合配体的形式活化,目前确定的作用最强的PPARγ天然性配体是15d-PGJ2,最常见的合成性配体是噻唑烷二酮类化合物(thiazoli dinediones,TZDs)。脑缺血后PPARγ的DNA结合能力显著下降,而激活剂包括15d-PGJ2和TZDs,如罗格列酮能够全面恢复PPARγ的DNA结合能力,是其发挥抗炎症反应等作用的关键机制[14-16]。
替米沙坦不仅通过阻断血管紧张素Ⅱ有效调控血压,保护缺血脑组织,而且越来越多的研究发现其表现出显著的抗炎症反应和氧化应激的特点,是惟一具有PPARγ活化作用的血管紧张素Ⅱ受体拮抗剂类药物。Maejima等[17]证实,替米沙坦通过激活PPARγ途径抑制心肌梗死后基质金属蛋白酶9等炎症因子表达,改善心室重构。更多的脑缺血的研究已经证实,替米沙坦能够显著减小脑缺血体积,减轻脑缺血后炎症反应[1-2]。本实验结果与之一致,替米沙坦能够显著改善神经功能缺失、减轻脑水肿和减小脑梗死体积,并有效下调脑缺血后高表达的NF-κB,上调PPARγ,而与PPARγ特异性阻断剂联合干预使替米沙坦的保护作用以及对NF-κB表达的抑制作用消失。因此,替米沙坦通过激活PPARγ抑制NF-κB的活性和表达,是其发挥抗炎症反应和脑保护作用的重要机制。
[1]HARAGUCHIT,IWASAKIK,TAKASAKIK,et al.Telmisartan,a partial agonist of peroxisome proliferator-activated receptor gamma,improves impairment of spatialmemory and hippocampal apoptosis in rats treated with repeated cerebral ischemia[J]. Brain Res,2010,1353(24):125-132.
[2]KOBAYASHIT,KAWAMATA T,SHIBATA N,et al.AngiotensinⅡtype 1 receptor blocker telmisartan reduces cerebral infarct volume and peri-infarct cytosolic phospholipase A(2)level in experimental stroke[J].JNeurotrauma,2009,26(12):2355-2364.
[3]LIU Y,ZHANG XJ,YANG CH,et al.Oxymatrine protects rat brains against permanent focal ischemia and downregulates NF-kappaB expression[J].Brain Research,2009,1268:174-180.
[4]YANG C,ZHANG X,FAN H,et al.Curcumin upregulates transcription factor Nrf2,HO-1 expression and protects rat brains against focal ischemia[J].Brain Research,2009,1282(28):133-141.
[5]WANG L,ZHANG X,LIU L,etal.Atorvastatin protects ratbrains against permanent focal ischemia and downregulates HMGB1, HMGB1 receptors(RAGE and TLR4),NF-kappaB expression[J].Neuroscience Letters,2010,471(3):152-156.
[6]WANG L,ZHANG X,LIU L,et al.TanshinoneⅡA downregulates HMGB1,RAGE,TLR4,NF-kappaB expression,ameliorates BBB permeability and endothelial cell function,and protects rat brains against focal ischemia[J].Brain Research,2010,1321(19):143-151.
[7]CUIL,ZHANG X,YANG R,et al.Neuroprotection of early and short-time applying atorvastatin in the acute phase of cerebral ischemia:down-regulated 12/15-LOX,p38MAPK and cPLA2 expression,ameliorated BBB permeability[J].Brain Research,2010,1325(14):164-173.
[8]MALEK R,BOROWICZ KK,JARGIELLO M,et al.Role of NF-kappaB in the central nervous system[J].Pharmacol,2007,59(1):25-33.
[9]MATTSON MP,CAMANDOLAS.NF-kappaB in neuronal plasticity and neurodegenerative disorders[J].J Clin Invest,2001,107(3):247-254.
[10]SCHNEIDER A,MARTIN-VILLALBA A,WEIH F,et al.NF-kappaB is activated and promotes cell death in focal cerebral ischemia[J].Nat Med,1999,5(5):554-559.
[11]STEPHENSON D,YIN T,SMALSTIG EB,et al.Transcription factor nuclear factor-kappaB is activated in neurons after focal cerebral ischemia[J].JCereb Blood Flow Metab,2000,20(3):592-603.
[12]REMELS AH,LANGEN RC,GOSKER HR,et al.PPARgamma inhibits NF-kappaB-dependent transcriptional activation in skeletalmuscle[J].Am JPhysiol Endocrinol Metab,2009,297(1):E174-183.
[13]ZHANG HL,XU M,WEI C,et al.Neuroprotective effects of pioglitazone in a ratmodel of permanent focal cerebral ischemia are associated with peroxisome proliferator-activated receptor gamma-mediated suppression of nuclear factor-kappaB signaling pathway[J].Neuroscience,2011,176(10):381-395.
[14]VICTOR NA,WANDERIEW,GAMBOA J.Altered PPARgamma expression and activation after transient focal ischemia in rats[J].Eur JNeurosci,2006,24(6):1653-1663.
[15]OU Z,ZHAO X,LABICHE LA,et al.Neuronal expression of peroxisome proliferator-activated receptor-gamma(PPARgamma)and 15d-prostaglandin J2--mediated protection of brain after experimental cerebral ischemia in rat[J].Brain Res,2006,1096(1):196-203.
[16]ZHAO Y,PATZER A,HERDEGEN T,et al.Activation of cerebral peroxisome proliferator-activated receptors gamma promotes neuroprotection by attenuation of neuronal cyclooxygenase-2 overexpression after focal cerebral ischemia in rats[J].FASEB J,2006,20(8):162-75.
[17]MAEJIMA Y,OKADA H,HARAGUCHIG,et al.Telmisartan,a unique ARB,improves left ventricular remodeling of infracted heart by activating PPARgamma[J].Lab Invest,2011,91(6):932-944.
(本文编辑:刘斯静)
THERAPEUTIC EFFECT AND MECHANISMSOF TELM ISARTAN ON FOCAL CEREBRAL ISCHEM IA IN RATS
ZHU Chunhua,WEN Ya,WANG Lina,MA Yuexia
(Department of Neurology,the Second Hospital of HebeiMedical University,Shijiazhuang 050000,China)
ObjectiveTo explore the therapeutic effect and mechanisms of telmisartan on focal cerebral ischemia of rats.M ethodsMale Sprague-Dawley rats were subjected to permanent middle cerebral artery occlusion(MCAO).Telmisartan was systemically administered to explore the effect on nuclear factorκB(NF-κB)and peroxisome proliferator-activated receptors(PPARγ)expression at 24h after cerebral ischemia by immunohistochemistry,western blot and qRT-PCR.And the neurological deficits,brain water content and infarct volume were explored.MethodsAt 24h after focal cerebral ischemia,NF-κB expression increased and PPARγdecreased.NF-κB expression was dramatically decreased and PPARγwas increased by telmisartan adminstration,and the neurological deficits,brain water content and infarct volume were alleviated,which were all reversed by GW9662(PPARγspecial antagnist)co-administration.ConclusionPPARγis the up-stream regulator controlling NF-κB expression.Telmisartan inhibited NF-κB expression by PPARγpathway in protecting brain against ischemia.
brain ischemia;NF-κB;peroxisome proliferator-activated receptors
R743.33
A
1007-3205(2013)05-0497-04
2013-03-19;
2013-04-15
祝春华(1978-),女,河北唐山人,河北医科大学第二医院主治医师,医学博士,从事脑血管病诊治研究。
10.3969/j.issn.1007-3205.2013.05.001

