羊乳以及羊奶粉中黄曲霉毒素M1和黄曲霉毒素B1的HPLC柱后碘衍生化法检测
陈 娴肖丽恒
1.云南省昆明市食品药品检验所,云南 昆明 650032;2.云南省楚雄州质量技术监督综合检测中心,云南 楚雄 675000
羊乳以及羊奶粉中黄曲霉毒素M1和黄曲霉毒素B1的HPLC柱后碘衍生化法检测
陈 娴1肖丽恒2
1.云南省昆明市食品药品检验所,云南 昆明 650032;2.云南省楚雄州质量技术监督综合检测中心,云南 楚雄 675000
目的:建立羊乳以及羊奶粉中黄曲霉毒素M1和黄曲霉毒素B1含量的HPLC测定方法。方法:采用高效液相色谱仪配荧光检测器,以Diamonsil(R)C18(250mm×4.6mm,5um)为色谱柱,流动相为水和甲醇,流速1.0mL/min,激发波长365nm,发射波长435nm作为分析条件,以0.05%碘溶液为衍生化试剂。结果:黄曲霉毒素M1、B1在0~10μg/kg范围内线性关系良好,相关系数均大于0.999;回收率均在76.5%~84.8%之间;检出限AFM1、AFB1分别为0.05、0.02μg/kg。结论:该法具有准确、灵敏、重复性好等优点,适合羊乳以及羊奶粉中的黄曲霉毒素M1、B1含量的检测.
液相色谱法;黄曲霉毒素M1;黄曲霉毒素B1;羊奶;羊奶粉
黄曲霉毒素(aflatoxin,AF)是一类化学结构类似的二氢呋喃香豆素的衍生物。是目前所发现的毒性最大的真菌毒素,且该毒素为黄曲霉和寄生曲霉中产毒菌株的代谢产物,普遍存在于霉变的粮食及粮食制品中,可以通过多种途径污染食品和饲料,直接或间接进入人类食物链,威胁人类健康和生命安全,特别对人体及动物内脏器官尤其是肝脏损害严重。黄曲霉毒素是剧毒物质,其毒性相当于氰化钾的10倍,砒霜的68倍。黄曲霉毒素肝脏毒除抑制DNA、RNA的合成外,也抑制肝脏蛋白质的合成,长期摄入黄曲霉毒素会诱发肝癌,是目前公认的致癌性最强的物质之一。黄曲霉毒素主要有4种:即B1、B2、C1、G2,其中B1被认为是主要的有毒物质,主要存在于农产品,动物饲料,中药等产品中。黄曲霉毒素M1是动物摄入黄曲霉毒素B1后在体内经羟基化代谢的产物,一部分从尿和乳汁排出,一部分存在于动物的可食部分,如乳、肝、蛋类、肾、血和肌肉中,其中以乳最为常见。黄曲霉毒素M1的毒性和致癌性与黄曲霉毒素B1的基本相似。
由于乳及其制品是人类,特别是婴儿的主要食品,所以危害性更大。中国、美国规定人类消费的乳及乳制品中的黄曲霉毒素M1含量不能超过0.5μg/kg[1],欧盟国家规定更加严格,在婴儿配方食品及改进配方食品以及在具有特殊医疗目的的婴儿食品中,黄曲霉毒素M1的最大限量为0.025μg/kg,要求具有特殊医疗目的的婴儿食品中黄曲霉毒素B1的最大限量。目前黄曲霉毒素M1、B1的分析一般采用薄层色谱法(TLC)[2]、高效液相色谱法(HPLC)[3-6]、气相色谱法 (GC)[7]、酶联免疫法(ELISA)、放射免疫检测法[8]、以及液相色谱串联质谱检测法[9-10]。TLC所需仪器设备简单,具有较好的分离和专一性,在基层比较常用,但灵敏度低,步骤多,试剂耗费大,干扰因素多,测定时间长,荧光强度的目测准确性比较差,主要用于定性;ELISA灵敏度较高,快速,经济,但存在重复性较差、试剂寿命短、需要低温保存等缺点[11];放射免疫法的样品前处理提取方法简便,具有灵敏度高、特异性强的特点,只能应用于初筛分析[8];而国标所用的免疫亲和柱-液相色谱串联质谱法灵敏度高,特异性好,但是免疫亲和柱价格昂贵,需低温保存,净化操作程序繁琐[9]。因此,本文选择水和甲醇提取,通过石油醚除脂,氯仿纯化作为前处理手段,液相色谱碘衍生化荧光检测法作为检测技术,建立了一种操作简单、灵敏度高、特异性好、适于批量样品检测的检测方法。
1 实验部分
1.1 仪器与设备 LC-20A岛津液相色谱仪及LC-solution化学工作站;CBM-20A系统控制器;RF-10Axl配荧光检测器;SIL-20AC自动进样器;CTO-20AC恒温柱温箱;GDU-20A5真空在线脱气机;CRB-6A柱后衍生化系统、在线自动混合器;样品均质器;漩涡混合器 (或高速搅拌器);高速离心机;氮气吹干仪;超声波清洗器;精密移液器;;真空抽滤泵;EasyDI8超纯水机。
1.2 材料与试剂 黄曲霉毒素标准储备溶液(10μg/mL),次氯酸钠溶液 (50 g/L),乙腈、甲醇为色谱纯,其余试剂
均为分析纯,水为去离子水。
1.3 色谱条件 Diamonsil(R)C18色谱柱(250mm× 4.6mm,5μm);流动相为甲醇:水(45:55);进样量:20μl;流速:1.0m L/min;激发波长365nm,发射波长435nm;衍生化溶液为0.05%碘溶液(避光冷藏保存);衍生溶液流速:0.3mL/min;衍生化反应器温度:70℃。
1.4 样品处理 准确称取羊乳粉试样5.0g于50mL离心管中,准确加入5mL水和20 mL甲醇,漩涡混合5min后,超声萃取10min,在6500r/min钟下离心10min。收集上清液并移入50mL比色管中,待净化。
准确称取羊奶试样10.0g于50mL离心管中,准确加入20mL甲醇,漩涡混合5min后,超声萃取10min,在6500r/min下离心10min。收集上清液并移入50mL比色管中,待净化。
净化处理:在比色管中加入20mL石油醚,再加入10mL饱和的氯化钠溶液,振摇2 min,待分层后,弃去石油醚层。重复用石油醚提取2次,每次10mL,弃去石油醚层。在下层溶液中加入氯仿20m L,在漩涡混合2min后。待分层以后,取出氯仿层于100mL的烧杯中,再每次用10 mL氯仿提取两次,并取出氯仿放入之前的烧杯中,在65℃水浴中将氯仿溶剂在氮吹下蒸干。用精密移液器取1mL流动相溶解,超声波超声1min,过0.45 um的有机系滤膜,20μL进样上液相色谱仪检测。
2 结果与讨论
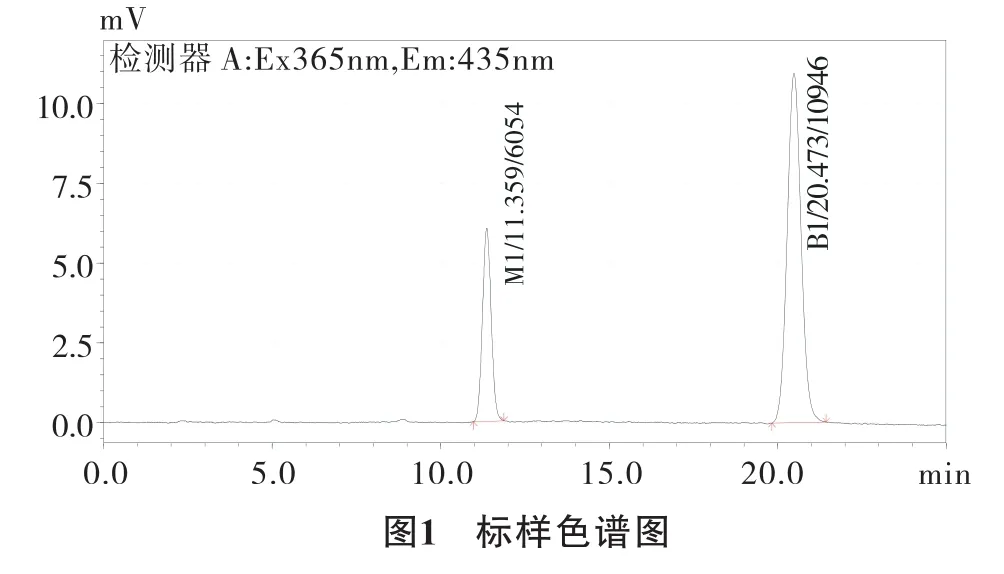
2.1 流动相的选择 用液相色谱仪自动进样20μL检测黄曲霉毒素标准工作溶液,选用乙腈和水作为流动相时,黄曲霉毒素的色谱峰拖尾严重。选用甲醇和水作为流动相,选择甲醇和水的比例为20:80时,出峰时间比较长,峰展宽较大。当甲醇的比例增加时,黄曲霉毒素出峰时间加快,当甲醇和水的比例为45:55时,黄曲霉毒素M1出峰时间为11.359min,黄曲霉毒素B1出峰时间为20.473min,分离效果好,出峰时间比较合理,标样色谱图如图(1)。
2.2 萃取方式的选择 黄曲霉毒素易溶于油、甲醇、丙酮和氯仿等有机溶剂,但不溶于石油醚、己烷和乙醚中。利用甲醇和水作为样品提取溶剂,在漩涡混合使其充分混合,采用超声波超声提取10min,6500r/min离心10min,能够充分的提取黄曲霉毒素,并减少蛋白的影响。
2.3 纯化方法的优化 黄曲霉毒素主要使用固相萃取柱(SPE)进行分离纯化,其固相萃取 (SPE)产品有两类:一种是多功能净化柱 (MFC),其特点以极性、非极性及离子交换等几类基团组成填充剂,可选择性吸附样液中的脂类、蛋白类等杂质,黄曲霉毒素不被吸附而直接通过,从而达到净化目的。另一是免疫亲和柱 (IAC),其特点是将特异性的黄曲霉毒素单克隆抗体与载体蛋白偶联并填柱而成。由于抗原抗体有一一对应的特异性吸附关系,所以IAC只能特效性地、高选择性地吸附黄曲霉毒素,而让其它杂质通过柱子,使样品得以纯化。这种吸附又可以被极性有机溶剂洗脱,进行定量检测[9]。使用SPE进行分离纯化,价格昂贵,并且只能使用一次。于是本实验利用黄曲霉毒素不溶于石油醚的性质,用石油醚除去样品溶液中的脂肪,再进一步使用氯仿提纯,使能溶于水而不溶于氯仿的杂质分离,纯化了样品溶液,减少了杂质在检测时的干扰。
2.4 校准曲线和检出限 取黄曲霉毒素标准储备液进行逐级稀释,并配置浓度为0.1μg/L、0.5μg/L、1.0μg/L、5.0μg/L、10.0μg/L的标准混合液,在选定的色谱条件下,以峰面积对质量浓度绘制标准曲线,线性关系良好,校准曲线和检出限如表1。

表1 黄曲霉毒素混合标准曲线回归方程
2.5 加样回收试验和精密度 样品中加入0.5、2.5、5.0μg/L黄曲霉毒素M1、B1,回收率在76.5%~84.8%,精密度在2.44%~4.18%,满足实验方法要求。加样回收率和精密度见表2。羊奶粉所做空白图如图2,羊奶粉加标图3。
Determination of Aflatoxin M1 and B1 in goat milk and goat milk powder by HPLC
CHEN Xian1,XIAO Li-heng2
(1.Kunming food and drug administration,Kunming 650032,China;2.Chuxiong quality of the technical supervision and inspection center,Chuxiong 675000,China)
Objective To establish the method for the determination of two aflatoxin in goat milk and goat milk powder by HPLC. Method The analyse equipment included the HPLC instrument and Diamonsil(R)C18 chromatogram(250mm*4.6mm,5um). The flowing phase is water and CH3OH and the rate is1.0 mL/min,excitating wave is365nm,emissing wave is435nm,the derived reagent is 0.05%Iodine solution.Result The linearity of AFM1 and AFB1 quantity between 0~10μg/kg were good.The correlation relativity was all above 0.999;The ratio of callbacking of two aflatoxin were all between 76.5%~84.8%.The determining limits of AFM1 and AFB1 in the samples were 0.05 and 0.02ug/kg.Conclusion The method is exact、sensitive and repletion is very good,It can be used to determine the quantity of AFM1 and AFB1 in the goat milk and goat milk powder.
HPLC;SFM1;AFB1;goat milk;goat milk powder
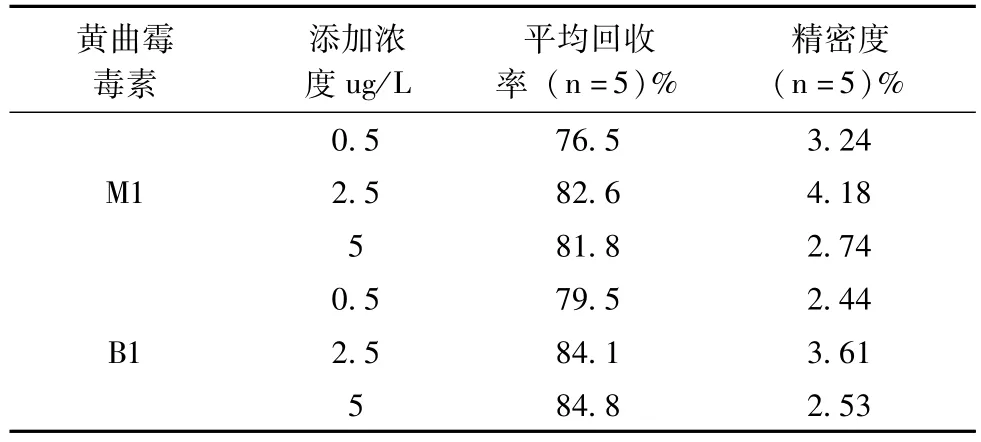
表2 样品中黄曲霉毒素添加回收率和精密度 (n=5)
R917
A
1007-8517(2013)13-0033-03

